Fortgeschrittenes Nierenzellkarzinom: Cabozantinib verbessert das Gesamtüberleben
„Die Therapielandschaft wird aufgemischt durch neue Substanzen“, betonte Prof. Andreas Jan Schrader, Münster, und verwies zugleich auf die von der europäischen Kommission (EMA) im September erteilte Zulassung für Cabozantinib (Cabometyx®) zur Behandlung des fortgeschrittenen Nierenzellkarzinoms (RCC) bei Erwachsenen nach vorangegangener Anti-VEGF-Therapie. Mit Cabozantinib wurde ein neuartiger TKI entwickelt, der neben den Kinasen der VEGF-Rezeptoren 1–3 auch die Aktivität der Tyrosinkinasen MET und AXL blockiert.
In präklinischen Modellen wurde nachgewiesen, dass Cabozantinib die Aktivität dieser Rezeptoren hemmt, die an der normalen Zellfunktion sowie an pathologischen Prozessen wie Tumorangiogenese, Tumorinvasivität, Metastasierung und Arzneimittelresistenz beteiligt sind. „Die kombinierte Blockade von VEGFR und c-MET sowie AXL hat ein hohes therapeutisches Potenzial bei therapienaiven, aber auch bei vorbehandelten und hochaggressiven Nierenzellkarzinomen“, fasste Schrader die präklinischen Daten zusammen.
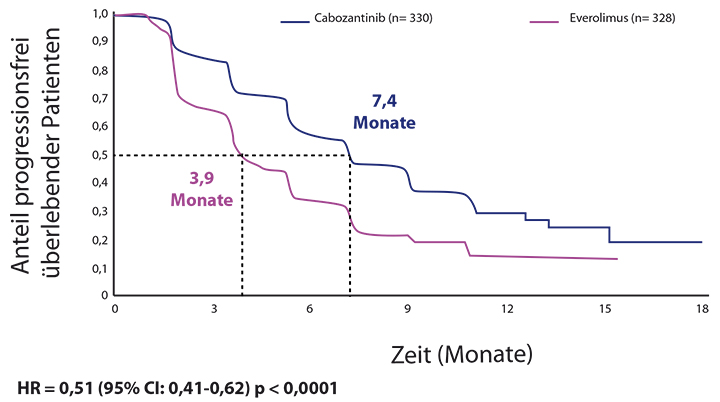
Die wissenschaftliche Rationale für die Zulassung brachte die weltweite, randomisierte Phase-III-Studie METEOR mit 658 Patienten mit RCC, bei denen mindestens eine vorangegangene Therapie mit einem VEGFR-TKI versagt hatte. Das progressionsfreie Überleben (PFS) bei den ersten 375 behandelten Patienten wurde als primärer Endpunkt definiert. Sekundäre Endpunkte waren das Gesamtüberleben (OS) und die objektive Ansprechrate (ORR) bei allen in die Studie aufgenommenen Patienten. Die Patienten erhielten randomisiert im Verhältnis 1 : 1 entweder einmal täglich 60 mg Cabozantinib oder einmal täglich 10 mg Everolimus. Im Vergleich zu Everolimus führte Cabozantinib zu einer Reduktion des Risikos von Krankheitsprogression oder Tod um 42% [1].Das mediane PFS für Cabozantinib betrug 7,4 Monate im Vergleich zu 3,8 Monaten für Everolimus, erläuterte Prof. Viktor Grünwald, Hannover.
Verglichen mit Everolimus verbesserte Cabozantinib auch die objektive Ansprechrate signifikant (24% vs. 4%, p < 0,0001). Wie Grünwald anhand der Studiendaten darlegte, zeigte Cabozantinib außerdem einen statistisch signifikanten und klinisch relevanten Vorteil beim Gesamtüberleben. Verglichen mit Everolimus führte Cabozantinib zu einer Reduktion des Sterberisikos um 34%. Das mediane OS für Patienten, die mit Cabozantinib behandelt wurden, lag bei 21,4 im Vergleich zu 16,5 Monaten bei Everolimus [2]. Der Therapieeffekt war unabhängig von der Vortherapie. Es traten keine unerwarteten Toxizitäten auf. Die häufigsten unerwünschten Ereignisse waren Diarrhö, Fatigue und Hypertonie für Cabozantinib sowie Fatigue, Anämie und Husten für Everolimus. Bei 62% bzw. 25% der Patienten erfolgte eine Dosismodifikation. Laut Grünwalds Erfahrungen könne man mit der Dosis heruntergehen – ohne Einbrüche in der Wirksamkeit zu bekommen. „Mit der Zulassung hat man als Therapeut eine neue Therapieoption, wenn die Initialtherapie versagt hat. Und sie ist Everolimus hinsichtlich ORR, PFS, und OS signifikant überlegen“, resümierte er.
Martina Eimer
Literatur
1. Choueiri TK et al. N Engl J Med 2015; 373: 1814-23.
2. Choueiri TK et al. Lancet Oncol 2016; 17; 917-27.
Einführungs-Pressekonferenz „Cabometyx®: Resistenzen überwinden – Progression verzögern – Leben verlängern“ am 29.09.2016 in Leipzig, veranstaltet von Ipsen Pharma GmbH, Ettlingen.