Aktuelle Prinzipien der Immuntherapie am Beispiel des metastasierten Melanoms
Die Inzidenz des Melanoms stieg in den letzten Jahren kontinuierlich an [1]. Melanome entstehen klassischerweise an der Haut, treten jedoch auch an Schleimhäuten, Lymphknoten, der Uvea sowie sehr selten an den Meningen auf. Die Klassifikation von primären Melanomen erfolgt anhand von Tumordicke, Ulzeration und Mitoserate nach der Klassifikation des American Joint Committee on Cancer (AJCC) von 2009 [2]. Sofern ein Melanom im frühen Stadium diagnostiziert und durch operative Therapie mit leitliniengerechtem Sicherheitsabstand entfernt wird, ist die Erkrankung in über 90% der Fälle heilbar [3]. Liegt ein Melanom im fortgeschrittenen Stadium vor, so ist die Prognose wesentlich schlechter. Im Kontext des nur geringen Ansprechens auf Chemotherapien und der relativ geringen Strahlensensitivität des Melanoms ist durch die nun verfügbaren Therapieoptionen mit zielgerichteten Inhibitoren (BRAF-/MEK-Inhibitoren) und Immuntherapien (CTLA-4- und PD-1-Inhibitoren, onkolytische Viren) eine neue Ära angebrochen.
Melanome scheinen sich aus verschiedenen Gründen besonders für Immuntherapien zu eignen: So kommt es bei kutanen Primärtumoren, aber auch bei Metastasen zu spontanen Regressionen [4]. Tumorregressionen sind assoziiert mit immunologischer Tumorkontrolle und histologisch gekennzeichnet durch ein entzündliches Infiltrat, insbesondere durch Tumor-infiltrierende Lymphozyten (TILs; [5]). Immunsupprimierte Patienten zeigen ein erhöhtes Risiko, Melanome zu entwickeln und daran zu versterben [6]. Der Grund für diese Immunogenität des Melanoms liegt wahrscheinlich in der UV-induzierten genetischen Instabilität mit der Entwicklung einer Vielzahl von Mutationen. Diese können zu einer erhöhten Rate präsentierter tumorspezifischer immunogener Peptide und somit zur verbesserten Erkennung des Tumors durch das Immunsystem führen [7].
Zur adjuvanten Immuntherapie des primären Melanoms ist ab einer Tumordicke von 1,5 mm seit Jahrzehnten die subkutane Gabe von Interferon α zugelassen, was zu einer geringen Verlängerung des progressionsfreien (PFS) und des Gesamtüberlebens (OS) führt [8]. Interleukin-2 wird vor allem erfolgreich zur intraläsionalen Therapie von In-transit-Metastasen eingesetzt [9], in den USA wurde es bis zur Zulassung der Immuncheckpoint-Blocker auch systemisch im Stadium IV appliziert. Für Patienten im Stadium III zeichnet sich eine neue Therapieoption ab, die in den USA auch bereits zugelassen ist, nämlich die adjuvante Therapie mit dem CTLA-4-Antikörper Ipilimumab (siehe unten). Hier hat sich ein klarer Vorteil im Gesamtüberleben für Ipilimumab-behandelte Patienten gezeigt, mit einem Überlebensvorteil von mehr als 10% nach fünf Jahren [10]. Aktuell wird die adjuvante PD-1-Blockade mit Pembrolizumab bei Hochrisikopatienten geprüft (NCT02362594).
Für die Therapie bei Metastasierung sind neben Ipilimumab auch die PD-1-Antikörper Pembrolizumab und Nivolumab zugelassen. Zudem steht zur Therapie kutan oder nodal metastasierter inoperabler Melanome das onkolytische Virus Talimogene laherparepvec (T-VEC) zur Verfügung. Neue Therapieoptionen wie weitere Checkpoint-Inhibitoren, der adoptive T-Zell-Transfer und Tumorvakzinierungen sind im Rahmen klinischer Studien verfügbar. Dieser Artikel gibt einen Überblick über die aktuellen Entwicklungen in der Immuntherapie des Melanoms.
Immuncheckpoint-Blockade
CTLA-4-Antikörper
CTLA-4 wird auf T-Zellen exprimiert und insbesondere nach Antigen-Erkennung hochreguliert, um die T-Zell-Aktivierung zu stoppen. Durch Konkurrenz mit CD28 an der Bindungsstelle von CD80/CD86 bewirkt es die Hemmung der T-Zell-Antwort und die gleichzeitige Aktivierung von regulatorischen T-Zellen [11]. Ipilimumab ist ein gegen CTLA-4 gerichteter monoklonaler Antikörper, der 2011 als erster Immuncheckpoint-Inhibitor in Deutschland zugelassen wurde. Ipilimumab war auch die erste Substanz, die das Überleben beim metastasierten Melanom signifikant verlängerte: bei vorbehandelten Patienten auf 10,1 versus 6,4 Monate in der Vergleichsgruppe mit gp100-Vakzinierung [12]. Trotz einer nur geringen objektiven Ansprechrate von etwa 10% kommt es bei etwa 20% der Patienten zu einer langfristigen Tumorkontrolle [13]. Dabei profitieren Patienten mit erhöhter Serum-Laktatdehydrogenase wahrscheinlich weniger von einer Ipilimumab-Therapie [14]. Ipilimumab wird als Infusion in der Dosierung 3 mg/kg alle drei Wochen über einen Zeitraum von drei Monaten appliziert. Anschließend erfolgt eine Verlaufskontrolle der Patienten, die mindestens eine Stabilisierung ihrer Erkrankung zeigen. Unklar ist, ob eine regelmäßige Erhaltungstherapie das Ansprechen verbessern kann [15]. Ipilimumab wird aktuell in der Erstlinie insbesondere in der Kombination mit dem PD-1-Antikörper Nivolumab gegeben (siehe unten).
PD-1-Antikörper
PD-1 ist ebenfalls ein ko-inhibitorischer Rezeptor auf T-Zellen. Seine Liganden PD-L1 und PD-L2 sind auf einer Vielzahl von Geweben sowie auf Tumorzellen solider und hämatologischer Tumoren exprimiert [16]. PD-1 ist im normalen Organismus für die Inhibition bereits aktivierter T-Zellen verantwortlich, um überschießende Immunantworten wie bei Autoimmunreaktionen zu verringern [17]. PD-1 wird durch Interferon γ und Typ-I-Interferone physiologischerweise hochreguliert [11].
Der PD-1/PD-1-Ligand (PD-L1, PD-L2)-Signalweg spielt eine kritische Rolle in der Umgehung der Immunkontrolle durch Tumorzellen [18]. Durch Bindung von PD-L1/PD-L2 an PD-1 wird die
T-Zell-Aktivierung via T-Zell-Rezeptor inhibiert. Die Blockade der PD-1/PD-L1-Interaktion bewirkt eine verstärkte Immunantwort und damit eine immunologische Kontrolle des Tumors.
Pembrolizumab und Nivolumab sind gegen PD-1 gerichtete monoklonale Antikörper. Neben der seit 2015 bestehenden Zulassung zur Therapie des metastasierten Melanoms sind sie ebenfalls für die Therapie des nicht-kleinzelligen Bronchialkarzinoms und des Nierenzellkarzinoms (Nivolumab) zugelassen. Beim Melanom führt die PD-1-Blockade unabhängig vom Vorliegen einer BRAF-Mutation zur Verlängerung von progressionsfreiem (PFS) und Gesamtüberleben (OS); die Ansprechraten liegen bei 31–40% (Abb. 1), die 1-Jahres-Überlebensraten bei bis zu 74% [19–23], etwa 60% der Patienten überleben zwei Jahre [20, 24]. Patienten, die zuvor eine Immuntherapie mit Ipilimumab erhalten hatten, zeigten etwas niedrigere Ansprechraten von 26% [22] beziehungsweise 32% [25]. Pembrolizumab wird beim Melanom alle drei Wochen als Infusion in einer Dosierung von 2 mg/kg und Nivolumab alle zwei Wochen als Infusion von 3 mg/kg appliziert. Aktuell werden im Rahmen von Studien auch PD-L1/-L2-Antikörper geprüft.
Die Kombination von Ipilimumab und Nivolumab ist in Deutschland seit Juni 2016 zur Therapie des metastasierten Melanoms zugelassen. Die Kombinationstherapie erzielt deutlich höhere Ansprechraten (61%), ist allerdings auch mit einer höheren Toxizität verbunden. 54% der Patienten entwickelten in der Zulassungsstudie höhergradige Toxizitäten (CTC-AE Grad 3–4; [26]). Die Kombinations-Immuntherapie zeigt ein längeres PFS als die Monotherapie mit einem
PD-1-Antikörper und insbesondere als die Monotherapie mit Ipilimumab (11,5 versus 6,9 versus 2,9 Monate; [27]).
Ob die PD-L1-Expression im Tumor als prädiktiver Marker beim Melanom verwendet werden soll, ist momentan fraglich. Die Expression von PD-L1 korrelierte in einigen Studien mit dem Therapieansprechen [20, 28]. Allerdings kam es auch bei einigen PD-L1-negativen Patienten zum Ansprechen unter der PD-1-
Antikörper-Therapie. Weiterhin wird eine Heterogenität der PD-L1-Expression innerhalb verschiedener Metastasen eines Patienten beobachtet [29]. Zudem sind die immunhistochemischen Nachweismethoden nicht standardisiert.
Eventuell könnte bei hoher PD-L1-Expression die PD-1-Inhibitor-Monotherapie ähnlich effektiv sein wie die Kombinationstherapie, während bei niedriger PD-L1-Expression ein höherer Benefit von der Kombinations-Immuntherapie zu erwarten ist [27]. Weitere Studien sind notwendig, um diesen Zusammenhang zu untersuchen.
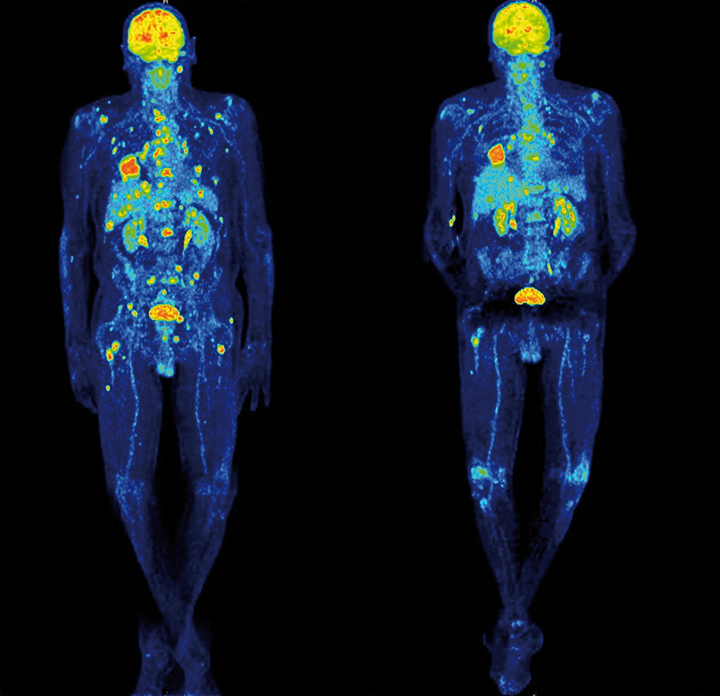
Immun-vermittelte unerwünschte Wirkungen der Immuncheckpoint-Blockade
Die Immuncheckpoint-Blockade mit Ipilimumab oder PD-1-Antikörpern ist aufgrund ihres Wirkmechanismus häufig mit immun-vermittelten Nebenwirkungen (irAEs) verbunden. Typische Nebenwirkungen von Ipilimumab sind Diarrhö/Kolitis, Dermatitis, Hepatitis und Endokrinopathien (z. B. Thyreoiditis, Hypophysitis; [12]). Unter PD-1-Antikörpern treten im Vergleich zu Ipilimumab seltener irAEs auf, bei Kombination von Ipilimumab und Nivolumab haben mehr als die Hälfte der Patienten schwere Nebenwirkungen [19]. Typische durch
PD-1-Antikörper induzierte Nebenwirkungen sind Thyreoiditis und Pneumonitis, in der Kombination der beiden Substanzen ist insbesondere die Hepatitis mit bis zu 20% Grad-3/4-Ereignissen häufig [24].
In der Regel sind alle irAEs gut therapierbar, sofern sie schnell behandelt werden. Je nach Schweregrad reicht eine symptomatische Behandlung oder Therapieunterbrechung und systemische Immunsuppression mit Kortikosteroiden und gegebenenfalls weiteren immunsuppressiven Präparaten aus. Selten können sie jedoch schwerwiegend verlaufen, auch therapiebedingte Todesfälle wurden beschrieben. Sofern man nach den publizierten Algorithmen zum Nebenwirkungsmanagement vorgeht [30], sind Nebenwirkungen mit Ausnahme der Residualzustände nach Endokrinopathien in der Regel reversibel [31].
Weitere Entwicklungen bei kostimulatorischen und koinhibitorischen Molekülen
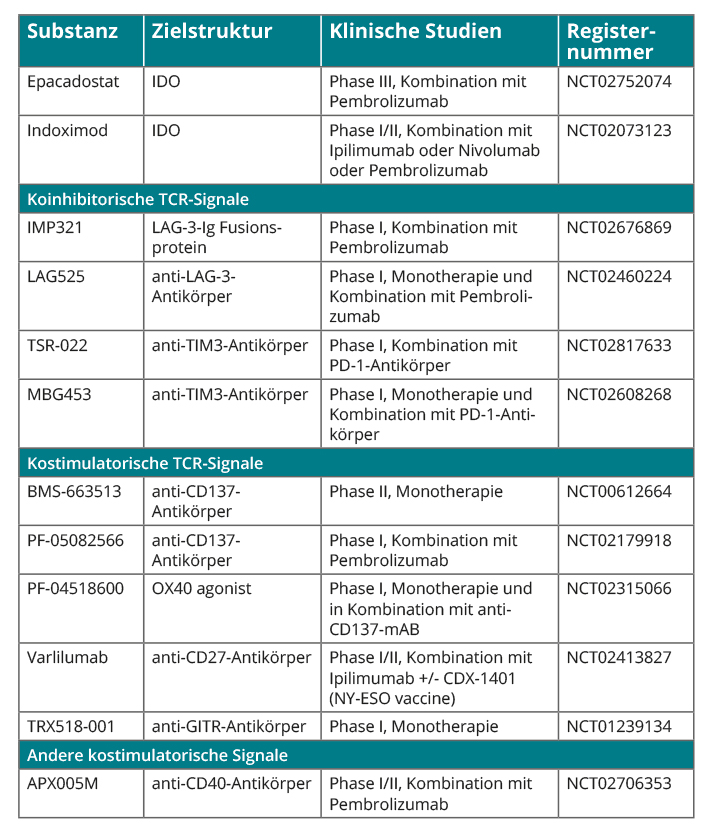
Im Rahmen der T-Zell-Aktivierung sind zwei stimulierende Signale notwendig, zum einen die Interaktion von T-Zell-Rezeptor und MHC-gebundenem Antigen, zum anderen die Kostimulation über Moleküle wie CD27, CD28 (exprimiert auf ruhenden T-Zellen) und CD137, OX40, ICOS, und GITR (induziert durch Antigen-Bindung; [32]). Die Bindung eines agonistischen Antikörpers führt zur T-Zell-Aktivierung. Weiterhin gibt es koinhibitorische Rezeptoren, über die die T-Zell-Antwort gehemmt wird [11]. Diese umfassen neben CTLA-4 und PD-1 beispielsweise TIM-3 und LAG-3. LAG-3, TIM-3 und PD-1 sind auf TILs koexprimiert und In-vitro-Daten zeigen eine erhöhte Zytokin-Produktion in tumorspezifischen T-Zellen unter kombinierter TIM-3- und PD-1-Inhibition [33]. Aktuell rekrutierende Studien mit Antikörpern gegen diese Moleküle sind in Tabelle 1 aufgeführt.
Eine andere Zielstruktur ist die Indolamin-2,3-Dioxygenase (IDO), ein in Antigen-präsentierenden Zellen im Tumorgewebe exprimiertes Enzym, das den Tryptophan-Abbau katalysiert. Seine verstärkte Aktivität führt zum Tryptophan-Mangel in der Tumorumgebung, wodurch zytotoxische T-Zellen gehemmt und regulatorische T-Zellen aktiviert werden [34]. Ein weiterer Angriffspunkt ist CD40, das auf Tumorzellen exprimiert wird und durch Bindung von T-Zellen mittels CD40L Tumorzell-Apoptose vermittelt sowie zur Generierung tumorspezifischer T-Zellen beiträgt [35]. Agonistische anti-CD40-Antikörper und rekombinanter CD40L befinden sich aktuell in der klinischen Prüfung.
Die alleinige Therapie mit Antikörpern gegen kostimulatorische/-inhibitorische Moleküle führt wahrscheinlich nicht zum klinisch signifikanten Tumorrückgang [36]; daher werden diese Substanzen in klinischen Studien in der Regel in Kombination mit PD-1-Inhibitoren geprüft (Tabelle 1).
Onkolytische Viren
Talimogene laherparepvec (T-VEC) ist das erste onkolytische Virus, das zur Immuntherapie des metastasierten Melanoms zur Verfügung steht. Seit 2016 ist es in Deutschland zur Therapie inoperabler kutaner und nodaler Melanom-Metastasen (Stadium III/IV), nicht aber bei Vorliegen viszeraler oder ossärer Metastasen zugelassen. Es wird intraläsional (kutan oder nodal) injiziert und besteht aus einem Herpes-simplex-Virus vom Typ 1, das genetisch so verändert wurde, dass es sich selektiv in Tumorzellen repliziert und dort Granulozyten-Makrophagen-Koloniestimulierenden Faktor (GM-CSF) produziert. Dadurch kommt es zum lokalen und zum Teil auch zum injektionsfernen Tumoransprechen. In der Zulassungsstudie zeigten sich Ansprechraten von 32% und ein medianes OS von 41 Monaten (versus 21,5 Monaten unter GM-CSF-Behandlung in der Vergleichsgruppe; [37]). Insbesondere Patienten mit niedrigeren Tumorstadien und niedriger Tumorlast zeigten gutes Ansprechen. Typische unerwünschte Wirkungen sind Fieber, Schüttelfrost und Fatigue nach den Injektionen. Aktuell wird die Kombination von Ipilimumab oder PD-1-Inhibitoren mit T-VEC in klinischen Studien geprüft (NCT01740297, NCT02263508).
Adoptiver T-Zell-Transfer und CAR-T-Zell-Therapie
Der adoptive T-Zell-Transfer und hier insbesondere der Einsatz autologer, in vitro expandierter Tumor-infiltrierender T-Lymphozyten (TILs), ist ein vielversprechendes, experimentelles immuntherapeutisches Verfahren, bei dem aus einer exzidierten Metastase TILs isoliert und unter GMP-Bedingungen ex vivo expandiert werden. Der Patient erhält eine lymphodepletive Chemotherapie (z. B. Cyclophosphamid plus Fludarabin) vor Reinfusion der ex vivo vermehrten TILs und nachfolgend eine Hochdosis-Interleukin-2(IL-2)-Therapie mit dem Ziel, das Überleben der infundierten TILs zu unterstützen. Zum adoptiven T-Zell-Transfer mit TILs liegen eine Vielzahl von Studien mit überzeugenden Ergebnissen vor, die Ansprechraten liegen bei 40–70%, und ein Teil der Patienten zeigt langfristige Remissionen [38]. Im Rahmen dieser Therapie treten häufig Nebenwirkungen auf, vor allem bedingt durch inflammatorische Zytokine sowie durch die parallele Gabe von IL-2. Autoimmune Nebenwirkungen treten nur selten auf. Dennoch überzeugt die Therapie durch hohe Ansprechraten, selbst bei zum Teil massiv vortherapierten Patienten [38]. Dies basiert vermutlich auf einer breiten T-Zell-Erkennung von verschiedenen Tumorantigenen [39]. Es konnte gezeigt werden, dass die Adressierung von patienten- und tumorspezifischen Neoantigenen, die durch somatische Mutationen entstehen, eine wichtige Komponente der T-Zell-Antwort darstellt [40]. Nur eine Minderheit der TILs reagiert auf definierte Melanom-assoziierte Antigene wie Differenzierungs- und Cancer/Testis-Antigene.
Noch befindet sich die TIL-Therapie in Deutschland in einem frühen Entwicklungsstadium, da für eine Zulassung zunächst hinreichende Phase-II- oder Phase-III-Studien mit standardisierten Behandlungsprotokollen und ausreichender Patientenzahl vorliegen müssen. Außerdem ist die Weiterentwicklung der Ex-vivo-TIL-Expansion notwendig, um die Qualität, insbesondere die längere Persistenz und damit längere antitumorale Aktivität der T-Zellen zu garantieren [39].
Im Gegensatz zur TIL-Therapie, für die auf einen langjährigen Erfahrungsschatz zurückgegriffen werden kann, liegen für die Therapie mit genetisch veränderten T-Zellen (Gentherapie mit TCR und chimärem Antigen-Rezeptor [CAR-T]) nur limitierte Erfahrungen vor. Bei diesen Zellverfahren werden TILs des Patienten ex vivo genetisch modifiziert, entweder mit einem Tumorantigen-spezifischen TCR oder mit einem chimären Antigen-Rezeptor, der aus einer Antikörper-Bindungsdomäne und dem intrazellulären Part des TCR besteht. Der Vorteil des CAR im Vergleich zum TCR ist, dass er durch das Antigen MHC-unabhängig aktiviert werden kann. Die meisten CAR-T-Zell-Studien gibt es bislang zu hämatologischen B-Zell-Neoplasien mit einem gegen CD19 oder CD20 gerichteten CAR [41]. In der Indikation Melanom werden aktuell Studien mit CARs gegen GD2 (Ox40-CD3-CAR; NCT02107963) und VEGF-RII (NCT01218867) durchgeführt. Das Hauptrisiko der CAR-Therapie sind sogenannte „On-target-off-tumor“-Effekte durch Erkennung des Antigens auf gesunden Körperzellen. Dies kann zu lebensgefährlichen Toxizitäten führen, insbesondere wenn Lunge, Herz oder Leber betroffen sind [41].
Tumorvakzinen
Vakzinen sind in der adjuvanten Therapie des Melanoms in den vergangenen Jahrzehnten ausgiebig und ohne relevanten klinischen Effekt untersucht worden. Mit dem Ziel der Immunstimulation zur Beseitigung von Mikrometastasen wurden Peptid-/Protein-Vakzinen, rekombinante Vektoren-basierte, dendritische Zell- und virale Vakzinen untersucht. Zielstrukturen der Vakzinen sind Melanom-spezifische Antigene, darunter Differenzierungs-Antigene (Melan-A, MART-1, gp100, Tyrosinase), Cancer/Testis-Antigene (MAGE-A3, NY-ESO-1), Antigene mit spezifischen Mutationen (Tumorzell-spezifische Antigene) sowie virale Antigene [42].
In der aktuellen Analyse der Daten aus der adjuvanten Phase-III-Studie mit MAGE-A3 beim Hochrisiko-Melanom zeigte sich eine 2-Jahres-Überlebensrate von 90% bei den geimpften wie auch bei den nicht geimpften Patienten und damit kein Überlebensvorteil [43]. Aktuelle Studien verwenden polyvalente Vakzinen (gegen diverse tumorassoziierte Antigene), dendritische Zell-Vakzinen oder patientenspezifische Vakzinen (Tumor-Neoantigene werden dabei miterfasst). Aktuell wird in Deutschland in einer Phase-I-Studie eine tetravalente RNA-Lipoplex-Vakzine gegen die Melanozyten-Antigene NY-ESO-1, MAGE-A3, Tyrosinase und TPTE geprüft (NCT02410733). RNA-beladene Lipid-Nanopartikel werden dabei intravenös verabreicht. Bei den ersten in der Phase-I-Studie behandelten Patienten konnte die Wirkungsweise dieser Substanz in vivo nachvollzogen werden [44].
Zusammenfassung und Ausblick
Immuntherapien stellen eine wichtige Säule in der Therapie des metastasierten Melanoms dar. Auch bei anderen Tumorerkrankungen kommen Immuntherapien zunehmend zum Einsatz. Trotz hoher Ansprechraten ist beim Melanom auch unter Immuntherapien nur bei einem Teil der Patienten eine langfristige Krankheitskontrolle möglich. Daher ist zukünftig eine weitere Evaluation von simultanen oder sequenziellen Kombinationstherapien der Immuntherapeutika (Checkpoint-Blockade, kostimulatorische Moleküle, T-VEC, etc.) und zielgerichteter Medikamente notwendig [45]. Die aktuell verfügbare Kombination von Ipilimumab und Nivolumab führt zu höheren Remissionsraten bei nicht unerheblicher Toxizität. Das Management der irAEs sollte anhand der publizierten Leitlinien erfolgen.
Die TIL-Therapie zeigt beim Melanom sehr gute Daten hinsichtlich eines dauerhaften Tumoransprechens und wird weltweit zunehmend eingesetzt und weiterentwickelt werden. Eine aktuelle und zukünftige Herausforderung ist die Identifikation und Evaluation von prädiktiven Biomarkern für die optimale Therapieentscheidung. Neue immunologische Zielstrukturen könnten weitere Zellen der Tumorumgebung wie NK-Zellen, Antigen-präsentierende Zellen oder regulatorische T-Zellen sein.
Literatur
1. Ferlay J et al. Cancer incidence and mortality patterns in Europe: Estimates for 40 countries in 2012. Eur J Cancer 2013; 49: 1374-403.
2. Balch CM et al. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol 2009; 27: 6199-206.
3. Tsao H et al. Management of cutaneous melanoma. N Engl J Med 2004; 351: 998-1012.
4. Kalialis LV et al. Spontaneous regression of metastases from melanoma: Review of the literature. Melanoma Res 2009; 19: 275-82.
5. Thomas NE et al. Tumor-infiltrating lymphocyte grade in primary melanomas is independently associated with melanoma-specific survival in the population-based genes, environment and melanoma study. J Clin Oncol 2013; 31: 4252-9.
6. Robbins HA et al. Melanoma risk and survival among organ transplant recipients. J Invest Dermatol 2015; 135: 2657-65.
7. Snyder A et al. Genetic basis for clinical response to CTLA-4 blockade. N Engl J Med 2015; 372: 783-###.
8. Rafique I et al. Immune checkpoint blockade and interferon-alpha in melanoma. Semin Oncol 2015; 42: 436-47.
9. Weide B et al. High response rate after intratumoral treatment with interleukin-2: Results from a phase 2 study in 51 patients with metastasized melanoma. Cancer 2010; 116: 4139-46.
10. Eggermont AM et al. Prolonged survival in stage III melanoma with ipilimumab adjuvant therapy. N Engl J Med 2016, DOI: 10.1056/NEJMoa1611299.
11. Perez-Gracia JL et al. Orchestrating immune check-point blockade for cancer immunotherapy in combinations. Curr Opin Immunol 2014; 27: 89-97.
12. Hodi FS et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010; 363: 711-23.
13. Lebbe C et al. Survival follow-up and ipilimumab retreatment of patients with advanced melanoma who received ipilimumab in prior phase II studies. Ann Oncol 2014; 25: 2277-84.
14. Kelderman S et al. Lactate dehydrogenase as a selection criterion for ipilimumab treatment in metastatic melanoma. Cancer Immunol Immunother 2014; 63: 449-58.
15. Dick J et al.. Long-lasting responses under treatment with ipilimumab: An argument against maintenance therapy? Dermatology 2015; 230: 8-10.
16. Okazaki T, Honjo T. PD-1 and PD-1 ligands: From discovery to clinical application. Int Immunol 2007; 19: 813-24.
17. Fife BT, Bluestone JA. Control of peripheral T-cell tolerance and autoimmunity via the CTLA-4 and PD-1 pathways. Immunol Rev 2008; 224: 166-82.
18. Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer 2012; 12: 252-64.
19. Robert C et al. Pembrolizumab versus ipilimumab in advanced melanoma. N Engl J Med 2015; 372: 2521-32.
20. Robert C et al. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 2015; 372: 320-30.
21. Robert C et al. Improved overall survival in melanoma with combined dabrafenib and trametinib. N Engl J Med 2015; 372: 30-9.
22. Robert C et al. Anti-programmed-death-receptor-1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: A randomised dose-comparison cohort of a phase 1 trial. Lancet 2014; 384: 1109-17.
23. Topalian SL et al. Survival, durable tumor remission, and long-term safety in patients with advanced melanoma receiving nivolumab. J Clin Oncol 2014; 32: 1020-30.
24. Robert C et al. Three-year overall survival for patients with advanced melanoma treated with pembrolizumab in Keynote-001. J Clin Oncol 2016; 34(suppl): ASCO 2016, Abstract #9503.
25. Weber JS et al. Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment (CheckMate 037): A randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2015; 16: 375-84.
26. Postow MA et al. Nivolumab and ipilimumab versus ipilimumab in untreated melanoma. N Engl J Med 2015; 372: 2006-17.
27. Larkin J et al. Combined ivolumab and ipilimumab or monotherapy in untreated melanoma. N Engl J Med 2015; 373: 23-34.
28. Weber JS et al. Safety, efficacy, and biomarkers of nivolumab with vaccine in ipilimumab-refractory or -naive melanoma. J Clin Oncol 2013; 31: 4311-18.
29. Madore J et al. PD-L1 expression in melanoma shows marked heterogeneity within and between patients: Implications for anti-PD-1/PD-L1 clinical trials. Pigment Cell Melanoma Res 2015; 28: 245-53.
30. Spain L et al. Management of toxicities of immune checkpoint inhibitors. Cancer Treat Rev 2016; 44: 51-60.
31. Weber JS et al. Patterns of onset and resolution of immune-related adverse events of special interest with ipilimumab: Detailed safety analysis from a phase 3 trial in patients with advanced melanoma. Cancer 2013; 119: 1675-82.
32. Sanmamed MF et al. Agonists of co-stimulation in cancer immunotherapy directed against CD137, OX40, GITR, CD27, CD28, and ICOS. Semin Oncol 2015; 42: 640-55.
33. Fourcade J et al. Upregulation of Tim-3 and PD-1 expression is associated with tumor antigen-specific CD8+ T cell dysfunction in melanoma patients. J Exp Med 2010; 207: 2175-86.
34. Uyttenhove C et al. Evidence for a tumoral immune resistance mechanism based on tryptophan degradation by indoleamine 2,3-dioxygenase. Nat Med 2003; 9: 1269-74.
35. Kalbasi A et al. CD40 expression by human melanocytic lesions and melanoma cell lines and direct CD40 targeting with the therapeutic anti-CD40 antibody CP-870,893. J Immunother 2010; 33: 810-6.
36. Curti BD et al. OX40 is a potent immune-stimulating target in late-stage cancer patients. Cancer Res 2013; 73: 7189-98.
37. Andtbacka RH et al. Patterns of clinical response with talimogene laherparepvec (T-VEC) in patients with melanoma treated in the OPTiM phase III clinical trial. Ann Surg Oncol 2016, DOI: 10.1245/s10434-016-5286-0.
38. Rosenberg SA et al. Durable complete responses in heavily pretreated patients with metastatic melanoma using T-cell transfer immunotherapy. Clin Cancer Res 2011; 17: 4550-7.
39. Wu R et al. Adoptive T-cell therapy using autologous tumor-infiltrating lymphocytes for metastatic melanoma: Current status and future outlook. Cancer J 2012; 18: 160-75.
40. Linnemann C et al. High-throughput epitope discovery reveals frequent recognition of neo-antigens by CD4+ T cells in human melanoma. Nat Med 2015; 21: 81-5.
41. Holzinger A et al. The growing world of CAR T cell trials: A systematic review. Cancer Immunol Immunother 2016, DOI: 10.1007/s00262-016-1895-5.
42. Ott PA et al. Vaccines and melanoma. Hematol Oncol Clin North Am 2014; 28: 559-69.
43. Slingluff CL Jr. et al. A randomized pilot trial testing the safety and immunologic effects of a MAGE-A3 protein plus AS15 immunostimulant administered into muscle or into dermal/subcutaneous sites. Cancer Immunol Immunother 2016; 65: 25-36.
44. Kranz LM et al. Systemic RNA delivery to dendritic cells exploits antiviral defence for cancer immunotherapy. Nature 2016; 534: 396-401.
45. Hassel JC et al. Vemurafenib and ipilimumab: A promising combination? Results of a case series. Oncoimmunology 2016; 5: e1101207.

