Primärtherapie des Multiplen Myeloms
Therapieindikationen und Behandlungsoptionen
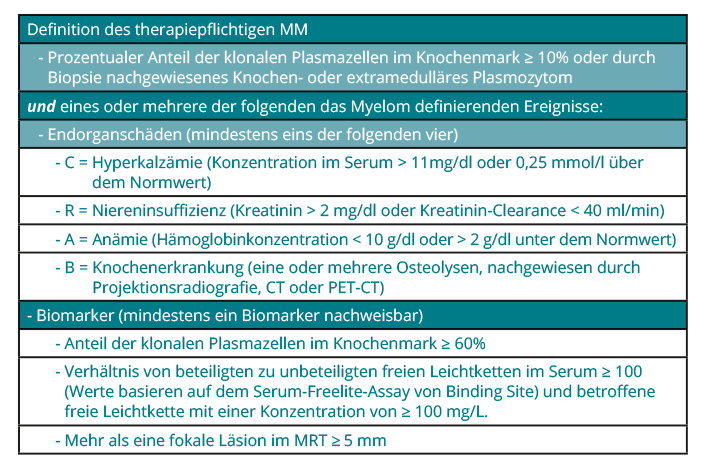
Symptomatische oder Myelompatienten mit pathologischen Biomarkern sind zu behandeln (Tab. 1; [1]). Asymptomatische Myelompatienten ohne pathologische Biomarker – diese Myelom-Erkrankungsform wird als smouldering myeloma bezeichnet – sind entsprechend ihres Risikoprofils zu kontrollieren. Eine Therapie für Hochrisiko-smouldering-myeloma-Patienten sollte nur in Studie erfolgen.
In der primären Diagnostik und in allen Krankheitsstadien des Multiplen Myeloms sollen Komplikationen wie Schmerzen, Niereninsuffizienz, Hyperkalzämie, Hyperviskositätssyndrom, Infektionen sowie Knochendestruktion analysiert und behandelt werden. Die optimale Behandlung kann nur interdisziplinär, insbesondere unter Einbeziehung von Nephrologen, Orthopäden, Osteologen und Strahlentherapeuten, erfolgen.
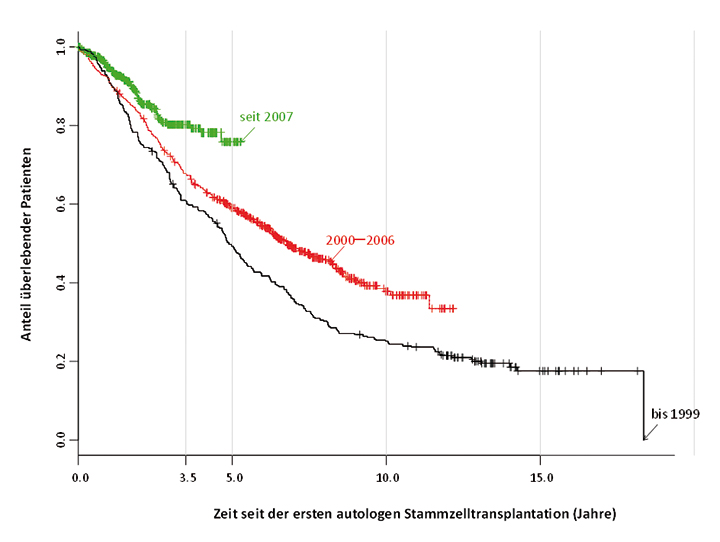
Zur Behandlung des Multiplen Myeloms werden konventionell dosierte Chemotherapeutika in Kombination mit neuen Substanzen oder eine Hochdosistherapie (HDT), gefolgt von der autologen Transplantation hämatopoetischer Stammzellen (ABSCT), eingesetzt. Neue Substanzen sind in alle Therapieformen integriert worden. Die Prognose der mit ABSCT behandelten Patienten konnte durch die Implementierung der neuen Substanzen verbessert werden (siehe Abb. 1; [2]).
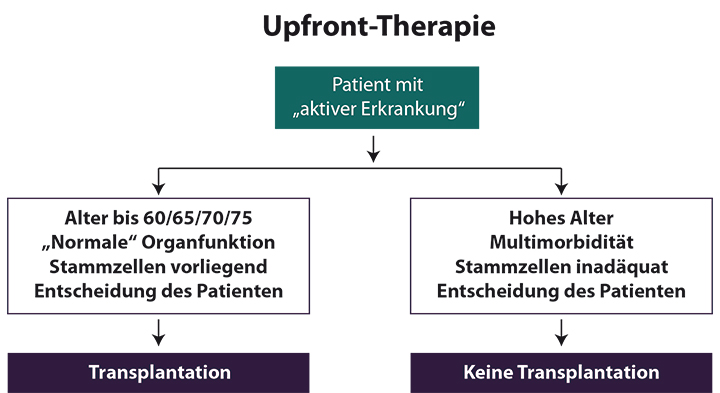
Die Entscheidung zur konventionellen oder Hochdosistherapie (s. Abb. 2) ist frühzeitig zu treffen, da Behandlungen mit Alkylanzien, insbesondere Melphalan (Bestandteil des MP-Schemas), den Pool an hämatopoetischen Stammzellen nachhaltig reduzieren und somit eine Mobilisierung hämatopoetischer Stammzellen ins periphere Blut erschweren. Die Transplantation allogener Blutstammzellen zur Induktion einer Graft-versus-Myelom-Reaktion sollte aufgrund der Nebenwirkungen dieser Behandlungsform nur innerhalb von Therapiestudien erfolgen.
Initiale Therapie
Die initiale Therapie des Multiplen Myeloms bei Patienten mit Kontraindikationen für die ABSCT ist entsprechend dem Zulassungsstatus in Deutschland (September 2016) meist eine Behandlung mit Melphalan und Prednison plus Bortezomib. Zunehmend wird die initiale Therapie mit Lenalidomid und Dexamethason etabliert. Die Therapie mit Melphalan, Prednison und Thalidomid verliert weiter an Bedeutung. Die Behandlung mit Bendamustin ist bei Kontraindikation für Bortezomib und unter Abwägung des Effekts der Lenalidomid-basierten Therapie eine Alternative.
Patienten mit der Option für eine ABSCT sollen mit Bortezomib plus hochdosiertem Dexamethason in Kombination mit Cyclophosphamid (VCD) oder Thalidomid (VTD) behandelt werden. Während VCD effektiv und gut tolerabel ist, kann durch VTD die Rate der sehr guten Remissionen erhöht werden. Jedoch sind die Nebenwirkungen durch VTD (u. a. Polyneuropathie) höher. Bei Patienten mit Komorbiditäten kann auch Bortezomib/Dexamethason (VD) angewendet werden.
Bei der „konventionellen Erstlinientherapie“ sind bei der primären Selektion der Behandlungsschemata folgende Kriterien besonders zu berücksichtigen:
• Patientenspezifische Kriterien wie Komorbidität und Alter,
• Eigenschaften des Tumorklons,
• Verfügbarkeit/Kostenerstattung der neuen Medikamente.
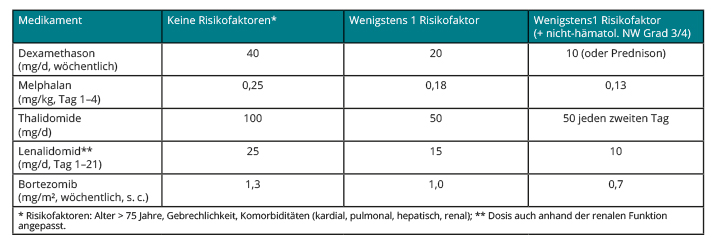
Bei der konventionellen Behandlung des Multiplen Myeloms sind primär die Komorbiditäten des Patienten zu analysieren. Empfehlungen zu Dosisreduktion, insbesondere für ältere Patienten, sollten umgesetzt werden, auch wenn diese auf Expertenmeinung beruhen und meist nicht durch prospektive Studienergebnisse belegt sind (s. Tab.2; [3]).
Für Patienten mit Polyneuropathie (PNP) werden Lenalidomid-basierte Therapien empfohlen. Zytogenetische Hochrisikogruppen, wie solche mit t(4;14), t(14;16), del17p, 1q21 oder Hypodiploidie, sind mit Bortezomib- und wahrscheinlich auch mit Lenalidomid-basierten Schemata zu behandeln. Bei eingeschränkter Knochenmarkfunktion ist Thalidomid allein oder in Kombination mit einem Glukokortikoid eine wichtige Option. Bei Niereninsuffizienz bis hin zur Dialysepflichtigkeit ist eine Bortezomib-basierte Therapie sehr effektiv, Lenalidomid-basierte Therapien sind ebenfalls wirksam. Insbesondere bei der CAST-Nephropathie ist eine intensive Therapie zur schnellen Reduktion der Tumormasse anzustreben. Eine Verbesserung der Nierenfunktion korreliert mit einer Verbesserung der Prognose des Myeloms.
Bei schwer führbarem Diabetes sollte die Glukokortikoid-Dosis reduziert werden, eventuell muss auf das Glukokortikoid vollständig verzichtet werden. Die hochdosierte gepulste Glukokortikoid-Therapie, z.B. mit Dexamethason 40 mg an den Tagen 1–4, 9–12 und 17–21, hat eine hohe Komplikationsrate und ist als ambulante Therapie obsolet. In der Auswertung der ECOG-Studie E4A03 [4] führte das klassisch hochdosierte Dexamethason in der Kombination mit Lenalidomid im Vergleich zur nur wöchentlichen Gabe von 40 mg Dexamethason plus Lenalidomid zwar zu einem besseren Therapieansprechen, jedoch musste eine gesteigerte Toxizität mit assoziierter Letalität bei den neu diagnostizierten Patienten in Kauf genommen werden. Die Dexamethason-Toxizität nahm mit dem Alter der Patienten zu. Insbesondere die erhöhte Infektionsrate mit Hospitalisierung führte zu frühzeitigen Therapiepausen und -abbrüchen. Patienten mit neu diagnostiziertem Myelom sollten deshalb mit reduzierten Dexamethason-Dosen, z. B. der wöchentlichen Gabe von 40 mg oder 20 mg Dexamethason, behandelt werden.
Bei langen Wegen des Patienten zum Betreuungszentrum ist eine orale Chemotherapie zu bevorzugen. Patienten mit einer ungewissen Compliance sollten hingegen parenteral behandelt werden.
Die primäre konventionelle Chemotherapie sollte mindestens (6)–9 Zyklen umfassen. Bei Erzielen eines Plateaus oder einer kompletten Remission sollten zwei weitere Therapiezyklen gegeben werden. Sowohl die primäre Therapie mit Bortezomib/Melphalan/Prednison (VMP-Schema; [5, 6]) und Melphalan/Prednison/Thalidomid (MPT; [7]) haben zu einer Verlängerung des Gesamtüberlebens der Myelompatienten, welche nicht für eine Hochdosistherapie geeignet sind, geführt. Zunehmend werden „Erhaltungstherapien“ insbesondere mit Lenalidomid nach initialer Kombinationstherapie prospektiv geprüft. Die initiale Therapie mit Lenalidomid plus Dexamethason hat im Gegensatz zur Behandlung mit MPT das progressionsfreie und das Gesamtüberleben verlängert [8]. Insbesondere für „nicht fitte“ Patienten ist diese Therapieform eine wirksame und nebenwirkungsarme Behandlung.
Auch die neuen Substanzen haben spezifische Nebenwirkungen. So war während der Bortezomib-Therapie die Rate der Herpes-Zoster-Reaktivierungen erhöht. Die antivirale Prophylaxe während der Bortezomib-Therapie z. B. mit Acyclovir reduziert diese Nebenwirkung essenziell. Die immunmodulierenden Substanzen Thalidomid und Lenalidomid sind ohne eine spezifische Prophylaxe bei hoher Tumormasse mit einer erhöhten Thromboembolie-Rate assoziiert. Niedermolekulares Heparin, Phenprocoumon und Azetylsalizylsäure reduzieren diese Komplikationen hochsignifikant. Spezifische Hinweise zur Anwendung dieser antikoagulatorischen Prophylaxe während der Therapie mit immunmodulierenden Substanzen sind publiziert und zu berücksichtigen [9].
Hochdosistherapie und autologe Blutstammzell-Transplantation
Die alleinige Hochdosistherapie, gefolgt von der Transplantation autologer Blutstammzellen, erhöht die Rate kompletter Remissionen auf etwa 40% im Vergleich zu 5–10% nach konventioneller Chemotherapie. Die therapieassoziierte Letalität der Hochdosistherapie beträgt in größeren Zentren weniger als 2%.
In der Publikation von Attal et al. wurde erstmals die Überlegenheit der Hochdosistherapie gegenüber einer Polychemotherapie bei Patienten mit Multiplem Myelom bis zum 65. Lebensjahr in einer prospektiv randomisierten Studie nachgewiesen [10]. Auf Kongressen präsentierte Ergebnisse des Vergleiches von primären modernen Kombinationstherapien mit und ohne autologe Blutstammzelltransplantation haben die Überlegenheit der initialen ABSCT bestätigt [11, 12].
Etabliert hat sich eine Therapiesequenz bestehend aus:
• Induktionstherapie zur Tumorreduktion,
• Mobilisierung und Sammlung autologer hämatopoetischer Stammzellen,
• Hochdosistherapie mit Melphalan, gefolgt von der Transplantation der hämatopoetischen Stammzellen,
• Konsolidierungs-/Erhaltungstherapie.
In die Behandlungsschritte vor und nach Hochdosistherapie wurden in den letzten Jahren die neuen Substanzen Thalidomid, Bortezomib und Lenalidomid integriert. Durch diese neuen Substanzen in Kombination mit der Hochdosistherapie werden die Remissionsraten der Therapie des Multiplen Myeloms entscheidend erhöht [13]. Ergebnisse zur Induktionstherapie mit Bortezomib-haltigen Schemata haben diese in Europa etabliert und zur Zulassung durch die EMA geführt. Durch die Implementierung von Bortezomib in die Induktionstherapie konnte das progressionsfreie und das Gesamtüberleben verlängert werden. In Nordamerika werden Lenalidomid-basierte Schemata, oft in Kombination mit Bortezomib, zunehmend angewendet.
Die Mobilisierung hämatopoetischer Stammzellen führt bei über 80% der Patienten zu einer Ausbeute bereits in der ersten Leukapherese, die ausreichende Stammzellmengen für zwei autologe Transplantationen beinhaltet.
Erste Ergebnisse von konsolidierenden Behandlungen nach Hochdosistherapie zeigen, dass molekulargenetisch negative komplette Remissionen beim Multiplen Myelom erzielbar sind. In der Auswertung von Avet-Loiseau [14] zeigte sich, dass Remissionen unterhalb einer Nachweisgrenze von < 10-6, mittels Next Generation Sequencing nachgewiesen, mit einer besonders guten Prognose korrelieren.
Allogene Blutstammzell- oder Knochenmark-Transplantation
Die myeloablative Konditionierung vor einer Transplantation allogener hämatopoetischer Stammzellen bedingte eine sehr hohe transplantationsassoziierte Mortalität von 30–40 %. Die in den letzten 15 Jahren eingeführte allogene Stammzelltransplantation nach Konditionierung mit reduzierter Intensität (RIC) akzeptiert eine verminderte Tumorzell-Eliminierung, um die Toxizität der Transplantations-Prozedur zu vermindern. Der immunologische Effekt der Graft-versus-Myeloma-Reaktion soll die Krankheitsaktivität des Multiplen Myeloms reduzieren und Restzellen des Tumorklones möglichst eradizieren. Bei der Analyse der publizierten allogenen Myelom-Studien zeigt sich, dass die Konditionierungen differieren und der Einfluss der Verwendung von Antithymozyten-Globulin Vergleiche erschwert. Auch die Ergebnisse hinsichtlich des Überlebens sind unterschiedlich. Deshalb ist die allogene Transplantation bei Patienten mit Multiplem Myelom in prospektiven Studien weiter zu evaluieren. Bis zum Vorliegen weiterer Studiendaten kann eine allogene Transplantation bei Myelom-Patienten nicht empfohlen werden.
Erhaltungstherapie nach autologer Transplantation
Viele Jahre wurden Erhaltungstherapien mit Interferon oder Thalidomid nach Hochdosistherapie empfohlen. Sowohl die Interferon- als auch die Thalidomid-Erhaltungstherapie mit mehr als 100 mg Thalidomid pro Tag führt zu Nebenwirkungen, wodurch diese Therapieformen zu über 30% bereits im ersten Behandlungsjahr abgebrochen werden müssen. Entscheidend besser werden Lenalidomid und Bortezomib nach Hochdosistherapie toleriert. Die Lenalidomid-Erhaltungstherapie zeigte sowohl in der französischen als auch in der nordamerikanischen Studie [15, 16] eine hochsignifikante Verbesserung des progressionsfreien Überlebens. Bortezomib nach der Hochdosistherapie wurde in der HOVON/GMMG-Studie [17] bei einer zweiwöchentlichen Applikation ebenfalls gut vertragen und scheint insbesondere bei den Gruppen mit ungünstiger Zytogenetik das progressionsfreie Überleben zu verbessern. Die Zunahme von Zweit-Neoplasien während der Erhaltungstherapie mit Lenalidomid ist ausführlich diskutiert worden. Der Benefit durch die Lenalidomid-Gabe hinsichtlich progressionsfreiem und Gesamtüberleben wird im Vergleich zu den Nebenwirkungen als höher eingeschätzt. Die Patienten werden unter und nach der Lenalidomid-Erhaltung umfassend nachbeobachtet.
Strahlentherapie
Durch interdisziplinäre Kooperation ist es möglich, die lokal sehr effektive und analgetisch wirksame Strahlenbehandlung zum bestmöglichen Zeitpunkt in die Therapie des Multiplen Myeloms zu integrieren. Die Radiotherapie hat hier folgende Indikationen:
• Behandlung von ossären Schmerzen,
• Prävention oder Therapie von pathologischen Knochenfrakturen,
• Therapie von Plasmazell-Tumoren, insbesondere paravertebral,
• Additiv zur Laminektomie und bei intraspinalen Plasmazell-Tumoren.
Die Strahlentherapie von isolierten Myelom-Herden ist zusätzlich zur systemischen Behandlung effektiv. Prospektive, randomisierte Studien dazu fehlen allerdings. Die Toxizität einer Primär-Kombinationsbehandlung, welche neue Substanzen einschließt, plus einer lokalen Strahlentherapie kann zu einer verstärkten Hämatotoxizität führen. Engmaschige Blutbildkontrollen während solch einer Behandlung werden empfohlen.
Zukünftige Entwicklungen
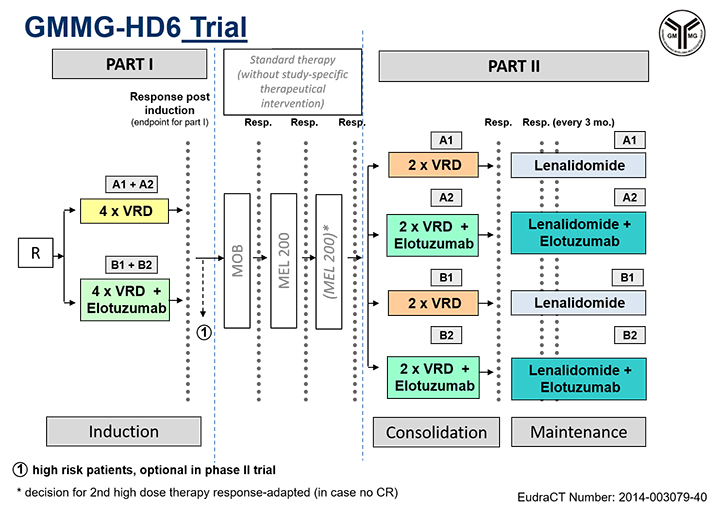
Die Myelom-Erkrankung ist heterogen. Molekularbiologische Erkenntnisse werden dazu führen, dass wir die Krankheit immer besser verstehen. Erste erfolgreiche Therapien bei Patienten mit BRAF-Mutation im Rezidiv sind beschrieben. Antikörper gegen Oberflächenantigene der Myelom-Zellen sind in Kombination mit Immunmodulatoren und Proteasominhibitoren hochwirksam. Prospektive Studien zur Frage, welche Antikörper zusammen mit hochwirksamen Kombinationstherapien das Ziel der Heilung näherbringen, sind aktiviert (s. Abb. 3). Auch die aktive Immuntherapie ist in ersten Studien beim Multiplen Myelom hoch wirksam. Die bessere Zuordnung der verschiedenen Therapieoptionen zum individuellen Patienten ist eine weitere Aufgabe der Zukunft.
Literatur
1. Rajkumar SV et al. International Myeloma Working Group updated criteria for the diagnosis of multiple myeloma. Lancet Oncol 2014; 15: e538-e548.
2. Hillengass J et al. Meeting report of the 4th Heidelberg Myeloma Workshop: Current status and developments in diagnosis and therapy of multiple myeloma. J Cancer Res Clin Oncol 2013; 139: 1807-11.
3. Palumbo A et al. Personalized therapy in multiple myeloma according to patient age and vulnerability: A report of the European Myeloma Network (EMN). Blood 2011; 118: 4519-29.
4. Rajkumar SV et al. Lenalidomide plus high-dose dexamethasone versus lenalidomide plus low-dose dexamethasone as initial therapy for newly diagnosed multiple myeloma: An open-label randomised controlled trial. Lancet Oncol 2010; 11: 29-37.
5. San Miguel JF et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma. N Engl J Med 20080; 359: 906-17.
6. San Miguel JF et al. Persistent overall survival benefit and no increased risk of second malignancies with bortezomib-melphalan-prednisone versus melphalan-prednisone in patients with previously untreated multiple myeloma. J Clin Oncol 2013; 31: 448-55.
7. Facon T et al. Melphalan and prednisone plus thalidomide versus melphalan and prednisone alone or reduced-intensity autologous stem cell transplantation in elderly patients with multiple myeloma (IFM 99-06): A randomised trial. Lancet 2007; 370: 1209-18.
8. Benboubker L et al. FIRST Trial Team. Lenalidomide and dexamethasone in transplant-ineligible patients with myeloma. N Engl J Med 2014; 371: 906-17.
9. Palumbo A et al. Prevention of thalidomide- and lenalidomide-associated thrombosis in myeloma. Leukemia 2008; 22: 414-23.
10. Attal M et al. A prospective, randomized trial of autologous bone marrow transplantation and chemotherapy in multiple myeloma. Intergroupe Français du Myélome. N Engl J Med 1996; 335: 91-7.
11. Attal M et al: Autologous transplantation for multiple myeloma in the era of new drugs: A phase III study of the Intergroupe Francophone Du Myelome (IFM/DFCI 2009 Trial). Blood 2015; 126: 391.
12. Cavo M et al. Upfront autologous stem cell transplantation (ASCT) versus novel agent-based therapy for multiple myeloma (MM): A randomized phase 3 study of the European Myeloma Network (EMN02/HO95 MM trial). J Clin Oncol 2016; 34 (ASCO 2016, Abstract #8000).
13. Raab MS et al. Targeted treatments to improve stem cell outcome: Old and new drugs. Bone Marrow Transplant 2007; 40: 1129–37.
14. Avet-Loiseau H et al. Evaluation of minimal residual disease (MRD) by next generation sequencing (NGS) is highly predictive of progression free survival in the IFM/ DFCI 2009 trial. Blood 2015; 126 (ASH 2015, Abstract #191).
15. Attal M et al. Lenalidomide maintenance after stem-cell transplantation for multiple myeloma. N Engl J Med 2012; 366: 1782-91.
16. McCarthy PL et al. Lenalidomide after stem-cell transplantation for multiple myeloma. N Engl J Med 2012; 366: 1770-81.
17. Sonneveld P et al. Bortezomib-based versus non-bortezomib-based induction treatment before autologous stem-cell transplantation in patients with previously untreated multiple myeloma: A meta-analysis of phase III randomized, controlled trials. J Clin Oncol 2013; 31: 3279-87.

(korrespondierender Autor)
Prof. Dr. med. Hartmut Goldschmidt
Prof. Dr. med. Gerlinde Egerer
Dr. med. Uta Bertsch
Sektion Multiples Myelom, Medizinische Klinik VUniversitätsklinikum HeidelbergIm Neuenheimer Feld 410, 69120 Heidelberg