Bedeutung der minimalen Resterkrankung beim Multiplen Myelom
Definition: Minimale Resterkrankung
Als minimale Resterkrankung (Minimal Residual Disease, MRD) definiert man eine verbleibende kleine Anzahl von monoklonalen Plasmazellen (PCs) im Knochenmark, die mit serologischen oder zytologischen Methoden nicht identifiziert werden können. Eine MRD wird als eine der Hauptursachen für das Wiederauftreten des MM nach erreichter Remission angesehen [1–4]. Die Erfassung des MRD-Status erlaubt eine Aussage über die Effizienz der Therapie und eine prognostische Risikostratifizierung [5]. Aktuell stehen drei molekulare Methoden zur MRD-Diagnostik im Knochenmark zur Verfügung: Durchflusszytometrie (Multicolor Flow Cytometry, MFC), allelspezifische Oligonukleotid-Polymerase-Kettenreaktion (ASO-PCR) und Next Generation Sequencing (NGS). Zusätzlich sind durch die Quantifizierung zirkulierender Tumorzellen (CTCs) im peripheren Blut (PB, [6, 7]) oder anhand bildgebender Verfahren wie der Positronenemissions-Tomografie (PET-CT) und der Magnetresonanztomografie (MRT) Aussagen über die Prognose eines MM-Patienten möglich [8].
MRD-Diagnostik im Knochenmark
Die drei gängigsten Methoden zur MRD-Diagnostik im Knochenmark – MFC, ASO-PCR und NGS – unterscheiden sich sowohl technisch als auch in ihrer Sensitivität und Anwendbarkeit voneinander (Tab. 1).
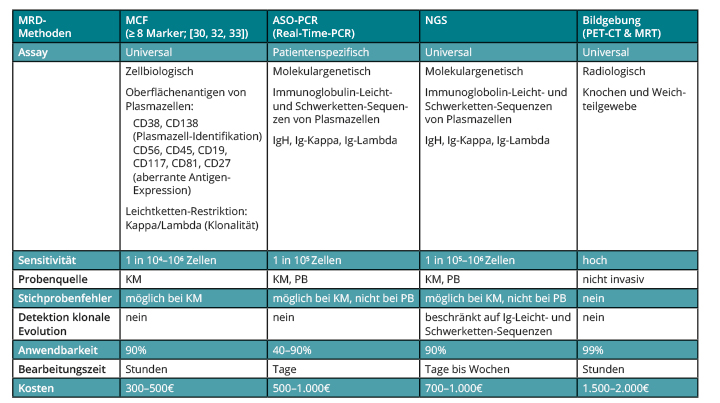
MFC
Die Durchflusszytometrie ist ein Laser-basiertes biophysikalisches Verfahren, das eine Quantifizierung und Charakterisierung von Zellpopulationen erlaubt. Dabei werden sowohl physikalische Eigenschaften (Zellgröße und -granularität) als auch Oberflächen-Antigene auf den Zellen erfasst. Die MFC erlaubt eine Unterscheidung zwischen aberranten und normalen PCs auf hohem Sensitivitätsniveau (10-4–10-6; [9, 10]). Bisher sind zahlreiche, für aberrante PCs charakteristische Antigene beschrieben worden [11]. Eine genau Differenzierung zwischen normalen und malignen PCs kann jedoch nur in der Zusammenschau der aberranten Expression mehrerer Antigene bzw. durch Nachweis einer Leichtketten-Restriktion erfolgen [12]. Das European Myeloma Network und die International Clinical Cytometry Society empfehlen eine Kombination aus acht Antigenen sowie den Nachweis der Leichtketten-Restriktion zur Identifikation von Myelomzellen in der MRD-Diagnostik (Tab. 1).
ASO-PCR und NGS
Neben der MCF stehen zwei molekulargenetische Methoden zur MRD-Diagnostik zur Verfügung (Tab. 1), die auf der Quantifizierung der patientenspezifischen Immunoglobulin-Schwerketten- und Leichtketten-DNA-Sequenzen der aberranten PCs beruhen. Bei der ASO-PCR-basierten MRD-Diagnostik nutzt man diese DNA-Sequenzen, um für jeden Patienten einen spezifischen Assay zu erstellen, der dann für die MRD-Diagnostik verwendet werden kann. Als Assays kommen entweder Real-Time-PCR-Primer [13] oder unmarkierte PCR-Primer in Kombination mit einer „Extreme-Limiting-Dilution“ Analyse infrage [14], die eine Sensitivität von 10-4–10-6 erreichen.
Bei der NGS-Methode dienen die Immunoglobulin-Schwerketten- und Leichtketten-DNA-Sequenzen als Templates für die Identifikation und Auszählung von aberranten PCs in der MRD-Probe. Die NGS-Methode nutzt keine patientenspezifischen Assays, sondern identifiziert aberrante Tumorzellen anhand massiver paralleler Sequenzierung tausender DNA-Sequenzen (Ultra-Deep Sequencing) mithilfe von Consensus-Primern [15]. NGS-basierte MRD-Diagnostik erreicht eine Sensitivität von 10-6.
Bedeutung der MRD-Diagnostik im Knochenmark
Unabhängig von der verwendeten Methode konnte in zahlreichen Studien nachgewiesen werden, dass trotz moderner Therapiekombinationen und Stammzelltransplantation eine MRD-Negativität (MRD-) nur von einem kleinen Teil der MM-Patienten erreicht wird. Diese Patienten zeichnen sich durch eine gute Prognose aus. Sind hingegen noch Tumorzellen im KM nachweisbar, haben Patienten ein signifikant verkürztes progressionsfreies (PFS) und Gesamtüberleben (OS) [8, 13, 15–20]. Durch technische Weiterentwicklungen, wie z. B. die Erweiterung der MFC von vier auf acht oder 14 verschiedene Marker für Oberflächenantigene oder die Anwendung von „Ultra-Deep“-Sequenzierungen, wurde deutlich, dass durch tiefere Grenzwerte für MRD- zwar weniger MRD-negative Patienten identifiziert werden können, die Tiefe des Therapieansprechens aber mit einem signifikant verbesserten PFS und OS assoziiert ist.
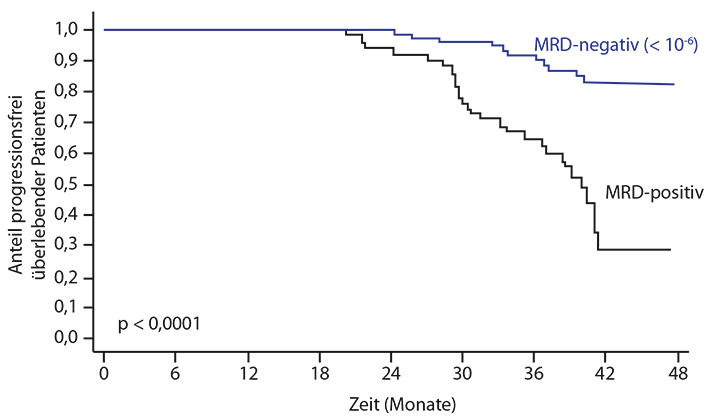
So ermittelten Rawstron et al. 62% MRD-negative Patienten, deren medianes PFS gegenüber MRD-positiven Patienten um 13 Monate verlängert war (MFC; Sensitivität 10-4; [18]). Martinez-Lopez et al. zeigten mit einem NGS-basierten Assay ein verlängertes PFS von 49 Monaten für die 37% als MRD- eingestuften Patienten (10-5; [21]), und Avet-Loiseau et al. konnten mit der bisher höchsten erreichten Sensitivität (10-6; NGS) zeigen, dass nur 36% der untersuchten Patienten MRD- waren, diese aber ein signifikant verlängertes PFS aufwiesen [19]. Die Ergebnisse der IMF/DFCI-2009-Studie, die auf dem Kongress der amerikanischen Gesellschaft für Hämatologie in Orlando im Dezember 2015 erstmals präsentiert wurden, zeigen nachhaltig die Bedeutung der sensitiven MRD-Diagnostik: Mittels NGS konnte bei einer Sensitivität von 10-6 bei MRD-Negativität die beste Prognose gezeigt werden (Abb. 1; [19]).
Zirkulierende Tumorzellen im peripheren Blut
Weit weniger etabliert als die MRD-Diagnostik an Material aus Knochenmark sind Untersuchungen von CTCs im peripheren Blut. Grundsätzlich eignen sich dank des technischen Fortschritts heute sowohl MCF als auch ASO-PCR und NGS für diese Analyse. Mehrere Studien konnten zeigen, dass die Menge der CTCs zum Zeitpunkt der Diagnose einen unabhängigen prognostischen Marker für PFS und OS von MM-Patienten darstellt [6, 7, 22, 23]. Auch konnte gezeigt werden, dass zwischen der Tumorlast im Knochenmark und im peripheren Blut eine Korrelation besteht.
MRD-Diagnostik mit Bildgebung
Radiologische Untersuchungen wie Röntgen, CT oder MRT gehören zur Basisdiagnostik für MM-Patienten, und ihr prognostischer Wert bei der Diagnose ist gut belegt [24–26]. Aber auch für die Bewertung des Therapieansprechens bieten bildgebende Verfahren wie PET-CT und MRT eine Möglichkeit, klinische Manifestation des MM wie Knochenmark-Infiltration, fokale Läsionen und Weichteilbeteiligungen zu beurteilen [2, 8]. Erste Studien konnten zeigen, dass der Nachweis einer persistierenden Erkrankung mittels MRT oder PET-CT mit einem verkürzten PFS und OS assoziiert ist [24, 27–29]. Als Mittel für die MRD-Diagnostik beim MM wird sowohl das PET-CT als auch das Ganzkörper-MRT im Rahmen von klinischen Studien weiter überprüft.
Ausblick
Derzeit findet die MRD-Diagnostik beim MM in Deutschland im Rahmen klinischer Studien Anwendung und wird in der Regel dann durchgeführt, wenn bei einem Patienten eine komplette Remission (CR) nach IMWG-Kriterien vorliegt. Konsequenzen für die weitere Behandlung werden aus einem positiven MRD-Ergebnis bisher nicht gezogen. Mögliche Optionen, wie eine zweite autologe Stammzelltransplantation oder die Verlängerung einer Erhaltungstherapie, werden in Fachkreisen diskutiert. Neben ihrer prognostischen Bedeutung stellt die MRD-Diagnostik am Knochenmark ein wichtiges Werkzeug für die Entwicklung und Evaluierung neuer Medikamente und die Evaluierung von Medikamentenkombinationen dar, da sie deren Wirksamkeit bewerten kann.
Für die Aufnahme der MRD-Diagnostik als Standard in die Bewertung des Therapieansprechens von MM-Patienten müssen standardisierte Bedingungen gewählt werden. Die Standardisierung betrifft die zu messende Gesamtzellzahl und die Grenzwerte für die Anzahl der zu detektierenden Myelomzellen für einen MRD-positiven bzw. -negativen Befund. Welche Methode sich als Goldstandard etablieren wird, hängt maßgeblich von den damit verbundenen Kosten und der therapiebegleitenden Durchführbarkeit ab. Zurzeit ist nur die MCF-MRD-Diagnostik kostengünstig und therapiebegleitend durchführbar. Durch absehbare Kostensenkungen und die Möglichkeit der Automatisierung kann sich auch die NGS-basierte Analyse in den nächsten Jahren etablieren.
Literatur
1. Sherrod AM et al. Minimal residual disease testing after stem cell transplantation for multiple myeloma. Bone Marrow Transplant 2016; 51: 2-12.
2. Paiva B et al. New criteria for response assessment: Role of minimal residual disease in multiple myeloma. Blood 2015; 125: 3059-68.
3. Vogel W et al. Myeloma cell contamination of peripheral blood stem-cell grafts can predict the outcome in multiple myeloma patients after high-dose chemotherapy and autologous stem-cell transplantation. J Cancer Res Clin Oncol 2005; 131: 214-8.
4. Galimberti S et al. Peripheral blood stem cell contamination evaluated by a highly sensitive molecular method fails to predict outcome of autotransplanted multiple myeloma patients. Br J Haematol 2003; 120: 405-12.
5. Hauwel M, Matthes T. Minimal residual disease monitoring: The new standard for treatment evaluation of haematological malignancies? Swiss Med Wkly 2014; 144: w13907.
6. Nowakowski GS et al. Circulating plasma cells detected by flow cytometry as a predictor of survival in 302 patients with newly diagnosed multiple myeloma. Blood 2005; 106: 2276-9.
7. Paiva B et al. Detailed characterization of multiple myeloma circulating tumor cells shows unique phenotypic, cytogenetic, functional, and circadian distribution profile. Blood 2013; 122: 3591-8.
8. Sherrod AM et al. Minimal residual disease testing after stem cell transplantation for multiple myeloma. Bone Marrow Transplant 2016; 51: 2-12.
9. Hart AJ et al. Minimal residual disease in myeloma: Are we there yet? Biol Blood Marrow Transplant 2012; 18: 1790-9.
10. Paiva B et al. Utility of flow cytometry immunophenotyping in multiple myeloma and other clonal plasma cell-related disorders. Cytometry B Clin Cytom 2010; 78: 239-52.
11. Rawstron AC et al. Report of the European Myeloma Network on multiparametric flow cytometry in multiple myeloma and related disorders. Haematologica 2008; 93: 431-8.
12. Kumar S et al. Immunophenotyping in multiple myeloma and related plasma cell disorders. Best Pract Res Clin Haematol 2010; 23: 433-51.
13. Puig N et al. Critical evaluation of ASO RQ-PCR for minimal residual disease evaluation in multiple myeloma. A comparative analysis with flow cytometry. Leukemia 2014; 28: 391-7.
14. Cremer FW et al. Evaluation of the kinetics of the bone marrow tumor load in the course of sequential high-dose therapy assessed by quantitative PCR as a predictive parameter in patients with multiple myeloma. Bone Marrow Transplant 2000; 26: 851-8.
15. Ladetto M et al. Major tumor shrinking and persistent molecular remissions after consolidation with bortezomib, thalidomide, and dexamethasone in patients with autografted myeloma. J Clin Oncol 2010; 28: 2077-84.
16. Martinez-Lopez J et al. Prognostic value of deep sequencing method for minimal residual disease detection in multiple myeloma. Blood 2014; 123: 3073-9.
17. Paiva B et al. Multiparameter flow cytometric remission is the most relevant prognostic factor for multiple myeloma patients who undergo autologous stem cell transplantation. Blood 2008; 112: 4017-23.
18. Rawstron AC et al. Minimal residual disease assessed by multiparameter flow cytometry in multiple myeloma: Impact on outcome in the Medical Research Council Myeloma IX Study. J Clin Oncol 2013; 31: 2540-7.
19. Avet-Loiseau H et al. Evaluation of minimal residual disease (MRD) by next generation sequencing (NGS) is highly predictive of progression free survival in the IFM/DFCI 2009 trial. Blood 2015; 126 (ASH 2015, Abstract #191).
20. Paiva B et al. High-risk cytogenetics and persistent minimal residual disease by multiparameter flow cytometry predict unsustained complete response after autologous stem cell transplantation in multiple myeloma. Blood 2012; 119: 687-91.
21. Martinez-Lopez J et al. Critical analysis of the stringent complete response in multiple myeloma: Contribution of sFLC and bone marrow clonality. Blood 2015; 126: 858-62.
22. Gonsalves WI et al. Quantification of clonal circulating plasma cells in relapsed multiple myeloma. Br J Haematol 2014; 167: 500-5.
23. Gonsalves WI et al. Quantification of clonal circulating plasma cells in newly diagnosed multiple myeloma: Implications for redefining high-risk myeloma. Leukemia 2014; 28: 2060-5.
24. Walker R et al. Magnetic resonance imaging in multiple myeloma: Diagnostic and clinical implications. J Clin Oncol 2007; 25: 1121-8.
25. Kyle RA, Rajkumar SV. Criteria for diagnosis, staging, risk stratification and response assessment of multiple myeloma. Leukemia 2009; 23: 3-9.
26. Mai EK et al. Association between magnetic resonance imaging patterns and baseline disease features in multiple myeloma: Analyzing surrogates of tumour mass and biology. Eur Radiol 2016; Jan 15 [Epub ahead of print, DOI 10.1007/s00330-015-4195-0]
27. Nishihori T et al. Minimal residual disease assessment in the context of multiple myeloma treatment. Curr Hematol Malig Rep 2016; 11: 118-26.
28. Bannas P et al. Diagnostic performance of whole-body MRI for the detection of persistent or relapsing disease in multiple myeloma after stem cell transplantation. Eur Radiol 2012; 22: 2007-12.
29. Hillengass J et al. Changes in magnetic resonance imaging before and after autologous stem cell transplantation correlate with response and survival in multiple myeloma. Haematologica 2012; 97: 1757-60.
30. Mailankody S et al. Minimal residual disease in multiple myeloma: Bringing the bench to the bedside. Nat Rev Clin Oncol 2015; 12: 286-95.
31. Paiva B et al. Is this the time to introduce minimal residual disease in multiple myeloma clinical practice? Clin Cancer Res 2015; 21: 2001-8.
32. Landgren O et al. Flow cytometry detection of minimal residual disease in multiple myeloma: Lessons learned at FDA-NCI roundtable symposium. Am J Hematol 2014; 89: 1159-60.
33. van Dongen JJ et al. EuroFlow: Resetting leukemia and lymphoma immunophenotyping. Basis for companion diagnostics and personalized medicine. Leukemia 2012; 26: 1899-907.

Dr. sc. hum. Stefanie Huhn
(korrespondierende Autorin)
Dr. med. Katharina Lisenko
Priv.-Doz. Dr. med. Michael Hundemer
Molekularbiologisches Labor
Sektion Multiples Myelom, Medizinische Klinik V, Universitätsklinikum Heidelberg
Im Neuenheimer Feld 410, 69120 Heidelberg
+49 6221 56 36194
+49 6221 56 5609

