Neues zu Lymphomen
ASCO/EHA 2016
Für Patienten mit Lymphom wurden in den letzten beiden Jahrzehnten enorme Fortschritte erzielt – man denke nur an die Einführung der Immunchemotherapie für Non-Hodgkin-Lymphome mit B-Zell-Ursprung. Noch aber gibt es viel zu tun, selbst beim Hodgkin-Lymphom, das zu den malignen Erkrankungen mit den besten Heilungschancen gehört. Dass die Entwicklung stetig fortschreitet und neue Therapieoptionen wie die Immuncheckpoint-Inhibitoren, die zunächst bei soliden Tumoren eingeführt wurden, auch in der Hämatologie von sich reden machen, wurde sowohl beim Kongress der American Society of Clinical Oncology (ASCO) in Chicago als auch bei der Jahrestagung der European Hematology Association (EHA) in Kopenhagen deutlich.
Hodgkin-Lymphom
Osteonekrose als Komplikation
Das Hodgkin-Lymphom zählt zu den am besten heilbaren Tumoren überhaupt, aber auch hier gibt es reichlich Möglichkeiten zur Verbesserung der Behandlung – sowohl bei rezidivierenden oder gar refraktären Patienten als auch bei den konventionellen, im Prinzip erfolgreichen Therapien, weil deren Toxizität zum Teil erheblich ist. Eine Nebenwirkung, die nicht häufig vorkommt, aber für Betroffene beträchtliche Konsequenzen haben kann, ist eine Osteonekrose. Die Deutsche Hodgkin-Studiengruppe (GHSG) kann auf Daten von Tausenden von Patienten aus ihren zahlreichen großen Studien zurückgreifen und damit auch das Auftreten solcher seltenen Komplikationen analysieren.
Bei 12.083 in den Studien HD10–15 und HD18 der GHSG behandelten Patienten lag die kumulative Inzidenz einer Osteonekrose bei Patienten in frühen Krankheitsstadien bei 0,16% und bei denen mit fortgeschrittener Erkrankung bei 0,93%, so Sven Borchmann, Köln [1]; es handelte sich um 140 einzelne Läsionen, die bei insgesamt 66 Patienten auftraten, von denen drei Viertel Männer waren. Am häufigsten war der Femur-Kopf betroffen (73%). Mehr als die Hälfte der Patienten bedurfte einer chirurgischen Intervention, aber bei zwei Drittel konnten die Symptome damit nicht vollständig kontrolliert werden.
Bei 83% der Betroffenen ereignete sich die erste Episode einer Osteonekrose innerhalb von drei Jahren nach Diagnose des Lymphoms, mit 41% aller Fälle am häufigsten im zweiten Jahr nach der Hodgkin-Therapie. Eine multivariate Analyse identifizierte männliches Geschlecht (Odds Ratio 2,1) und ein fortgeschrittenes Stadium der Hodgkin-Erkrankung (OR 3,9) als Risikofaktoren für das Auftreten von Osteonekrosen. Bei den Patienten mit fortgeschrittener Erkrankung wurde eine weitere multivariate Analyse vorgenommen, in der sich ein jüngeres Alter und eine höhere Prednison-Dosis im Hodgkin-Therapieregime (OR 1,3 für jedes zusätzliche Gramm) als Risikofaktoren ergaben.
Während die übrigen Faktoren zur frühzeitigen Erkennung von Hochrisiko-Patienten dienen könnten, ist die Steroid-Dosis der einzige potenziell beeinflussbare Faktor, so Borchmann. Entsprechende Modifikationen von Therapieregimes v. a. für Patienten mit fortgeschrittener Erkrankung könnte das Risiko reduzieren.
Immuntoxin versus Bestrahlung
Patienten mit begrenztem Hodgkin-Lymphom werden mit einer Chemotherapie (in der Regel ABVD) und gegebenenfalls Strahlentherapie zur Eradikation eventueller Residuen behandelt. Der Einfluss der Bestrahlung auf die Überlebensaussichten ist unklar, ihre langfristige Toxizität hingegen sehr real. Da das Immuntoxin Brentuximab Vedotin (BV) sich in den letzten Jahren als eines der wirksamsten Medikamente erwiesen hat, wurde in einer US-amerikanischen Phase-II-Studie getestet, ob es eventuell die Radiotherapie zur Konsolidierung ersetzen könnte [2].
Patienten mit Hodgkin-Lymphom im Frühstadium (non-bulky) erhielten in Abhängigkeit vom Ergebnis der Kontrolluntersuchungen mit der Positronenemissionstomografie (PET) zwischen zwei und sechs Zyklen ABVD und anschließend sechs Zyklen BV. Von 40 auswertbaren Patienten (median 29 Jahre alt) hatten knapp die Hälfte eine ungünstige Prognose aufgewiesen, so Steven Park, Chapel Hill. Mehr als 90% der Patienten benötigten allerdings höchsten vier Zyklen ABVD, nur einer musste wegen einer Progression bestrahlt werden. 72% der Patienten waren nach zwei Zyklen der Chemotherapie PET-negativ und insgesamt 90% nach der Konsolidierung mit dem Immuntoxin. Nach einem Jahr lagen progressionsfreies und Gesamtüberleben bei 91% bzw. 96%.
An Toxizitäten vom Grad 3 oder höher traten unter BV Neutropenien (n = 3), Neuropathie und Hautausschlag (jeweils n = 1) auf. Es gab einen Todesfall durch Sepsis und Leberversagen – eine sehr seltene, aber bekannte Komplikation unter der Immuntherapie.
Alles in allem, so Park, scheint BV als Konsolidierungstherapie in dieser Indikation sicher und wirksam zu sein, und die Notwendigkeit der Bestrahlung könnte dadurch in Zukunft komplett entfallen.
Checkpoint-Inhibition auch beim Hodgkin-Lymphom erfolgreich
BV hat sich in den letzten Jahren eine feste Rolle in der Behandlung von Hodgkin-Patienten erworben, die nach autologer Stammzelltransplantation (ASCT) rezidivieren. Die meisten von ihnen kommen mit dem Immuntoxin wieder in eine Remission, aber es gibt besonders hartnäckige Fälle, die auch hier eine Progression erleiden und dann bisher eine sehr schlechte Prognose hatten. Interessanterweise exprimieren die Lymphom-Zellen in solchen rezidivierten und refraktären Tumoren die Checkpoint-Moleküle PD-L1 und PD-L2. Diese sind die Liganden für das auf zytotoxischen T-Lymphozyten exprimierte PD-1-Antigen, und Antikörper gegen PD-1 haben in den letzten Jahren bei einer ganzen Reihe bisher schlecht behandelbarer solider Tumoren für Furore gesorgt. Dass sie auch in der Hämatologie und speziell beim Hodgkin-Lymphom ein therapeutisches Potenzial haben, belegten in Chicago und Kopenhagen die Ergebnisse mehrerer Studien:
Wie Robert Chen, Duarte, in Chicago zeigte [3], konnte der PD-1-Antikörper Pembrolizumab in der Phase-II-Studie KEYNOTE-087 bei schwer vorbehandelten Hodgkin-Patienten (die insbesondere eine ASCT und BV erhalten hatten) Gesamtansprechraten zwischen 70% und 80% erzielen, mit bis zu 27% Komplettremissionen.
Ein anderer derzeit in breiter Testung befindlicher PD-1-Antikörper, Nivolumab, wurde in der Phase-II-Studie CheckMate-205 in einem ähnlichen Kollektiv von 80 Hodgkin-Patienten, die trotz ASCT und BV progredient waren, untersucht. Anas Younes, New York, berichtete in Kopenhagen [4], dass nach median neun Monaten 66% der Patienten in Remission waren (8,8% komplett). Bei 43 Patienten, die primär refraktär gegenüber BV gewesen waren, lag die Ansprechrate mit 72% etwas höher, Komplettremissionen traten hier bei 27,5% der Patienten auf. Nach sechs Monaten waren 77% der Patienten progressionsfrei am Leben, die Gesamtüberlebensrate betrug 99%.
Insgesamt stellt die Immuntherapie mit Checkpoint-Inhibitoren also einen außerordentlich vielversprechenden neuen Ansatz dar, zunächst vor allem für diejenigen Hodgkin-Patienten, die mit den bisher verfügbaren Therapien nicht geheilt werden können.
Aggressive NHL
DLBCL: Intensivere Rituximab-Therapie ohne Wirkung
Für Patienten mit aggressiven (diffus-großzelligen) B-Zell-Non-Hodgkin-Lymphomen (DLBCL) ist der therapeutische Standard seit Langem die Chemotherapie (meist CHOP) in Kombination mit dem CD20-Antikörper Rituximab (R-CHOP). Nach wie vor ist nicht klar, ob Rituximab mit 375 mg/m2 einmal pro Zyklus optimal dosiert ist. Die deutsche Studiengruppe hatte hier Hinweise gefunden, dass dies nicht der Fall sein könnte und dass auch alters- und geschlechtsspezifische Unterschiede bestehen könnten. Die niederländische HOVON-Gruppe hat in Zusammenarbeit mit der Nordic Lymphoma Group eine Phase-III-Studie angestrengt, in der 575 Patienten mit einem DLBCL zunächst randomisiert wurden, entweder sechs Zyklen des klassischen 14-tägigen R-CHOP-Regimes oder zusätzlich zur Mitte der ersten vier Zyklen eine weitere Dosis von 375 mg/m2 Rituximab zu erhalten [5].
Das Ergebnis war enttäuschend, so Pieternella Lugtenburg, Rotterdam: Beim primären Endpunkt, einer metabolischen Komplettremission im PET-CT, war kein Unterschied zwischen beiden Armen zu erkennen (84% im Standard- versus 82% im experimentellen Arm). Ähnliches galt für die 3- und 5-Jahres-Raten für das progressionsfreie Überleben, und diese Ergebnisse waren unabhängig von Alter und Geschlecht.
Es gab in der Studie eine zweite Randomisierung für die Patienten, die in der Induktionstherapie eine Komplettremission erreichten. Sie sollten danach entweder eine Erhaltungstherapie mit Rituximab bekommen oder nur beobachtet werden. Ergebnisse hierzu gibt es noch nicht, so Lugtenburg.
Langzeitfolgen der Therapie
Die intensiven Chemotherapien, die Patienten mit Non-Hodgkin-Lymphomen erhalten, sind ebenfalls mit Langzeit-Toxizitäten assoziiert. Allerdings ist bisher wenig darüber bekannt, wie sich das vor gut eineinhalb Jahrzehnten in die Behandlung eingeführte Rituximab darauf auswirkt. Hämatologen in der französischen LYSA-Studiengruppe wollten diese Fragestellung in einem großen Kollektiv von Patienten angehen und brachten die Adressen von 3.317 Patienten in Erfahrung, die in zwölf LYSA-Studien zwischen 1993 und 2007 wegen eines Non-Hodgkin-Lymphoms behandelt worden waren und noch lebten [6]. Die beiden Fragebögen zu Fatigue und zur Lebenssituation wurden von der Hälfte der Patienten beantwortet.
Nach median elfjähriger Nachbeobachtung, so Nicolas Mounier, Nizza, berichteten 20% der Patienten über kardiovaskuläre Komplikationen, 17% über neuro-psychiatrische Störungen, 12% über Infektionen, 11% über muskuloskelettale Störungen, 8% über Lungenerkrankungen, 5% über Erkrankungen des Verdauungstraktes und 8% über sekundäre Neoplasien. Interessanterweise war die Gabe von Rituximab mit signifikant weniger Sekundärtumoren (6% vs. 9%; p = 0,02) und kardiovaskulären Störungen (17% vs. 23%; p = 0,006) assoziiert, eine autologe Stammzelltransplantation hingegen mit signifikant mehr Infektionen (17% vs. 11%; p = 0,002) und Lungenerkrankungen (12% vs. 7%; p = 0,005). Beinahe zwei Drittel der Patienten berichteten über persistierende Fatigue (≥ 40 Punkte im MFI-20-Fragebogen), die aber nicht von der Art der Therapie abhängig war.
Was für das Hodgkin-Lymphom seit Längerem bekannt ist, wird durch diese große Auswertung auch für Non-Hodgkin-Lymphome bestätigt: Eine Lymphom-Therapie beeinträchtigt bei der Mehrzahl der Patienten den Gesundheitszustand langfristig. Beruhigend ist immerhin, dass die Zugabe von CD20-Antikörpern hier keine Verschlechterung zu bewirken scheint.
Antiinfektive Prophylaxe reduziert Mortalität bei Älteren
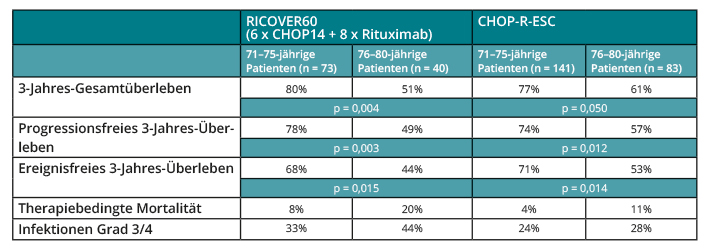
Auf infektiöse Komplikationen und die behandlungsbedingte Mortalität konzentrierte sich eine Analyse der Deutschen Studiengruppe für Hochmaligne Non-Hodgkin-Lymphome (DSHNHL), in die 1.171 über 60-jährige Patienten mit aggressiven Lymphomen eingingen, die in der RICOVER60- und in der CHOP-R-ESC-Studie behandelt worden waren und dort das R-CHOP14-Regime erhalten hatten [7]. Nach Adjustierung für den International Prognostic Index (IPI), so Florian Zettl, Traunstein, zeigte sich ein deutlicher Anstieg von Infektionen und therapiebedingter Mortalität zwischen den Subgruppen der 71–75- und der 76–80-Jährigen (s. Tab. 1). Dosisreduktionen waren in der letzteren Gruppe am häufigsten, und bis zu 70% dieser Patienten konnten nicht alle Zyklen der Therapie erhalten. Interessanterweise konnte eine routinemäßig verabreichte antiinfektive Prophylaxe in der CHOP-R-ESC-Studie die Raten der Infektionen deutlich reduzieren und die behandlungsbedingte Sterblichkeit nahezu halbieren (s. Tab. 1).
Josef Gulden
Literatur
1. Borchmann S et al. #S109).
2. Park SI et al. J Clin Oncol 2016 (15S; ASCO 2016, Abstract #7508).
3. Chen RW et al. J Clin Oncol 2016 (15S; ASCO 2016, Abstract #7555).
4. Engert A et al. Haematologica 2016; 101 (s1; EHA 2016, Abstract #S793).
5. Lugtenburg PJ et al. J Clin Oncol 2016 (15S; ASCO 2016, Abstract #7504).
6. Mounier N et al. J Clin Oncol 2016 (15S; ASCO 2016, Abstract #7518).
7. Zettl F et al. J Clin Oncol 2016 (15S; ASCO 2016, Abstract #7539).
8. Zinzani PL et al. Haematologica 2016; 101 (s1; EHA 2016, Abstract #S797).


