Zervixkarzinom: Prävention, Diagnostik und Therapie
Weltweit ist das Zervixkarzinom, nach dem Mammakarzinom, der zweithäufigste maligne Tumor der Frau. Die Erkenntnis, dass die überwiegende Mehrzahl dieser Tumoren durch humane Papillomviren (HPV) ausgelöst wird, hat erstmals in der Geschichte zu einer präventiven Impfung gegen eine onkologische Erkrankung geführt, die in Deutschland für Mädchen ab dem neunten Lebensjahr empfohlen wird. Bereits in der Vergangenheit konnten Inzidenz und Mortalität des Zervixkarzinoms durch systematische Vorsorgeuntersuchungen, vor allem durch die zytologische Untersuchung von Abstrichpräparaten, stark reduziert werden. Welche Rolle der HPV-Nachweis bei der Vorsorge spielen soll, wird derzeit von G-BA und IQWiG bewertet. Die operativen Methoden zur Behandlung des Zervixkarzinoms wurden in den letzten Jahrzehnten weiterentwickelt, insbesondere auch durch die Einführung schonender laparoskopischer Zugangswege. Man geht davon aus, dass dadurch die Morbidität bei gleicher onkologischer Sicherheit verbessert werden kann, aber noch fehlt der letzte Nachweis durch kontrollierte, randomisierte Studien. Die therapeutischen Möglichkeiten beim fortgeschrittenen Zervixkarzinom sind noch entwicklungsfähig; immerhin ist mittlerweile der anti-angiogene Antikörper Bevacizumab als zusätzliche, lebensverlängernde Option zur Chemotherapie hinzugekommen.
Die Inzidenz des Zervixkarzinoms lag in Deutschland 2011 und 2012 bei 4.720 bzw. 4.640 Neuerkrankungen pro Jahr und bewegt sich damit weiterhin auf einem niedrig stabilen Niveau, das etwa seit den 1990er-Jahren beobachtet wird, nachdem die Inzidenz nach Einführung des Krebsfrüherkennungsprogramms drastisch zurückgegangen war [1]. Das mittlere Erkrankungsalter liegt deutlich niedriger als bei anderen gynäkologischen Tumoren: Invasive Zervixkarzinome werden bei im Mittel 53-jährigen Frauen diagnostiziert, In-situ-Karzinome, die zwei- bis dreimal häufiger sind, schon in einem mittleren Alter von 34 Jahren. Ungefähr 1.600 Todesfälle gehen in Deutschland derzeit jährlich auf Zervixkarzinome zurück, die Überlebensrate fünf Jahre nach Diagnose eines invasiven Tumors liegt bei 68%.
Weltweit ist das Zervixkarzinom der zweithäufigste weibliche Tumor. Nachdem es in Deutschland in den 1970er-Jahren noch der häufigste bösartige Tumor bei Frauen war, stand es hier 2012 mit einem Anteil von 1,6% nur noch an zwölfter, bezüglich der Krebssterbefälle an 16. Stelle in Deutschland. Der wichtigste Grund für diesen dramatischen Rückgang von Inzidenz und vor allem Mortalität ist die Einführung der Früherkennung durch die regelmäßige zytologische Untersuchung von Abstrichen im Jahr 1971. Die HPV-Impfung, die seit 2007 von der Ständigen Impfkommission empfohlen wird, dürfte zu einem weiteren deutlichen Rückgang führen, wenn die Durchimpfungsraten weiter gesteigert werden können.
Ätiologie und Risikofaktoren beim Zervixkarzinom
Histologisch sind ungefähr drei Viertel aller Zervixkarzinome Plattenepithelkarzinome, etwa jeder fünfte Tumor ist ein Adenokarzinom, dessen Ursprung dann am Übergang zwischen Zervix und Korpus liegt. Das Zervixkarzinom ist der erste menschliche Tumor, für den eine virale Ätiologie zweifelsfrei nachgewiesen werden konnte [2]. Auslösendes Agens dürften in so gut wie allen Fällen DNA-Viren aus der Familie Papillomaviridae, die humanen Papillomviren (HPV) sein. Von den mehr als 100 beschriebenen Typen werden ungefähr 30 im Anogenital-Trakt gefunden. Von klinischer Bedeutung für die Ätiologie des Zervixkarzinoms sind insbesondere Hochrisiko-Typen, die für die Entstehung zervikaler intraepithelialer Neoplasien („cervical intraepithelial neoplasia“, CIN) bzw. des Zervixkarzinoms verantwortlich sind: Man findet sie in 99% aller zervikalen Malignome. Die International Agency for Research on Cancer (IARC) stufte bisher die HPV-Typen 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58 und 59 als kanzerogen ein [3]. In fast allen Zervixkarzinomen lassen sich HP-Viren der Hochrisiko-Gruppe nachweisen; die größte Bedeutung haben die Typen 16 und 18, die man in 70% dieser Tumoren findet [4].
Umgekehrt bedeutet aber eine Infektion mit einem Hochrisiko-HPV, die in der Regel bei ungeschütztem Geschlechtsverkehr stattfindet, keineswegs zwingend eine Erkrankung an einem Zervixkarzinom: Bei nur ungefähr jeder zehnten bis 20. Frau persistiert eine solche Infektion, und nur bei 2–3% entwickelt sich tatsächlich ein maligner Tumor [5].
Die Viren zeigen einen Tropismus für die Basalzellen der Transformationszone der Zervix. Die Infektion kann ein ganzes Spektrum von Verläufen zeigen – von einer lediglich latenten Infektion mit nachfolgender Ausheilung bis hin zur Entwicklung von CIN und Karzinomen der Zervix, die im Einzelfall von verschiedenen Faktoren abhängen (z. B. Art und Stärke der Immunreaktion, onkogene Potenz des Virus). Ein entscheidender Schritt bei der Karzinogenese ist die Integration der viralen DNA in das Genom der Wirtszelle, wobei die Inaktivierung des viralen E2-Gens wichtig zu sein scheint: Dieses kann dann nicht mehr seiner Funktion nachkommen, die in der Suppression der Expression der Gene E6 und E7 des Virus besteht. Werden diese beiden Gene unkontrolliert exprimiert, so können sie die Wirkung von Tumorsuppressor-Genen in der Wirtszelle hemmen und dadurch die maligne Entartung anstoßen [5].
Man nimmt an, dass von der Entstehung erster Dysplasien bis zur vollen Expression eines invasiven Karzinoms durchschnittlich etwa 10–15 Jahre vergehen, abhängig vom Schweregrad der Dysplasie. Für diese Annahme spricht, dass diese Zeitangaben in etwa mit der Differenz zwischen dem bekannten Durchschnittsalter bei Erstdiagnose dieser Tumoren und dem Beginn der sexuellen Aktivität, bei der die Infektion erfolgen könnte, korrespondieren.
Weitere Risikofaktoren, wenngleich von nachgeordneter Bedeutung, sind Rauchen, Infektionen im Genitalbereich mit anderen sexuell übertragbaren Erregern wie Herpes simplex-Viren oder Chlamydien, ein früher Beginn der sexuellen Aktivität, sexuelle Promiskuität, viele Geburten sowie eine Immunschwäche. Auch die langfristige Einnahme oraler Kontrazeptiva scheint das Erkrankungsrisiko leicht zu erhöhen; diese Erhöhung ist nach dem Absetzen der oralen Kontrazeption aber wieder rückläufig [1, 6, 7].
Prävention des Zervixkarzinoms
Primärprävention = Impfung
Mit dem Nachweis der ätiologischen Rolle von HPV für das Zervixkarzinom ist es erstmals möglich geworden, eine Impfstrategie zur Eindämmung dieser Erkrankung zu entwickeln. Es gibt bisher zwei Impfstoffe gegen die zahlenmäßig bedeutendsten Virustypen: Beide Vakzinen, die in Deutschland mittlerweile zur Impfung von Mädchen ab dem neunten Lebensjahr zugelassen sind und von der Ständigen Impfkommission empfohlen werden [8], decken die beiden häufigsten Virustypen 16 und 18 ab, eines der Präparate wurde weiterentwickelt und richtet sich darüber hinaus gegen weitere sieben HPV-Typen.
Der frühe Zeitpunkt einer möglichen Impfung ist der Tatsache geschuldet, dass ein Teil der Mädchen bereits in sehr frühem Alter erste sexuelle Erfahrungen macht: Nach einer Studie der Bundeszentrale für gesundheitliche Aufklärung zum Sexualverhalten in Deutschland hatten 2009 10% der Mädchen ihren ersten Geschlechtsverkehr bereits vor dem 14. und die Hälfte vor dem 16. Lebensjahr gehabt, und das häufig ungeplant, sodass eine gynäkologische Beratung meist erst später möglich war. Da jeder Verkehr ein potenzielles Infektionsrisiko birgt, entfaltet die Impfung auf Populationsebene ihre stärkste Wirkung, wenn so viele Mädchen wie möglich sie vor dem ersten Verkehr erhalten. Würde die Hälfte der Mädchen bis zum zwölften Lebensjahr geimpft, so könnten dadurch einer Modellrechnung zufolge in den kommenden hundert Jahren rund 100.000 Neuerkrankungen an Zervixkarzinomen und etwa 24.000 Todesfälle verhindert werden [9].
Sekundärprävention = Früherkennung
Wenn es, wie erwähnt, von der Entstehung erster Dysplasien bis zur vollen Expression eines invasiven Karzinoms durchschnittlich etwa 10–15 Jahre dauert und wenn die Läsionen außerdem an einer mit wenig invasiven Methoden zugänglichen Stelle liegen, wie sie der Gebärmutterhals darstellt, sind das ausgezeichnete Voraussetzungen für eine Sekundärprävention, bei der es darum geht, maligne Vorstufen von Tumoren frühzeitig zu erkennen und zu entfernen und so die Entstehung invasiver Spätstadien zu verhindern. Die Methoden der Früherkennung sind in diesem Fall die HPV-Testung und regelmäßige zytologische Kontrollen. Diese Strategie, deren zytologische Komponente in Deutschland Anfang der 1970er-Jahre implementiert und später um die HPV-Testung ergänzt wurde, hat zu einem deutlichen Rückgang von Erkrankungen an Zervixkarzinomen geführt. Nicht übersehen darf man dabei aber das Risiko einer Übertherapie: Die meisten positiven (auch falsch-positiven) Befunde fallen bei Frauen im gebärfähigen Alter an, wo ein möglicherweise nicht nötiger Eingriff das Risiko für Frühgeburten und perinatale Mortalität erhöhen kann [10].
Die Ausgestaltung der Zervixkarzinom-Vorsorge in Deutschland befindet sich zurzeit in der Diskussion. Traditionell besteht sie seit Einführung vor etwa 45 Jahren aus der jährlichen Entnahme eines Abstrichs, der zytologisch nach Papanicolaou auf verdächtige Zellen kontrolliert wird. In einigen Ländern liegt das Untersuchungsintervall zwischen drei und fünf Jahren, die europäischen Leitlinien empfehlen ein Intervall von mindestens drei Jahren, weil bei kürzeren Intervallen die Rate falsch-positiver Befunden zunehmen soll, ohne dass sich die Prävention verbessert [11]. In Deutschland ist die Inzidenz des Zervixkarzinoms aber im Vergleich zu anderen Ländern, die ein organisiertes Screening durchführen, zumindest nicht schlechter – tatsächlich scheint sie hierzulande sogar weiter abzunehmen.
Ein weiterer Punkt, der derzeit intensiv diskutiert wird, ist die Implementierung eines HPV-Tests in die Vorsorge-Routine, eventuell in Kombination mit einem zytologischen Abstrich. Grundlage für diese Diskussion ist eine große prospektive, randomisierte finnische Studie, in der zwischen 2003 und 2005 von über 100.000 Frauen im Alter zwischen 25 und 65 Jahren, die zur Vorsorge gebeten wurden, knapp zwei Drittel tatsächlich teilnahmen [12]. Randomisiert wurde zwischen der traditionellen zytologischen Abstrichkontrolle und einer primären HPV-Testung, auf die nur bei einem auffälligen Befund eine zytologische Untersuchung folgte. Insgesamt zeigte das von der Zytologie gefolgte HPV-Screening die gleiche Spezifität von über 99% wie die konventionelle alleinige Zytologie. Bei den Frauen, die mindestens 35 Jahre alt waren, war das HPV-Screening mit nachfolgender Zytologie tendenziell sensitiver. Allerdings wurden mehr Frauen aus der HPV-Screening-Gruppe einem intensivierten Follow-up, d. h. einer kolposkopischen Untersuchung zugeteilt als aus der Kontrollgruppe, die nur einen zytologischen Abstrich erhalten hatte. Da Langzeitdaten fehlen, kann man noch nicht abschätzen, welchen Anteil an Übertherapie die beiden Teststrategien jeweils nach sich ziehen oder wie sie sich auf die Lebensqualität der Patientinnen auswirken.
In einer Pilotstudie in Wolfsburg [13] wurden 16.724 Patientinnen mittels HPV-DNA-Test und konventioneller Zytologie untersucht. Diejenigen mit unauffälligen Befunden in beiden Tests sollten weiter jährlich gynäkologisch, aber erst nach fünf Jahren wieder mittels HPV- und Zytologie-Test untersucht werden. Waren beide Tests positiv, wurden sie sofort zur Kolposkopie überweisen, und im Fall eines positiven HPV- und eines negativen Pap-Tests wurde letzterer nach sechs Monaten und der Abstrich nach einem Jahr wiederholt. War der HPV-Test dauerhaft positiv, so folgte auch hier eine Kolposkopie. 5,41% der Frauen wiesen beim ersten Termin einen positiven HPV-Test und 2,02% atypische Befunde im Abstrich auf. Lediglich 2,48% der Patientinnen mussten sich letztlich einer Kolposkopie unterziehen, und von ihnen wies etwa jede vierte eine zervikale intraepitheliale Neoplasie (CIN) vom Grad 3 oder höher auf, darunter acht invasive Tumoren und acht In-situ-Adenokarzinome.
Leider verzögert sich die Veröffentlichung einer aktualisierten Version der S3-Leitlinie zur Prävention des Zervixkarzinoms, von der dringend neue Empfehlungen zur Durchführung des Screenings erwartet werden. Einigkeit besteht aber darin, dass der erste invasive Diagnoseschritt nicht eine Konisation, sondern eine Biopsie unter kolposkopischer Kontrolle sein sollte. Die Konisation geht nämlich, abhängig von der Tiefe des Eingriffs, mit einer Erhöhung des Risikos für Frühgeburten einher. Die diagnostische Sensitivität der gezielten Biopsieentnahme unter kolposkopischer Kontrolle ist genauso hoch; wird im Verlauf eine Konisation notwendig, so kann sie unter kolposkopischer Kontrolle immer noch problemlos erfolgen.
Diagnostik des Zervixkarzinoms
Diagnostiziert wird ein invasives Zervixkarzinom in der Regel nach zytologischer Kontrolle eines Pap-Abstrichs und der nachfolgenden Entnahme einer Biopsie, die histologisch untersucht wird. Die Einteilung von Zervixkarzinomen in Stadien erfolgt nach der Klassifikation der International Federation of Gynecology and Obstetrics (FIGO; Tab. 1; [14]), die im Wesentlichen auf der Klinik basiert und bei der bildgebende Verfahren sowie operatives Staging im Hintergrund stehen. Begründet wird das mit den begrenzten infrastrukturellen Möglichkeiten in den Ländern, in denen das Zervixkarzinom am häufigsten auftritt. Die derzeit gültige deutsche S3-Leitlinie empfiehlt demgegenüber, in Anpassung an die qualitativ höherwertigen Versorgungsstrukturen in Deutschland, auch radiologische Verfahren vom Ultraschall bis zur Positronenemissions-Tomografie (PET) einzusetzen [15].
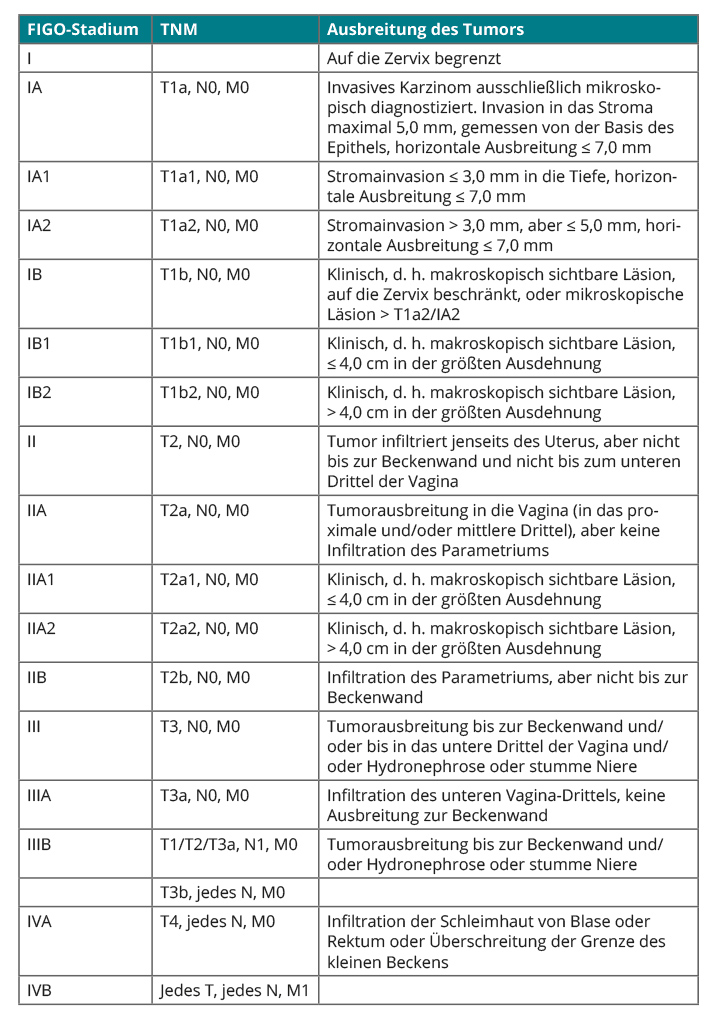
Um die lokoregionäre Tumorausbreitung abzuschätzen, eignen sich vaginaler Ultraschall, Ultraschall der Nieren und die Kernspintomografie (MRT). Letztere ist beispielsweise hinsichtlich der Beurteilung der Parametrien ab einem Stadium von FIGO IB2 der rein klinischen Untersuchung mit einer Sensitivität von 84% versus 40% überlegen [16], während sich der vaginale Ultraschall v. a. in frühen Stadien bei der Einschätzung der Größe des Tumors und des Ausmaßes einer Stroma-Invasion durch hohe Treffsicherheit auszeichnet [17, 18].
Zur Detektion eventuell vorliegender Fernmetastasen empfiehlt die aktuelle S3-Leitlinie eine Computertomografie (CT) von Thorax und Abdomen [15]. Die Klärung des Lymphknotenstatus ist jedoch weiter eine Domäne des operativen Stagings, weil sich weder mit MRT noch mit CT und nicht einmal mit FDG-PET hier eine zufriedenstellende Sensitivität erzielen lässt. Verließe man sich deshalb präoperativ primär auf die Bildgebung, so würde das intraoperativ häufig eine Anpassung der Operationsstrategie erzwingen. Das operative Staging stellt damit nach wie vor die Methode der Wahl zur präzisen Beurteilung der Situation dar.
Therapie des Zervixkarzinoms
Sowohl beim Staging als auch bei der chirurgischen Therapie des Zervixkarzinoms spielen laparoskopische Operationsverfahren eine immer wichtigere Rolle, z. B. die laparoskopisch assistierte radikale vaginale Hysterektomie (LARVH), die vaginal assistierte laparoskopische radikale Hysterektomie (VALRH), die total laparoskopische radikale Hysterektomie (TLRH) oder die Roboter-assistierte radikale Hysterektomie (RRH). Offene und laparoskopische Methoden gelten derzeit bezüglich der onkologischen Sicherheit als gleichwertig, unterscheiden sich aber bei Komplikationen und Nebenwirkungen [19]: So werden bei Anwendung der offenen Verfahren mehr Blutverlust, eine längere Liegezeit in der Klinik und postoperativ mehr Infektionen registriert als bei laparoskopischem Vorgehen. Bei letzterem wiederum treten häufiger Verletzungen der Harnblase auf. Ein sicheres Urteil ist hier noch nicht möglich, weil es bisher nur wenige prospektive und randomisierte Studien gibt. In der Phase-III-Studie Laparoscopic Approach to Cervical Cancer (LACC; [20] werden total laparoskopische radikale Hysterektomie und Roboter-assistierte radikale Hysterektomie mit der offenen radikalen Hysterektomie verglichen, aber die Studie rekrutiert noch, sodass die Ergebnisse noch nicht so bald zur Verfügung stehen werden. Die derzeit gültige S3-Leitline [15] spricht die konsensbasierte Empfehlung aus, dass man die laparoskopische radikale Hysterektomie ebenso wie die abdominale radikale Hysterektomie anwenden kann.
Nach wie vor unklar ist, ob bei befallenen Lymphknoten (im Becken oder paraaortal) vor einer Radiochemotherapie eine Hysterektomie durchgeführt werden sollte. Die S3-Leitlinie weist darauf hin, dass Patientinnen, die sich einer sekundären Hysterektomie nach primärer Radiochemotherapie unterziehen, davon keinen Überlebensvorteil haben, aber an stärkerer Morbidität leiden. Daraus wird gefolgert, dass eine radikale Hysterektomie vor der Radiochemotherapie bei befallenen Becken- und/oder paraaortalen Lymphknoten keinen Nutzen bringt. Die Hysterektomie sei daher kritisch zu diskutieren, eine Erweiterung des Bestrahlungsfeldes bei Diagnose positiver Lymphknoten aber auf jeden Fall erforderlich [15].
Rolle der Biopsie des Sentinel-Lymphknotens
Metastasierte Lymphknoten lassen sich mit bildgebenden Verfahren nicht sicher darstellen, andererseits ist die systematische Lymphonodektomie hier mit einem hohen Komplikationsrisiko während und nach dem Eingriff belastet (Lymphödeme, Lymphozelen, Parästhesien etc.). Die Biopsie eines Sentinel-Lymphknotens, wie sie zuerst beim Melanom und beim Mammakarzinom eingeführt wurde, sollte daher eine gangbare Alternative darstellen, mit der sich ein exaktes Staging erreichen lässt, ohne dass sich dadurch die Morbidität wesentlich erhöht. In einer Metaanalyse von 23 Studien mit über 800 Patientinnen [21] zeigte sich, dass die kombinierte Anwendung der 99m-Technetium-Kolloid-Szintigrafie und der Färbung mit Patentblau die Methode der Wahl ist, mit der sich eine Sensitivität von 92% und eine Spezifität von 97% erreichen lassen. Der Sentinel-Lymphknoten konnte durch die kombinierte Anwendung von 99mTc und des blauen Farbstoffs in 97% der Fälle korrekt identifiziert werden, mit alleiniger Szintigrafie nur bei 88% und mit dem Farbstoff alleine nur bei 84% der Patientinnen. Die Ergebnisse waren nicht unterschiedlich, wenn offen oder laparoskopisch operiert worden war.
In einer Validierungsstudie der Arbeitsgemeinschaft Gynäkologische Onkologie (AGO; [22]) wurden 590 Patientinnen mit Zervixkarzinomen aller Stadien behandelt und mit Technetium, Patentblau oder mit beiden Techniken nach dem Sentinel-Lymphknoten gesucht. Er wurde in 88,6% der Fälle gefunden, bei Anwendung beider Markierungstechniken in 93,5%. Von 106 Patientinnen mit Metastasen in Beckenlymphknoten konnte bei 82 ein positiver Sentinel-Lymphknoten detektiert werden, entsprechend einer Sensitivität von 77,4%. Eine retrospektiv durchgeführte Subgruppenanalyse ergab allerdings, dass bei Frauen mit Tumoren einer Größe von ≤ 20 mm (das traf auf neun von zehn Patientinnen zu) die Sensitivität höher war: Bei bilateraler Detektion lag sie bei 87,2%, bei Anwendung beider Markierungstechniken bei 80,3%. Der negative prädiktive Wert betrug insgesamt 94,3%, bei einer Tumorgröße von ≤ 20 mm sogar 99,1%, d. h. bei lediglich einer von hundert solchen Patientinnen würde ein Befall des Sentinel-Lymphknotens nicht erkannt werden.
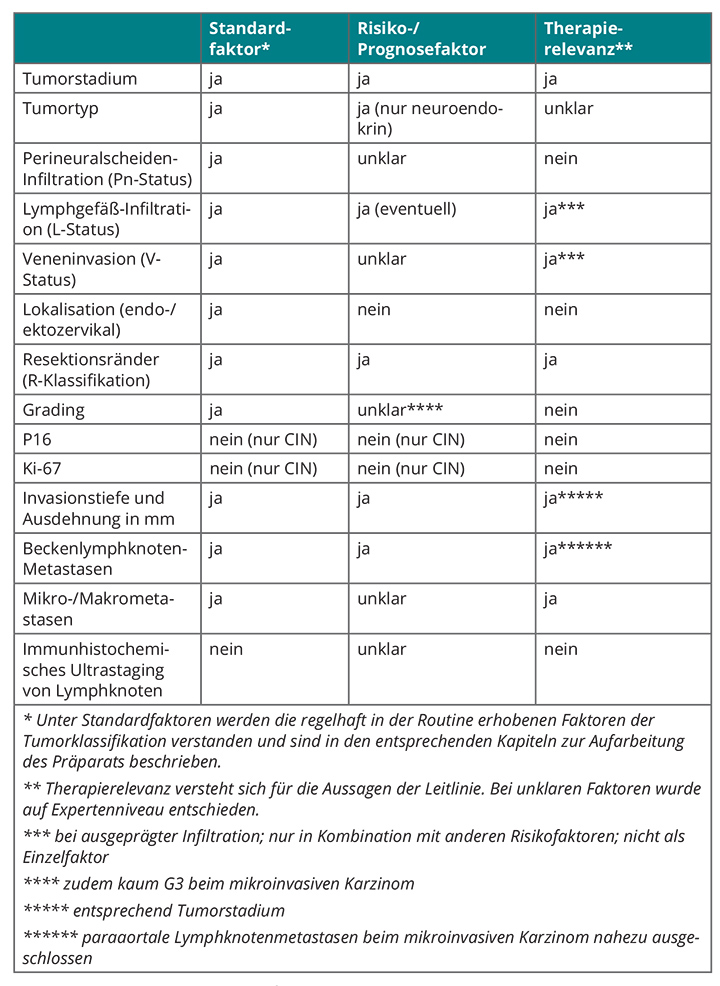
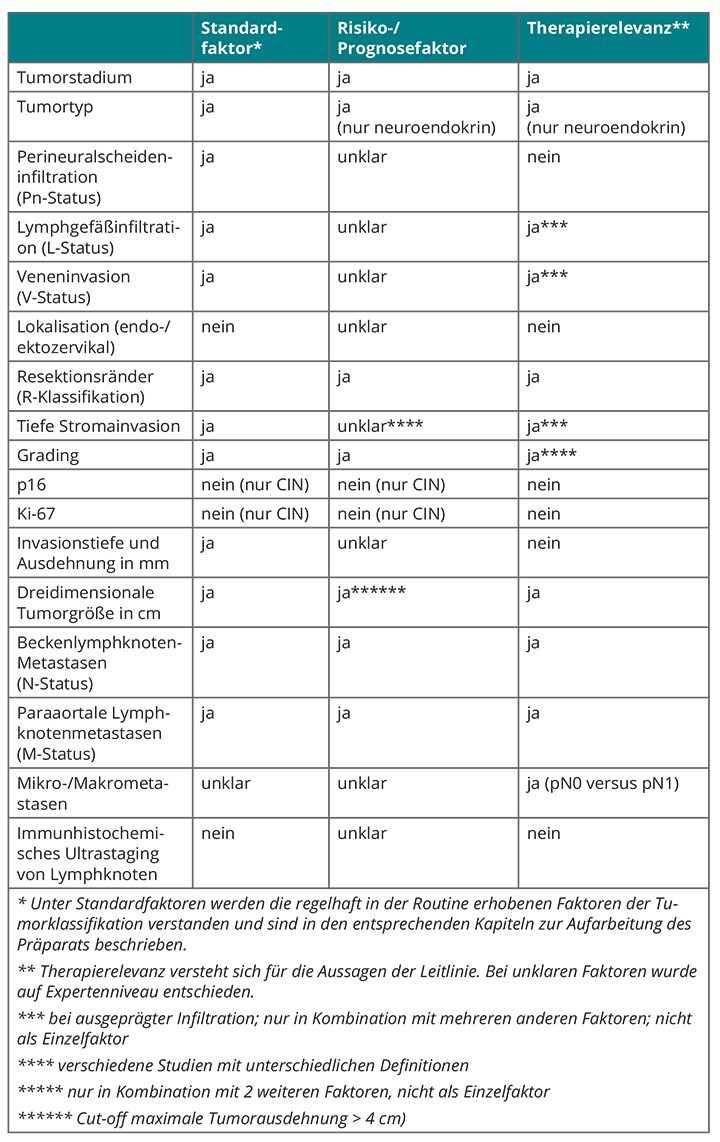
In der S3-Leitlinie wird die alleinige Biopsie des Sentinel-Lymphknotens nicht als Standardverfahren betrachtet. Sie hat nur Aussagekraft bei präoperativer beidseitiger Darstellung mittels Szintigrafie, beidseitiger intraoperativer Darstellung von Sentinel-Lymphknoten, einem Primärtumor von < 20 mm Durchmesser ohne Risikofaktoren (Tab. 2, 3) und bei Entnahme aller bildgebend dargestellten Sentinel-Lymphknoten. Die Markierung muss auf jeden Fall mit Patentblau und einem radioaktiven Tracer erfolgen [15], und die Patientin muss immer über das Risiko eines falsch-negativen Befundes aufgeklärt werden. Ob die Sentinel-Lymphknoten-Biopsie der systematischen Lymphonodektomie hinsichtlich des Gesamtüberlebens gleichwertig ist, werden die Ergebnisse der an der Charité in Berlin durchgeführten Studie „Sentinel Concept in Early Stage Cervical Cancer“ zeigen [23].
Radio(chemo)therapie
Eine primäre Radiotherapie ist in Kombination mit einer Cisplatin-haltigen Chemotherapie Standard für Tumoren ab einem Stadium FIGO IIB. Einer Cochrane-Analyse zufolge verbessert die Hinzunahme der Chemo- zur Radiotherapie die Überlebenschancen um 13% [24]. Im Stadium IIA und IIB ohne Risikofaktoren (Tab. 2, 3) sind Operation und primäre Radiochemotherapie gleichwertig, was das onkologische Ergebnis angeht.
Eine adjuvante Radiochemotherapie ist der Studie 109 der Gynecologic Oncology Group (GOG) zufolge angezeigt, wenn Lymphknotenmetastasen, eine ausgedehnte Parametrien-Infiltration und positive Resektionsränder vorliegen [25]. In der GOG-Studie 92 wird sie ab dem Vorliegen von zwei Risikofaktoren (Tab. 2, 3) empfohlen [26], aber in der aktuellen deutschen S3-Leitlinie werden drei postoperativ gesicherte Risikofaktoren gefordert, um die Indikation für eine Radiochemotherapie zu stellen, weil einige der Risikofaktoren als möglicherweise nicht so relevant angesehen werden [15]. Derzeit gibt es keine Daten aus Vergleichsstudien zwischen adjuvanter Radiochemotherapie und keiner zusätzlichen Therapie.
Operative Therapie des Zervixkarzinoms
Die operative Therapie richtet sich nach dem Tumorstadium (Tab. 1) und der Zahl vorliegender Risikofaktoren (Tab. 2, 3):
• Bei Patientinnen mit Zervixkarzinom des Stadiums IA1 mit höchstens einem Risikofaktor, die einen Kinderwunsch äußern, ist eine Beschränkung des Eingriffs auf eine Konisation mit Zervix-Kürettage ausreichend, sofern sie in sano erfolgt. Zeigt das Konisations-Präparat positive Schnittränder, kann man die Konisation wiederholen oder eine Trachelektomie durchführen. Ist die Familienplanung abgeschlossen, kann man, wenn die Patientin dies wünscht, eine sekundäre Hysterektomie durchführen. Die S3-Leitlinie empfiehlt hier keine Radiochemotherapie und auch keine Lymphonodektomie [15], obwohl sich bei einigen Patientinnen mit Lymphgefäß-Infiltration (L1) auch Lymphknotenmetastasen finden [27].
• Im Stadium FIGO IA1 mit mindestens zwei Risikofaktoren und im Stadium FIGO IA2 mit maximal einem Risikofaktor ist bei bestehendem Kinderwunsch das gleiche Vorgehen möglich, wenn beim operativen Staging histologisch negative Lymphknoten nachgewiesen werden konnten. Auch hier empfiehlt sich nach Abschluss der Familienplanung eine Hysterektomie ohne Resektion der Parametrien. Bei Metastasen in Beckenlymphknoten bzw. einem positiven Sentinel-Lymphknoten muss das operative Staging auch die Dissektion der paraaortalen Lymphknoten umfassen. Weil bei Nachweis von Lymphknoten-Metastasen eine Radiochemotherapie indiziert ist, sollte zum Schutz der Eierstöcke eine Ovariopexie durchgeführt werden.
• Im Stadium FIGO IA2 mit mindestens zwei Risikofaktoren ist das Risiko so hoch, dass eine radikale Hysterektomie mit Resektion der Parametrien indiziert ist. Bei Befall der Beckenlymphknoten ist ebenfalls eine paraaortale Lymphonodektomie mit anschließender Radiochemotherapie angezeigt – mit vorsorglicher Ovariopexie, wenn die Patientin ihre Ovarien behalten möchte.
• Weist der Tumor ein Stadium FIGO IB1 oder IIA1 auf, besteht noch Kinderwunsch, misst der Tumor < 20 mm und hat das operative Staging keine Risikofaktoren ergeben, so kann man eine radikale Trachelektomie mit permanenter Cerclage verantworten. Nach Abschluss der Familienplanung soll aber eine radikale Hysterektomie mit Resektion der Parametrien vorgenommen werden; abhängig von der Tumorausdehnung wird außerdem eine tumorfreie Scheidenmanschette reseziert. Bei Metastasen in Beckenlymphknoten ist auch hier die Resektion der paraaortalen Lymphknoten erforderlich. Die Ovarien kann man bei prämenopausalen Patientinnen belassen; sie werden mittels Ovariopexie geschützt, wenn sich aufgrund positiver Lymphknoten oder wegen Inoperabilität oder Verzicht auf die Operation aus anderen Gründen eine Radiochemotherapie anschließt.
• Wenn das operative Staging in den Stadien FIGO IB2, IIA2 und IIB keine Metastasen in den Beckenlymphknoten ergibt, so wird eine radikale Hysterektomie durchgeführt, wobei besonders auf tumorfreie Schnittränder der Scheidenmanschette zu achten ist. Sind die Beckenlymphknoten positiv, werden auch die paraaortalen Lymphknoten entfernt und untersucht. Ein Adenokarzinom ist Anlass zur Salpingo-Oophorektomie. Positive Lymphknoten, ein Stadium FIGO IIB oder Inoperabilität stellen eine Indikation für eine Radiochemotherapie dar. Die aktuelle S3-Leitlinie empfiehlt ab einem Stadium FIGO IIB die primäre Radio(chemo)therapie anstelle der Operation [15].
• Im Stadium FIGO III ist eine Radiochemotherapie die Therapie der Wahl, aber nur nach vorangegangenem operativem Staging. Makroskopisch befallene Lymphknoten werden vor geplanter Radiochemotherapie reseziert.
• Im Stadium FIGO IVA ist laut S3-Leitlinie [15] in einzelnen Fällen noch eine primäre Exenteration denkbar. Dies stellt eine Expertenempfehlung dar, weil es für den Nutzen eines solchen Vorgehens keine belastbaren Daten gibt. Im Stadium FIGO IVB wird mit primär palliativer Zielsetzung behandelt, um in erster Linie die Symptome zu kontrollieren.
Medikamentöse Therapie bei Lokalrezidiv bzw. in der metastasierten Situation
Das Zervixkarzinom und seine Metastasen sind gegenüber Chemotherapien weniger empfindlich als andere gynäkologische Tumoren. Die Autoren der S3-Leitlinie zitieren eine Cochrane-Metaanalyse von 2012, in der der Wissensstand dazu zusammengefasst wird [28]: Am häufigsten wird beim Zervixkarzinom Cisplatin verwendet (50 mg/m2 alle drei Wochen) – bei niedrigen Ansprechraten und einer progressionsfreien Überlebenszeit von median lediglich drei Monaten. Carboplatin dürfte ähnlich wirksam sein, aber es gibt keine direkten Vergleichsstudien.
Kombinationen aus Cisplatin und anderen Zytostatika verbessern im Vergleich zur Monotherapie die Ansprechrate, aber auf Kosten höherer Toxizität. Ein Überlebensvorteil gegenüber der Cisplatin-Monotherapie konnte bislang nur für die Kombination von Cisplatin mit Topotecan gezeigt werden [29]. Cisplatin plus Paclitaxel scheint genauso wirksam bei weniger Nebenwirkungen zu sein [28]. Rezidive innerhalb einer zuvor bestrahlten Region sprechen signifikant schlechter auf die Chemotherapie an als Metastasen außerhalb des Strahlenfeldes [28]. Ein weiteres Problem stellt der zunehmende Einsatz von Platinsalzen in der Primärtherapie (in der Regel im Kontext einer Radiochemotherapie) dar: Rezidive und Metastasen sprechen danach schlechter auf Cisplatin mit oder ohne Topotecan an [191, 490].
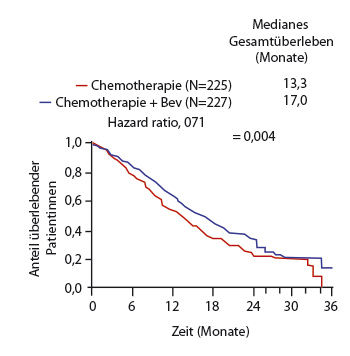
Seit April 2015 ist zur Therapie des persistierenden, rezidivierten oder metastasierten Zervixkarzinoms auch der anti-angiogene Antikörper Bevacizumab zugelassen – in Kombination mit Paclitaxel/Cisplatin oder bei Patientinnen, die keine platinhaltige Therapie bekommen können, mit Paclitaxel/Topotecan. Diese Zulassung beruht auf einer Phase-III-Studie, in der 452 Patientinnen mit fortgeschrittenem Zervixkarzinom (72% rezidiviert, 70% im Rahmen einer primären Radiochemotherapie mit Cisplatin vorbehandelt) in vier Arme randomisiert worden waren [30]: Sie erhielten in einer 2 x 2-Randomisierung dreiwöchige Zyklen mit entweder Cisplatin/Paclitaxel oder Topotecan/Paclitaxel, jeweils mit oder ohne Bevacizumab (15 mg/kg an Tag 1 jedes Zyklus). Die Therapie wurde bis zum Progress oder dem Eintreten einer kompletten Remission oder dem Auftreten von inakzeptablen Toxizitäten gegeben. In den mit Bevacizumab behandelten Armen war die Ansprechrate höher (48% vs. 36%) und das mediane progressionsfreie Überleben signifikant länger (8,2 vs. 5,9 Monate; HR 0,67; p = 0,002), insbesondere aber konnte der Antikörper auch das Gesamtüberleben signifikant verlängern (von median 13,3 auf 17,0 Monate; HR 0,71; p = 0,004; Abb. 1). Der Unterschied zwischen den beiden Chemotherapie-Regimes war nicht signifikant.
Literatur
1. Krebs in Deutschland 2011/2012. 10. Ausgabe. Robert Koch-Institut (Hrsg) und die Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. (Hrsg). Berlin, 2015.
2. zur Hausen H. Papillomaviruses in the causation of human cancers – a brief historical account. Virology 2009; 384: 260-5.
3. Bouvard V et al. A review of human carcinogens – Part B: Biological agents. Lancet Oncol 2009; 10: 321–2.
4. Bosch FX et al. Epidemiology and natural history of human papillomavirus infections and type-specific implications in cervical neoplasia. Vaccine 2008; 26(Suppl 10): K1-K16.
5. Schiffman M et al. Human papillomavirus testing in the prevention of cervical cancer. J Natl Cancer Inst 2011; 103: 368–83.
6. Appleby P et al. Cervical cancer and hormonal contraceptives: collaborative reanalysis of individual data for 16,573 women with cervical cancer and 35,509 women without cervical cancer from 24 epidemiological studies. Lancet 2007; 370: 1609-21
7. Berrington de Gonzalez A et al. Comparison of risk factors for squamous cell and adenocarcinomas of the cervix: A meta-analysis. Br J Cancer 2004; 90: 1787-91.
8. Robert Koch-Insitut (RKI). Neuerungen in den aktuellen Empfehlungen der Ständigen Impfkommission (STIKO) am RKI vom August 2014. Epidemiol Bull 2014; 35: 343–5.
9. Horn J et al. Estimating the long-term effects of HPV vaccination in Germany. Vaccine 2013; 31: 2372-80.
10. Arbyn M et al. Perinatal mortality and other severe adverse pregnancy outcomes associated with treatment of cervical intraepithelial neoplasia: Meta-analysis. Br Med J 2008; 337: a1284.
11. Jordan J et al. European guidelines for clinical management of abnormal cervical cytology, part 2. Cytopathology 2009; 20: 5-16.
12. Leinonen M et al. Age-specific evaluation of primary human papillomavirus screening vs conventional cytology in a randomized setting. J Natl Cancer Inst 2009; 101: 1612-23.
13. Luyten A et al. Risk-adapted primary HPV cervical cancer screening project in Wolfsburg, Germany – experience over 3 years. J Clin Virol 2009; 46(Suppl 3): S5-S10.
14. Pecorelli S et al. Revised FIGO staging for carcinoma of the cervix. Int J Gynaecol Obstet 2009; 105: 107-8.
15. AWMF. S3-Leitlinie „Diagnostik, Therapie und Nachsorge der Patientin mit Zervixkarzinom“. 2014 (http://www.awmf.org/uploads/tx_szleitlinien/032-033OLl_S3_Zervixkarzinom_2014-10.pdf)
16. Thomeer MG et al. Clinical examination versus magnetic resonance imaging in the pretreatment staging of cervical carcinoma: Systematic review and meta-analysis. Eur Radiol 2013; 23: 2005-18.
17. Epstein E et al. Early-stage cervical cancer: Tumor delineation by magnetic resonance imaging and ultrasound – a European multicenter trial. Gynecol Oncol 2013; 128: 449-53.
18. Gaurilcikas A et al. Early-stage cervical cancer: agreement between ultrasound and histopathological findings with regard to tumor size and extent of local disease. Ultrasound Obstet Gynecol 2011; 38: 707-15.
19. Geetha P, Nair MK. Laparoscopic, robotic and open method of radical hysterectomy for cervical cancer: A systematic review. J Minim Access Surg 2012; 8: 67-73.
20. clinicaltrials.gov/ct2/results.
21. Lande J van de et al. Sentinel lymph node detection in early stage uterine cervix carcinoma: A systematic review. Gynecol Oncol 2007; 106: 604-13.
22. Altgassen C et al. Multicenter validation study of the sentinel lymph node concept in cervical cancer: AGO Study Group. J Clin Oncol 2008; 26: 2943-51.
23. clinicaltrials.gov/ct2/show/NCT01157962.
24. Green J et al. Concomitant chemotherapy and radiation therapy for cancer of the uterine cervix. Cochrane Database Syst Rev 2005; 3: CD002225.
25. Peters WA III et al. Concurrent chemotherapy and pelvic radiation therapy compared with pelvic radiation therapy alone as adjuvant therapy after radical surgery in high-risk early-stage cancer of the cervix. J Clin Oncol 2000; 18: 1606-13.
26. Rotman M et al. A phase III randomized trial of postoperative pelvic irradiation in Stage IB cervical carcinoma with poor prognostic features: follow-up of a gynecologic oncology group study. Int J Radiat Oncol Biol Phys 2006; 65: 169-76.
27. Mota F. Microinvasive squamous carcinoma of the cervix: Treatment modalities. Acta Obstet Gynecol Scand 2003; 82: 505-9.
28. Scatchard K et al. Chemotherapy for metastatic and recurrent cervical cancer. Cochrane Database Syst Rev 2012; 10: CD006469.
29. Long HJ 3rd et al. Randomized phase III trial of cisplatin with or without topotecan in carcinoma of the uterine cervix: A Gynecologic Oncology Group Study. J Clin Oncol 2005; 23: 4626-33.
30. Tewari KS et al. Improved survival with bevacizumab in advanced cervical cancer. N Engl J Med 2014; 370: 734-43.

Prof. Dr. Marion Kiechle
Frauenklinik im Klinikum rechts der Isar der Technischen Universität München (TUM)
Lehrstuhl für Gynäkologie und Geburtshilfe
Ismaninger Straße 22, 81675 München
+49 89 4140 2420
+49 89 4140 4831
Marion.kiechle[at]lrz.tu-muenchen[dot]de

