Patient mit Hodenkarzinom und Zytopenien unklarer Signifikanz
Kasuistik
Fall:
Bei einem 24-jährigen männlichen Patienten afghanischer Abstammung, der seit dem 15. Lebensjahr in Deutschland lebt, wurde Ende 2012 ein Hodentumor rechts diagnostiziert und im Januar 2013 operiert. In der Computertomografie vor der Operation zeigten sich keine Fernmetastasen, die Histologie ergab ein Nichtseminom des UICC-Stadiums pT2, cN0 mit Lymphgefäßinvasion und guter Prognose. Der Patient stellte sich bei uns vor mit der Frage, ob er sich einen Zyklus einer PEB-Chemotherapie (Cisplatin, Etoposid und Bleomycin) geben oder einfach nur beobachten lassen sollte. Im letzteren Fall würde das Rezidivrisiko bei ungefähr 30% liegen. Bei abgeschlossener Familienplanung entschieden wir uns zusammen mit ihm für die Chemotherapie, weil er die Erkrankung „hinter sich lassen“ wollte.
Verlauf:
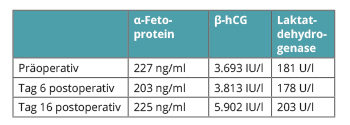
Bei dem ersten Gespräch sechs Tage nach p. o. waren die zehn Tage präoperativ bestimmten und damals erhöhten Tumormarker noch nicht abgefallen (Tab. 1). Am Tag 16 postoperativ zu Beginn der Chemotherapie zeigte die erneute routinemäßige Bestimmung einen überraschenden Anstieg des β-HCG auf fast 6.000 IU/l. Der erste Zyklus PEB wurde trotzdem planmäßig appliziert, aber ein CT in der darauf folgenden Woche veranlasst. Dies ergab eine 1,6 cm große Lymphknotenmetastase knapp unterhalb der Nierenvene, jedoch weiterhin keine Fernmetastasen. Bei einem Stage-Shift nach pT2, cN1, also nach AJCC zum Stadium IIA waren nun insgesamt drei Zyklen PEB adjuvant indiziert.
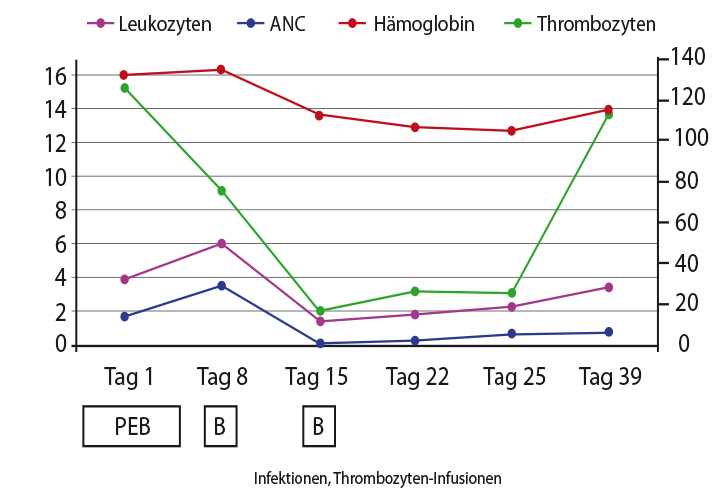
Als Komplikation ergab sich eine unerwartet starke und vor allem prolongierte Hämatotoxizität im ersten Zyklus PEB. Die Leukozyten fielen unter 1.000/µl, die Granulozyten unter 200/µl trotz Gabe von G-CSF, und die Thrombozyten fielen unter 20.000/µl. Ein Harnwegsinfekt und eine ausgedehnte Herpes simplex-Infektion waren die Folge, der Patient benötigte Thrombozyten-Transfusionen. An Tag 22, als der nächste Zyklus PEB fällig gewesen wäre, lagen die Granulozyten weiterhin unter 500/µl, die Thrombozyten bei etwa 30.000/µl, und auch der Hb-Wert war im Sinken begriffen.
Da der Patient nun angab, zwei Jahre zuvor schon einmal wegen niedriger Blutzellwerte bei einem Hämatologen gewesen zu sein, kontrollierten wir noch einmal die Ausgangswerte vor Beginn der Chemotherapie: 3.900 Leukozyten/µl, 1.794 Neutrophilen/µl, ein Hb-Wert von 16,3 g/dl (MCV 96,4 fl) und 126.000 Thrombozyten/µl wären kein unmittelbarer Grund zur Sorge gewesen. In der Knochenmarkbiopsie von vor zwei Jahren zeigte sich bei grenzwertiger Leukopenie (3.500/µl) und deutlicherer Thrombopenie (85.000/µl) ein leicht hypozelluläres Knochenmark – am ehesten mit toxischen Veränderungen zu erklären –, aber kein Hinweis auf eine maligne hämatologische Erkrankung.
Auch in einer Knochenmarkbiopsie an Tag 24 nach Beginn der PEB-Gabe zeigten sich zytologisch ein hypozelluläres Knochenmark, mutmaßlich toxische Veränderungen und Zeichen einer Regeneration nach Chemotherapie, aber auch hier gab es wie in der Durchflusszytometrie keine Hinweise auf eine hämatologische Störung (Dysplasien < 10%). Auch die Knochenmark-Histologie war kompatibel mit einem toxischen Schaden. Bei unauffälliger Zytogenetik war molekulargenetisch eine ASXL1-Mutation in 10% der untersuchten Zellen nachweisbar. Als Diagnose ergab sich nun eine „Clonal Cytopenia of Undetermined Significance“ (CCUS).
An Tag 38 nach Beginn des einzigen Zyklus PEB hatten sich die Tumormarker normalisiert, die Thrombozyten wieder die Werte vor der Chemotherapie erreicht, die Granulozyten stiegen an, waren aber mit 780/µl immer noch erniedrigt. Die Chemotherapie wurde nicht wieder begonnen.
Von Seiten der Urologie wurde zwei Monate nach Beginn der Chemotherapie eine nervenschonende retroperitoneale Lymphadenektomie (RPLA) durchgeführt. In zwei von neun untersuchten Lymphknoten fand sich histologisch ein Teratom, kein Karzinom. Der Patient kommt weiterhin zur Nachsorge und ist noch drei Jahre später in kompletter Remission bezüglich des Hodenkarzinoms.
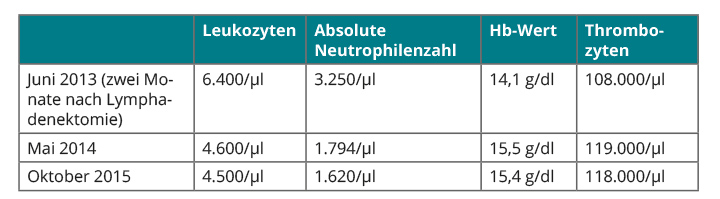
Hinsichtlich der hämatologischen Störung entschieden wir uns dafür, den Patienten regelmäßig halbjährlich klinisch und mittels Blutbild zu untersuchen mit der Option einer Knochenmarkpunktion, sobald die Zytopenie sich verschlechtert. Eine allogene Stammzelltransplantation haben wir angesichts der Unsicherheit hinsichtlich der Bedeutung der Veränderungen zum jetzigen Zeitpunkt nicht in Erwägung gezogen. Der weitere Verlauf der Blutwerte scheint uns bisher recht zu geben (Tab. 2).
Diskussion:
Die hämatologische Abklärung von Zytopenien ergibt oft keine morphologischen oder sonstigen phänotypischen Auffälligkeiten, bei den immer häufiger veranlassten molekulargenetischen Untersuchungen aber somatische Mutationen, die aus dem Kontext von Leukämien oder myelodysplastischen Syndromen (MDS) bekannt sind, bei isoliertem Vorliegen aber keine Anomalien außer der Zytopenie zu verursachen scheinen. Sie sind zweifellos Ursprung einer klonalen Hämatopoese und erhöhen das Risiko für hämatologische Neoplasien. Um Fehldiagnosen zu vermeiden und trotzdem die Bedeutung der Mutation ins Bewusstsein zu heben, wurde die neue Entität der klonalen Hämatopoese von unbestimmtem Potenzial (Clonal Hematopoiesis of Indeterminate Potential, CHIP) geschaffen, wobei die Allelfrequenz der gefundenen Veränderungen bei mindestens 2% liegen muss [1, 2].
CHIP gilt als potenzielle Vorstufe hämatologischer Neoplasien. Die Häufigkeit steigt mit dem Alter, im achten Lebensjahrzehnt soll etwa jeder zehnte eine CHIP aufweisen, das wären in Deutschland ungefähr 2.750 Personen [2]. Am häufigsten sind die Gene DNMT3A, TET2 und ASXL1 betroffen, und die Transformationsrate zu echten Neoplasien ist mit 0,5–1% pro Jahr etwa 13-fach erhöht [3]. Diese Situation scheint bei unserem Patienten vorzuliegen, der schon mit 24 Jahren eine isolierte ASXL1-Mutation aufweist.
Zum Management solcher Patienten gibt es bisher keine belastbaren Daten. Unser Vorgehen deckt sich in etwa mit den Empfehlungen der Gruppe von der Medizinischen Hochschule Hannover, die bei normalen Zellzahlen zu einem regelmäßigen Differenzialblutbild rät, um die Entwicklung einer Zytopenie oder das Auftreten von Blasten im Blut frühzeitig zu erkennen [2]. Bei Zytopenie sollte man das Knochenmark punktieren und die Blutbildkontrolle engmaschiger wiederholen.
Literatur
1. Steensma DP et al. Clonal hematopoiesis of indeterminate potential and its distinction from myelodysplastic syndromes. Blood 2015; 126: 9-16.
2. Steensma DP et al. Cytopenias + mutations – dysplasia = what? Blood 20915; 126: 2349-51.
3. Heuser M et al. Klonale Hämatopoese von unbestimmtem Potenzial. Ein Risikofaktor für hämatologische Neoplasien. Dt Ärztebl 2016; 113: 317-22.
Dr. Burkhard Schmidt
Gemeinschaftspraxis Hämato-Onkologie München-Pasing
Bäckerstraße 4, 81241 München
+49 89 82 99 660 089
+49 89 82 12 771
praxis[at]onkologie-pasing[dot]de
www.onkologie-pasing.de

