Ösophagus- und Magenkarzinom – kurative Konzepte
Maren Knödler, Ines Gockel
Die kurative Therapie lokalisierter Ösophagus- und Magenkarzinome wird weltweit weiterhin kontrovers diskutiert. Die chirurgische Resektion wurde lange Zeit als die einzige kurative Therapiemodalität angesehen. Bei sehr frühen Karzinomen, die nicht die Submukosa infiltrieren, kann die endoskopische Resektion die chirurgische Variante ersetzen. Aufgrund der frühen lymphogenen Metastasierung und späten Manifestation von Symptomen werden diese Tumoren regelhaft erst diagnostiziert, wenn sie mit einer alleinigen Operation nicht mehr kurativ behandelt werden können. Andererseits sind die Karzinome empfindlich gegenüber Chemo- bzw. Strahlentherapie, sodass die multimodale Therapie Standard ist. Die perioperative Platin/5-FU-basierte Chemotherapie hat sich für die Therapie lokal fortgeschrittener Adenokarzinome des Ösophagus und Magens etabliert. Die neoadjuvante Radiochemotherapie mit Carboplatin/Paclitaxel ist der Behandlungsstandard für resektable Plattenepithelkarzinome des Ösophagus (cT3/cT4a) und kann auch für Adenokarzinome des Ösophagus eingesetzt werden. Die Behandlungsalternative für Patienten mit Plattenepithelkarzinomen und erhöhtem Operationsrisiko ist die definitive Radiochemotherapie. Nach dieser kann eine Salvage-Operation in Einzelfällen eine ergänzende Therapieoption sein. Die adjuvante Chemotherapie spielt in Europa eine untergeordnete Rolle und ist keine Standardtherapie. Die multidisziplinäre Therapie und komplexe Chirurgie mit stetiger Weiterentwicklung modernster Operationstechniken erfordert die Behandlung an einem Zentrum mit hoher Expertise.
Schlüsselwörter: Ösophaguskarzinom, Magenkarzinom, kurative Therapie, multimodale Therapie, multidisziplinäre Therapie
Ösophaguskarzinom
Plattenepithel- und Adenokarzinome sind die beiden häufigsten histologischen Tumorentitäten des Ösophagus mit steigender Inzidenz der Adenokarzinome. Seit der 7. Ausgabe der TNM-Klassifikation von 2010 werden die Adenokarzinome des ösophago-gastralen Übergangs zu den Ösophaguskarzinomen gezählt [1]. Häufig und frühzeitig liegt eine Metastasierung in lokoregionäre Lymphknoten vor. Therapeutisch relevant sind insbesondere auch der Bezug des Ösophagus zum Tracheobronchial-System und die Unterscheidung in suprabifurkale oder in Höhe der Bifurkation wachsende Karzinome einerseits und infrabifurkale Karzinome andererseits. Eine weitere wichtige klinische Einteilung bezieht sich auf die Unterscheidung der distalen Adenokarzinome des Ösophagus von den Kardiakarzinomen und subkardialen Magenkarzinomen ([2]; Abb. 1).
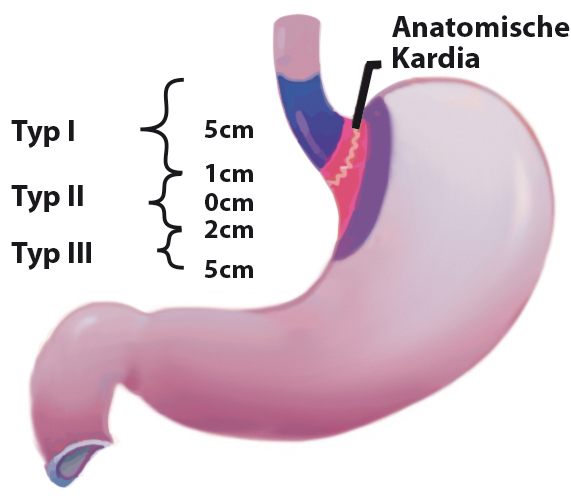
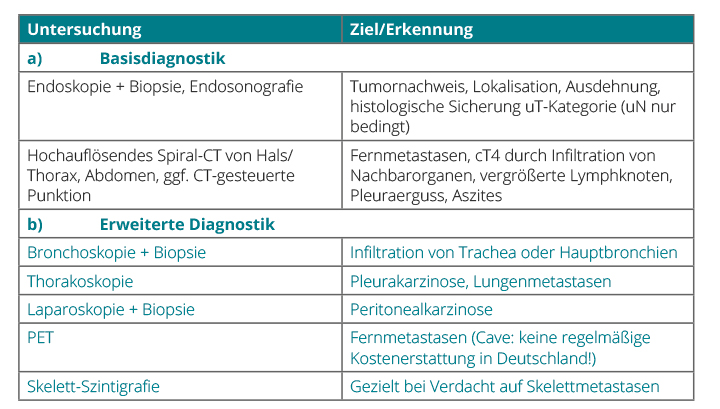
Neben einer Reflux-Anamnese sind kardiovaskuläre Erkrankungen und Adipositas charakteristisch für Patienten mit Adenokarzinomen, während Patienten mit Plattenepithelkarzinom bei chronischem Nikotinabusus häufiger pulmonale Funktionsstörungen und durch Alkoholkonsum bedingte Lebererkrankungen aufweisen. Eine effektive und zielgerichtete Diagnostik mit Tumorsicherung und Staging sowie die präoperative Risikoanalyse sind für die Bestimmung der optimalen Therapie entscheidend (Tab. 1). Primäres Ziel der Behandlung des Ösophaguskarzinoms ist die vollständige Tumorentfernung mit möglichst geringem Risiko und die Verhinderung von Tumorrezidiven.
Therapie
Der Therapiealgorithmus und die Indikationsstellung bei funktionell operablen und onkologisch resektablen Ösophaguskarzinomen richten sich entsprechend der Histologie nach der präoperativen cTNM-Klassifikation und dem Risikoprofil des Patienten [3]. Mukosakarzinome umschriebenen Ausmaßes von < 2 cm ohne Nachweis einer Multifokalität können prinzipiell endoskopisch reseziert werden [4]. Bei größerer Eindringtiefe (T1b- oder T2-Karzinom) ist bei funktionell operablen Patienten die Ösophagektomie Standard. Bei funktionell und anatomisch operablen Patienten mit cT3- und cT4-Tumoren wird zur Verbesserung der Ausgangssituation für eine R0-Resektion eine präoperative Chemotherapie (CT) oder Radiochemotherapie (RCT) durchgeführt [3]. Nach der präoperativen Therapie und vor der radikalen Operation erfolgt ein Restaging, bei dem die zwischenzeitliche Entwicklung von Fernmetastasen ausgeschlossen werden soll.
Chirurgische Therapie
Ziel der chirurgischen Therapie des Plattenepithel- und Adenokarzinoms des Ösophagus ist die En-bloc-Resektion mit lokoregionären Lymphknoten unter Erreichung tumorfreier Resektionsränder oral, aboral und zirkumferenziell [5]. Lokalisation des Tumors und histopathologische Entität bestimmen das operativ-technische Vorgehen bzw. das Ausmaß des Eingriffs. Das Ausmaß der Lymphadenektomie richtet sich nach der Lokalisation des Primärtumors, wobei drei Felder (abdominal, thorakal und zervikal) unterschieden werden. Die Zweifeld-Lymphadenektomie (abdomino-thorakal) stellt den Standard dar [5].
1. Zervikaler Ösophagus (Plattenepithelkarzinome)
Gemäß der Empfehlungen der aktuellen S3-Leitlinie soll hier die Indikation zum chirurgischen Vorgehen im Gegensatz zur definitiven Radiochemotherapie unter eingehender Nutzen-/Risikoabwägung diskutiert werden. Als chirurgisches Verfahren kann entweder eine totale Ösophagektomie mit Magenhochzug oder in geeigneten Fällen eine zervikale Ösophagusteilresektion mit Rekonstruktion durch ein freies Jejunum-Interponat und Gefäßanschluss an die zervikalen Gefäße über einen zervikalen Zugang mit oberer Sternotomie erfolgen [3].
2. Proximales/mittleres Ösophagus-Drittel (Plattenepithelkarzinome)
Standard ist die abdomino-thorakale En-bloc-Ösophagusresektion (Ivor-
Lewis) mit systematischer Zweifeld-Lymphknotendissektion [5]. Bei Tumoren im proximalen Ösophagus-Drittel kann zur Erreichung einer R0-Resektion bzw. zur Wahrung eines entsprechenden Sicherheitsabstandes die Resektion nach kranial ausgedehnt werden mit zervikaler Anastomosierung (McKeown; [6]).
3. Distales Ösophagus-Drittel (Adeno-/Barrett-Karzinome = AEG [Adenocarcinoma of the Esophago-Gastric junction] Typ I nach Siewert; [2])
Standard beim AEG Typ I bzw. klassischen Barrett-Karzinom ist die abdomino-thorakale subtotale Ösophagektomie en bloc mit systematischer Zweifeld-Lymphadenektomie [3].
4. AEG Typ II nach Siewert [2]
Auf die Kardia-Karzinome oder AEG Typ II-Tumoren nach Siewert wird im Abschnitt „Magenkarzinom – chirurgische Therapie“ näher eingegangen. Zu erwähnen ist an dieser Stelle, dass gemäß aktueller S3-Leitlinie beim AEG Typ II mit ausgedehnter Infiltration der unteren Speiseröhre die abdomino-thorakale subtotale Ösophagektomie durchgeführt werden kann (analog 3.), alternativ eine trans-hiatale abdomino-zervikale subtotale Ösophagektomie nach Orringer [7]. Letztere hat den Nachteil der limitierten thorakalen/mediastinalen Lymphadenektomie, welche lediglich im hinteren unteren Mediastinum bis zur Karina praktikabel ist. Ein zusätzlicher ausgedehnter Magenbefall kann eine Ösophago-Gastrektomie erforderlich machen [3].
Die Rekonstruktion erfolgt normalerweise mittels hochgezogenem Schlauchmagen. Sollte dieser wegen Tumorbefalls oder Voroperation nicht zur Verfügung stehen, kommt alternativ ein Kolon-Interponat zum Einsatz. Der Rekonstruktionsweg kann im alten Bett der Speiseröhre oder retrosternal gewählt werden.
In der letzten Zeit kommen minimal-invasive Techniken der onkologischen Ösophagektomie und entsprechender Rekonstruktion zunehmend zur Anwendung. Eine prospektiv randomisierte Studie konnte eine signifikant niedrigere pulmonale und somit Gesamtmorbidität nach minimal-invasiver Ösophagektomie im Vergleich zum offenen Vorgehen belegen [8]. Eine Metaanalyse von Dantoc et al. wies nach, dass die Anzahl entfernter Lymphknoten – als wichtiger Qualitätsparameter in der onkologischen Chirurgie – in der minimal-invasiv operierten Gruppe signifikant höher war als beim offenen Vorgehen [9]. Vorteil ist möglicherweise – neben dem geringeren pulmonalen Trauma – die verbesserte Visualisierung mediastinaler/thorakaler Lymphknoten. So kam es in einer Untersuchung von Shen et al. im Rahmen der minimal-invasiven Lymphadenektomie zu einem TNM-Upstaging bei 6,6% der Patienten im Vergleich zur offenen (historischen) Kontrollgruppe [10]. Dabei war die Komplikationsrate in beiden Gruppen nicht signifikant unterschiedlich [10].
Die Anastomosierung beim minimal-invasiven Vorgehen kann mittels transoraler Stapler-Systeme erfolgen, und die Insuffizienzraten unterscheiden sich nicht von denen bei offener Technik [11]. Die ROBOT-Studie vergleicht derzeit in randomisiert-kontrollierter, monozentrischer Weise bei 112 Patienten die Robotik-assistierte thorako-laparoskopische mit der offenen transthorakalen Ösophagektomie mit dem Zielparameter der Gesamtkomplikationsrate bei einer Nachbeobachtungszeit von fünf Jahren [12].
Zusammenfassend sind minimal-invasive und Robotik-assistierte Ösophagus-Resektionen sicher, zeigen zahlreiche Vorteile in der postoperativen Rekonvaleszenz und führen zur Reduktion der Morbidität [13]. Die Langzeitresultate scheinen vergleichbar zum offenen Vorgehen [13].
Die Ösophagus-Resektion als hoch-komplexer Zweihöhlen-Eingriff sollte in einem High-Volume-Zentrum mit großer chirurgischer und intensivmedizinischer sowie endoskopisch-interventioneller Expertise durchgeführt werden, da dem interdisziplinären Komplikationsmanagement in der postoperativen Phase eine große Bedeutung zukommt [14]. Entscheidend für ein gutes postoperatives Ergebnis ist – neben der prätherapeutischen Selektion der Patienten mit Risikoanalyse – eine Konditionierung vor der Operation zur Minimierung von Risikofaktoren bzw. zur Reduktion potenzieller postoperativer Komplikationen, die gut im Rahmen des Zeitintervalls während der neoadjuvanten Therapie durchgeführt werden kann.
Präoperative Chemotherapie
Die Wirksamkeit einer präoperativen CT bei lokal fortgeschrittenen Plattenepithel- und Adenokarzinomen wurde in mehreren Studien untersucht [15, 16]. Für die präoperative Therapie der Adenokarzinome des Ösophagus und des ösophago-gastralen Übergangs siehe Abschnitt „Magenkarzinom – Perioperative Therapie“.
Die Metaanalyse von Sjoquist ergab keinen signifikanten Unterschied für Patienten mit Plattenepithelkarzinomen, die mit einer präoperativen CT behandelt wurden (Hazard Ratio 0,92; p = 0,18; [17]).
Weiterhin unklar bleibt der Stellenwert einer postoperativen Fortsetzung der CT. Leitlinien empfehlen derzeit eine Fortsetzung nach R0-Resektion, wenn die Toxizität in der präoperativen Phase vertretbar war [3]. Zusammenfassend besteht für lokal fortgeschrittene Adenokarzinome des Ösophagus die Indikation zur perioperativen CT, jedoch nicht für Plattenepithelkarzinome. Die Grundlage für die perioperative Chemotherapie bilden Cisplatin und 5-FU.
Präoperative Radiochemotherapie
Trotz präoperativer CT und Operation treten etwa 25% aller Rückfälle lokoregionär auf [18]. Klinische Studien und Metaanalysen belegen eine signifikante Verbesserung der Überlebensraten und der lokalen Kontrolle nach präoperativer RCT. Die zuvor erwähnte Metaanalyse von Sjoquist zeigte für Patienten mit Plattenepithelkarzinomen eine signifikante relative Risikoreduktion hinsichtlich des Gesamtüberlebens um 22%
(HR 0,78; 95%-Konfidenzintervall 0,70–0,88; p = 0,002) und einen absoluten Unterschied in der 2-Jahres-Überlebensrate von 8,7% [17].
Die größte prospektiv randomisierte kontrollierte Studie zur präoperativen RCT des Ösophaguskarzinoms (CROSS-Studie, Chemoradiotherapy for Oesophageal Cancer Followed by Surgery Study) verglich die präoperative RCT, gefolgt von der Resektion, mit der Chirurgie alleine [19]. Die präoperative RCT bestand aus wöchentlichem Carboplatin (AUC 2) und Paclitaxel (50mg/m2) plus simultaner Radiotherapie bis zu einer Gesamtdosis von 41,1 Gy. Das CROSS-Regime erbrachte einen signifikanten Überlebensvorteil für die präoperative RCT (Adeno- und Plattenepithelkarzinome), insbesondere für die Plattenepithelkarzinome, wenn auch diese Gruppe klein war. Die postoperative Letalität war trotz der Therapieintensivierung nicht erhöht.
Damit definiert die CROSS-Studie eine neue Behandlungsempfehlung für Plattenepithelkarzinome des Ösophagus. Für Adenokarzinome liegt der Benefit allerdings im gleichen Bereich, wie er auch durch die alleinige präoperative CT erreicht wird. Ein eindeutiger Vorteil für eine präoperative RCT vs. CT kann für Adenokarzinome nicht abgeleitet werden. Auch die randomisierte POET-Studie zeigte zwar einen Trend zugunsten einer präoperativen RCT vs. einer CT, aber keinen signifikanten Vorteil [20]. Entscheidend ist, dass die Indikation zur präoperativen RCT kritisch und nicht zu großzügig gestellt wird.
Zusammenfassend bleibt hinsichtlich der präoperativen Therapie festzustellen, dass die präoperative RCT die Langzeitprognose signifikant verbessert und deshalb beim thorakalen Ösophaguskarzinom (Adeno- und Plattenepithelkarzinom) als internationaler Therapiestandard gilt. Für Adenokarzinome des ösophago-gastralen Übergangs ist die präoperative CT derzeit als gleichwertige Option anzusehen.
Definitive Radiochemotherapie von Plattenepithelkarzinomen
In randomisierten Studien zeigten die definitive RCT und präoperative RCT, gefolgt von Ösophagektomie, vergleichbare Effektivität hinsichtlich des Überlebens bei Patienten mit Plattenepithelkarzinomen des Ösophagus [20, 21]. Die Behandlungsverfahren gelten deshalb als gleichwertig effektiv und sollten beide angeboten werden. Für eine definitive RCT spricht die fehlende Morbidität und Letalität durch diese Behandlung. Für eine trimodale Therapie einschließlich Ösophagektomie spricht eine bessere lokale Tumorkontrolle. Je höher die medizinischen Risiken des Patienten und das operative Risiko, desto eher wird man dem Patienten zur definitiven RCT raten. Im Falle einer definitiven RCT gilt weiterhin die Kombination aus Radiotherapie (mindestens 50 Gy) plus Cisplatin und 5-FU als Standard [22].
Ziel von zwei aktuell publizierten Studien war es, Verbesserungen durch die begleitende Chemotherapie zu erreichen: Eine randomisierte Studie aus Frankreich untersuchte an Patienten, die für eine Operation ungeeignet waren, die kombinierte Radiotherapie mit FOLFOX versus Cisplatin/5-FU. Hinsichtlich des progressionsfreien Überlebens ergab sich kein statistisch relevanter Unterschied in den Behandlungsgruppen (9,7 vs. 9,4 Monate). Insgesamt zeigte sich in der FOLFOX-Gruppe aber ein günstigeres Nebenwirkungsprofil [23]. In einer nicht randomisierten Beobachtungsstudie verglichen holländische Zentren im Rahmen einer definitiven RCT Cisplatin/5-FU mit wöchentlichem Carboplatin/Paclitaxel. Auch in dieser Arbeit zeigte sich ein vergleichbares onkologisches Ergebnis für beide Therapiegruppen mit einem günstigeren Nebenwirkungsprofil für Carboplatin/Paclitaxel. Im klinischen Alltag finden diese alternativen Behandlungsregimes bereits Verwendung.
Magenkarzinom
Das Magenkarzinom gehört weltweit zu den häufigsten Tumorerkrankungen. Das mittlere Erkrankungsalter liegt bei 62 Jahren, aber auch bei jungen Menschen werden zunehmend Karzinome erstmals diagnostiziert. Aufgrund fehlender Frühsymptome werden Magenkarzinome meist in fortgeschrittenen Stadien diagnostiziert. Bei Nachweis einer lymphogenen oder hämatogenen Fernmetastasierung sowie einer Peritonealkarzinose verläuft die Erkrankung fast immer tödlich. Trotz kurativer Resektion ist die 5-Jahres-Überlebenswahrscheinlichkeit bei fortgeschrittenen Magenkarzinomen mit < 50% kritisch. Hieraus resultiert die Notwendigkeit optimaler multidisziplinärer Therapien. Die individuelle stadienabhängige Therapie ergibt sich in Abhängigkeit von den differenzierten Staging-Untersuchungen. Im Folgenden werden die aktuellen Therapiealgorithmen zur kurativen Therapie des Magenkarzinoms unter Berücksichtigung der wissenschaftlichen Evidenz dargestellt (Tab. 2; [24]).
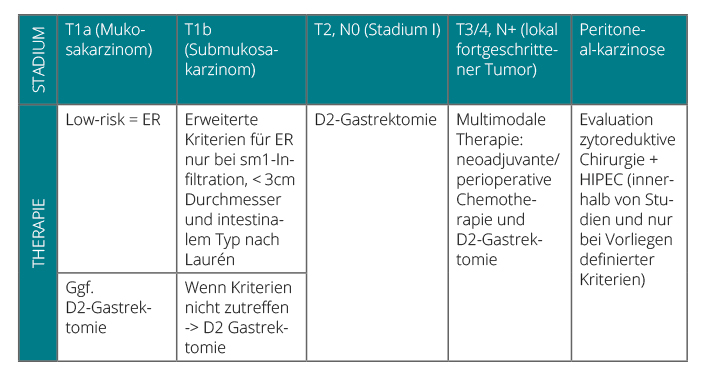
Kurative Therapie früher Tumorstadien
Mukosa-Karzinome (pT1a) können mit einer endoskopischen Resektion kurativ und mit gutem Langzeitergebnis behandelt werden, da die Wahrscheinlichkeit einer lymphogenen Metastasierung in diesem Stadium mit < 5% gering ist. Gemäß der deutschen Leitlinie „Magenkarzinom“ können Mukosa-Karzinome endoskopisch reseziert werden, sofern folgende Kriterien erfüllt sind [25]:
• Läsionen von < 2 cm Größe in erhabenen Typen
• Läsionen von < 1 cm Größe in flachen Typen
• Histologischer Differenzierungsgrad: gut oder mäßig (G1/G2)
• Keine makroskopische Ulzeration
• Invasion begrenzt auf die Mukosa
• Keine restliche invasive Erkrankung nach endoskopischer Resektion.
Die endoskopische Resektion erfolgt als En-bloc-Resektion, um die vollständige histologische Beurteilung der basalen und lateralen Ränder zu erlauben. Untersuchungen chirurgischer Resektate konnten belegen, dass die Lymphknoten-Metastasierung bereits bei Infiltration der tiefen mukosalen Schicht (m3) beginnt und hier in 13% der Fälle vorliegt, sodass die onkologische Radikalität einer endoskopischen Resektion bei dieser Patientengruppe fraglich erscheint [26]. Bei einer größeren Eindringtiefe mit Infiltration der Submukosa (≥ pT1b) ist eine chirurgische Resektion mit systematischer Lymphadenektomie die Standardtherapie.
Chirurgische Therapie
Die kurative chirurgische Therapie des Magenkarzinoms besteht in der En-bloc-Resektion mit großem und kleinem Netz sowie systematischer D2-Lymphaden-
ektomie. Das Ausmaß der Magenresektion orientiert sich dabei an der Lokalisation des Tumors: Beim Kardia-Karzinom (einem AEG Typ II nach Siewert entsprechend) sowie beim subkardial lokalisierten Karzinom (AEG Typ III; [2]) ist die transhiatal erweiterte Gastrektomie mit distaler Ösophagus-Teilresektion und D2-Lymphadenektomie indiziert. Die abdominelle, totale D2-Gastrektomie wird bei allen übrigen Lokalisationen durchgeführt. Ausnahme bilden die distalen Antrumkarzinome, bei denen eine onkologische subtotale Magenresektion (4/5-Resektion) durchgeführt werden kann. Zur Erreichung tumorfreier Resektionsränder (R0-Resektion) ist ein proximaler Sicherheitsabstand von 5 cm (intestinaler Typ nach Laurén) bzw. von 8 cm (diffuser Typ) in situ erforderlich [25]. Vorteil der subtotalen 4/5-Magenresektion – wenn onkologisch vertretbar – im Vergleich zur totalen Gastrektomie ist nicht nur die geringere perioperative Morbidität, sondern auch die verbesserte Lebensqualität postoperativ aufgrund des proximalen Magenrests als Reservoir für die Nahrungsaufnahme [27]. Gemäß der deutschen S3-Leitlinie zum Magenkarzinom sollte die D2-Lymphadenektomie die Resektion und histopathologische Untersuchung von mindestens 25 lokoregionären Lymphknoten beinhalten [25]. Für die exakte Beurteilung der N-Kategorie ist die Resektion und Untersuchung von mindestens 16 regionären Lymphknoten erforderlich [25].
Das in Deutschland am häufigsten angewandte Rekonstruktionsverfahren ist das nach Roux-Y (ohne Erhalt der Duodenal-Passage). Seltener ist die Wiederherstellung der Nahrungspassage mit Erhalt der Duodenal-Passage (z. B. mit iso-peristaltischem Jejunum-Interponat nach Longmire-Gütgemann), die insbesondere dann einen Vorteil bieten, wenn das Duodenum bzw. die Papille auch postoperativ weiter endoskopisch gut zugänglich sein muss (z. B. für endoskopische Verlaufskontrollen bei hereditären Polyposis-Erkrankungen mit Duodenal- und Papillen-Neoplasien). Es stellt sich die Frage, ob die Rekonstruktion mit Pouch postoperativ einen funktionellen Vorteil erbringt. Hier konnte eine Metaanalyse von Gertler et al. belegen, dass die Pouch-Anlage weder mit einer signifikant erhöhten Morbidität und Letalität noch mit längeren OP-Zeiten bzw. Klinikaufenthalten einhergeht [28]. Als relevante Vorteile fanden sich signifikant weniger Sodbrennen und Dumping sowie eine bessere Nahrungszufuhr und Lebensqualität [28].
In der letzten Zeit spielen minimal-invasive Resektionen und Robotik-Verfahren mit dem DaVinci®-System eine zunehmende Rolle in der Chirurgie des Magenkarzinoms. Eine Metaanalyse von Zou et al. erbrachte keine Unterschiede beim Gesamt- und krankheitsfreien 5-Jahres-Überleben nach laparoskopischer vs. offener D2-Gastrektomie beim lokal fortgeschrittenen Magenkarzinom [29]. Hingegen konnten Lin et al. in einer Fall-Kontroll-Studie bei 2.041 konsekutiven laparoskopischen Gastrektomien einen signifikanten Überlebensvorteil zugunsten des minimal-invasiven Verfahrens nach drei Jahren feststellen, wobei sich in letzterer Gruppe Patienten mit initial günstigeren Tumorstadien fanden [30]. Morbidität und Letalität waren in beiden Gruppen vergleichbar.
Da die Langzeitresultate der minimal-invasiven Gastrektomie im Vergleich zum konventionellen, offenen Vorgehen letztlich unklar sind, rekrutieren in Asien derzeit drei große multizentrische, prospektiv-randomisierte, kontrollierte Studien zur laparoskopischen Gastrektomie beim fortgeschrittenen Magenkarzinom, die insgesamt > 2.600 Patienten einschließen sollen: die Korean Laparoscopic Gastrointestinal Surgery Study (KLASS 02; Phase-III-Studie), die Japanese Laparoscopic Gastric Surgery Study (JLSSG 0901; Phase-II/III-Studie) und die Chinese Laparoscopic Gastrointestinal Surgery Study (CLASS 01; Phase-III-Studie).
Die Robotic D2-Gastrektomie mit dem DaVinci®-System bietet den Vorteil einer potenziell besseren Visualisierung und präziseren Dissektion von Lymphknoten. Die Effizienz der drei unterschiedlichen Zugangswege (Robotik vs. minimal-invasiv vs. konventionell-offen) wurde in einer Metaanalyse von Zong et al. untersucht (12 Studien mit 8.493 Patienten; [31]). Hier war der Blutverlust beim Robotik- und laparoskopischen Verfahren signifikant geringer als beim offenen, die OP-Dauer mit dem DaVinci®-System am längsten. Sowohl die Anzahl der entfernten Lymphknoten als auch die postoperative Morbidität und Letalität unterschieden sich bei allen drei Methoden nicht signifikant voneinander [31].
Perioperative Chemotherapie
Bei lokal fortgeschrittenen Magenkarzinomen (uT3 und uT4a [resektabel]) wie auch bei Karzinomen des ösophago-gastralen Übergangs ist die perioperative Chemotherapie der empfohlene Standard. Diese wird präoperativ begonnen und postoperativ fortgeführt. Grundlegend für diese Empfehlung sind Ergebnissen randomisierter, kontrollierter Studien zur perioperativen Therapie (Tab. 3; [32–35]): Die britische MAGIC-Studie verglich eine perioperative Chemotherapie (sechs Zyklen) mit dem ECF-Regime (Epirubicin, Cisplatin und 5-Fluorouracil [FU]) mit der alleinigen chirurgischen Therapie. In der Endauswertung zeigte sich ein signifikanter 5-Jahres-Überlebensvorteil von 13% absolut für die Gruppe mit perioperativer Chemotherapie im Vergleich zur alleinigen Operation (23% vs. 36%; [32]). Postoperative Komplikationen (46%) und Sterblichkeit (6%) waren in beiden Gruppen gleich. Die Ergebnisse von MAGIC wurden durch die französische ACCORD-07-FFCD-9703-Studie mit einem 5-Jahres-Überlebensvorteil von 14% bestätigt [33]. Die Ergebnisse einer vorzeitig beendeten EORTC-Studie belegen zudem eine Verbesserung der R0-Resektionsrate nach neoadjuvanter Chemotherapie und ein längeres rezidivfreies Überleben bei tendenziell besserem Gesamtüberleben (HR 0,84; p nicht signifikant; [34]). Infusionales 5-FU und das orale Fluoropyrimidin Capecitabin (z. B. das XP-Regime mit Cisplatin/Capecitabin oder ECX) scheinen in der neoadjuvanten Chemotherapie austauschbar zu sein.
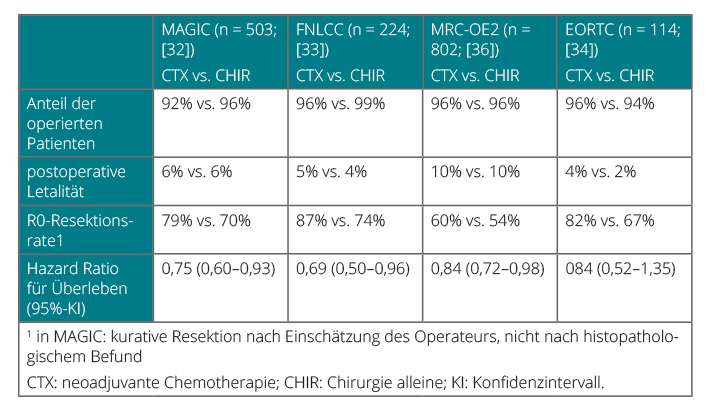
Die aktuellen Ergebnisse der MRC OE05-Studie belegen zudem die gleichwertige Effektivität der Zweifachkombination (Cisplatin, 5-FU) im Vergleich mit ECX (Epirubicin, Cisplatin, Capecitabin) ohne Auswirkung auf das Gesamtüberleben [36]. Noch kein Standard, aber sehr vielversprechend sind die ersten Zwischenergebnisse der AIO-FLOT4-Studie. Dieses untersucht das neoadjuvante Konzept mit dem FLOT-Regime (5-FU, Oxaliplatin und Docetaxel). Die aktuellen Daten sprechen für eine gute Durchführbarkeit und Anti-Tumor-Aktivität. Aktuell erfolgt die weitere Validierung, und es gilt die Überlebensdaten abzuwarten. Der Stellenwert von Trastuzumab und Pertuzumab für die neoadjuvante Therapie HER2/neu-überexprimierender Magenkarzinome wird aktuell in der EORTC-Innovation-Studie geprüft.
Adjuvante Chemotherapie
Durch die Etablierung der perioperativen Therapie als Standardtherapie hat die adjuvante Chemotherapie in Europa kaum Bedeutung. Dennoch konnte in der CLASSIC-Studie bei Patienten mit fortgeschrittenen Magenkarzinom (UICC-Stadien II/IIIA/IIIB) und Z. n. Gastrektomie durch die adjuvante Kombinationschemotherapie mit Capecitabin und Oxaliplatin ein signifikant besseres progressionsfreies Überleben nach drei Jahren (74% vs. 59%) gezeigt werden [37]. Metaanalysen bestätigen, dass sich durch die adjuvante Chemotherapie ein grenzwertig signifikanter Überlebensvorteil durch die adjuvante Therapie ergibt. Besonders Patienten mit positivem Nodalstatus profitierten in diesen Untersuchungen stärker von einer adjuvanten Therapie [38, 39]. Die adjuvante Chemotherapie ist gemäß der S3-Leitlinie kein Standard, kann aber im Einzelfall mit entsprechender Risikokonstellation indiziert sein – z. B. bei einem initial als uT2 eingeschätzten Tumor mit späterem Nachweis positiver Lymphknoten oder bei initial aktiver Blutung und primärer Gastrektomie.
Adjuvante Radiochemotherapie
In der randomisierten nordamerikanischen Intergroup-Studie 0116 zeigte sich ein signifikant besseres Gesamtüberleben für Patienten, die eine adjuvante RCT erhielten, im Vergleich zur alleinigen Operation [40]. Kritisch anzumerken ist einerseits die eingeschränkte onkologische Qualität der Operationen (54% der Patienten erhielten weniger als eine D1-Lymphadenektomie) und andererseits die eingeschränkte Durchführbarkeit mit schweren hämatologischen Toxizitäten und schwerer gastrointestinaler Toxizität bei > 50% bzw. jedem dritten Patienten. Die aktuell publizierte ARTIST-Studie aus Korea zeigt ein insgesamt negatives Endergebnis für die adjuvante RCT nach D2-Lymphadenektomie [41]. Ein positiver Effekt für die adjuvante RCT zeigt sich allerdings in der Subgruppenanalyse für Patienten mit positivem Nodalstatus und intestinalem Subtyp. Die CRITICS-Studie überprüft derzeit den Stellenwert der adjuvanten RCT bei adäquat resezierten Patienten [42]. In den deutschen Leitlinien wird die postoperative Chemotherapie lediglich im Falle einer inkompletten Resektion (R1 oder R2) als Option angesehen [25]. Den Stellenwert der Radiochemotherapie in der neoadjuvanten Therapie prüft aktuell die randomisierte EORTC-TOPGEAR-Studie.
Interessenskonflikte: M. Knödler gibt an, dass keine Interessenskonflikte bestehen.
Literatur
1. Sobin LH et al. TNM-Klassifikation maligner Tumoren, 7. Aufl., Weinheim 2010.
2. Siewert JR, Stein HJ. Classification of adenocarcinoma of the oesophagogastric junction. Br J Surg 1998; 85: 1457-9.
3. Porschen R et al. S3-Leitlinie „Diagnostik und Therapie der Plattenepithelkarzinome und Adenokarzinome des Ösophagus“. Z Gastroenterol 2015; 53: 1288-347.
4. Pech O et al. Long-term efficacy and safety of endoscopic resection for patients with mucosal adenocarcinoma of the esophagus. Gastroenterology 2014; 146: 652-60.
5. Lewis I. The surgical treatment of carcinoma of the esophagus with special reference to a new operation for growths of the middle third. Br J Surg 1946; 134: 18-31.
6. McKeown KC. Total three-stage oesophagectomy for cancer of the oesophagus. Br J Surg 1976; 63: 259-62.
7. Orringer MB et al. Two thousand transhiatal esophagectomies: Changing trends, lessons learned. Ann Surg 2007; 246: 363-72; discussion: 372-4.
8. Biere SS et al. Minimally invasive versus open oesophagectomy for patients with oesophageal cancer: A multicentre, open-labeled, randomised controlled trial. Lancet 2012; 379: 1887-92.
9. Dantoc M et al. Evidence to support the use of minimally invasive esophagectomy for esophageal cancer. Arch Surg 2012; 147: 768-76.
10. Shen Y et al. Extensive mediastinal lymphadenectomy during minimally invasive esophagectomy: Optimal results from a single center. J Gastrointest Surg 2012; 16: 715-21.
11. Gockel I et al. Minimally invasive abdominothoracic esophagus resection by transoral esophagogastrostomy. Interdisciplinary challenge. Anaesthesist 2013; 62: 836-44.
12. van der Sluis PC et al. Robot-assisted minimally invasive thoraco-laparoscopic esophagectomy versus open transthoracic esophagectomy for resectable esophageal cancer, a randomized controlled trial (ROBOT trial). Trials 2012; 13: 230.
13. Wullstein C. Scope and limitations of minimally invasive resections of the esophagus and stomach. Zentralbl Chir 2014; 139: 37-42.
14. Gockel I et al. Neoadjuvant therapy for tumors of the upper gastrointestinal tract: Complication management. Chirurg 2015; 86: 1014-22.
15. Kelsen DP et al. Chemotherapy followed by surgery compared with surgery alone for localized esophageal cancer. N Engl J Med 1998; 339: 1979-84.
16. Medical Research Council Oesophageal Cancer Working Group. Surgical resection with or without preoperative chemotherapy in oesophageal cancer: A randomized controlled trial. Lancet 2002; 359: 1727-33.
17. Sjoquist KM et al. Survival after neoadjuvant chemotherapy or chemoradiotherapy for resectable oesophageal carcinoma: An updated meta-analysis. Lancet Oncol 2011; 12: 681-92.
18. Hiripi E et al. Survival of stomach and esophagus cancer patients in Germany in the early 21st century. Acta Oncol 2012; 51: 906-14.
19. van Hagen P et al. Preoperative chemoradiotherapy for esophageal or junctional cancer. N Engl J Med 2009; 366: 2074-84.
20. Stahl M et al. Phase III comparison of preoperative chemotherapy compared with chemoradiotherapy in patients with locally advanced adenocarcinoma of the esophagogastric junction. J Clin Oncol 2009; 27: 851-6.
21. Bedenne L et al. Chemoradiation followed by surgery compared with chemoradiation alone in squamous cancer of the esophagus: FFCD 9102. J Clin Oncol 2007; 25: 1160-8.
22. Herskovic A et al. Combined chemotherapy and radiotherapy compared with radiotherapy alone in patients with cancer of the esophagus. N Engl J Med 1992; 326: 1593-8.
23. Conroy T et al. Definitive chemoradiotherapy with FOLFOX versus fluorouracil and cisplatin in patients with oesophageal cancer (PRODIGE5/ACCORD17): Final results of a randomised, phase 2/3 trial. Lancet Oncol 2014; 5: 305-14.
24. Gockel I, Mehdorn M. Moderne Chirurgie des Magenkarzinoms – Innovationen für mehr Effektivität und Sicherheit. MMW Fortschr Med 2016 (in press).
25. Moehler M et al. German S3-Guideline „Diagnosis and Treatment of Esophagogastric Cancer“. Z Gastroenterol 2011; 49:461-531.
26. Hölscher AH et al. Early gastric cancer: Lymph node metastasis starts with deep mucosal infiltration. Ann Surg 2009; 250: 791-7.
27. Gockel I et al. Subtotal or total gastrectomy for gastric cancer: impact of the surgical procedure on morbidity and prognosis – analysis of a 10-year-experience. Langenbecks Arch Surg 2005; 390: 148-55.
28. Gertler R et al. Pouch vs. no pouch following total gastrectomy: Metaanalysis and systematic review. Am J Gastroenterol 2009; 104: 2838-51.
29. Zou ZH et al. Laparoscopic vs open D2 gastrectomy for locally advanced gastric cancer: A meta-analysis. World J Gastroenterol 2014; 20: 16750-64.
30. Lin JX et al. Surgical outcomes of 2041 consecutive laparoscopic gastrectomy procedures for gastric cancer: A large-scale case control study. PLoS One 2015; 10: e0114948.
31. Zong L et al. Efficacy evaluation of subtotal and total gastrectomies in robotic surgery for gastric cancer compared with that in open and laparoscopic resections: A meta-analysis. PLoS One 2014; 9: e103312.
32. Cunningham D et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2011; 355: 11–20.
33. Ychou M et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 2011; 29: 1715–21.
34. Schuhmacher C et al. Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of the stomach and cardia: European Organisation for Research and Treatment of Cancer randomized trial 40954. J Clin Oncol 2010; 28: 5210-8.
35. Allum WH et al (2009) Long term results of a randomized trial of surgery with or without preoperative chemotherapy in esophageal cancer. J Clin Oncol 27:5062–5066
36. Alderson et al. Neoadjuvant chemotherapy for resectable oesophageal and junctional adenocarcinoma: Results from the UK Medical Research Council randomised OEO5 trial (ISRCTN 01852072). J Clin Oncol 2015; 33 (15S): 209s (ASCO 2015, Abstract #4002).
37. Bang YJ et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): A phase 3 open-label, randomised controlled trial. Lancet 2012; 379: 315-21.
38. GASTRIC (Global Advanced/Adjuvant Stomach Tumor Research International Collaboration) Group, Paoletti X et al. Benefit of adjuvant chemotherapy for resectable gastric cancer: A meta-analysis. J Am Med Ass 2010; 303: 1729-37.
39. Noh SH et al. Adjuvant capecitabine plus oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): 5-year follow-up of an open-label, randomised phase 3 trial. Lancet Oncol 2014; 15: 1389-96.
40. Macdonald JS et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001; 345: 725-30.
41. Park SH et al. Phase III trial to compare adjuvant chemotherapy with capecitabine and cisplatin versus concurrent chemoradiotherapy in gastric cancer: Final report of the adjuvant chemoradiotherapy in stomach tumors trial, including survival and subset analyses. J Clin Oncol 2015; 33: 3130-6.
42. Dikken JL et al. Neo-adjuvant chemotherapy followed by surgery and chemotherapy or by surgery and chemoradiotherapy for patients with resectable gastric cancer (CRITICS). BMC Cancer 2011; 11: 329.

Korrespondierende Autorin
Dr. med. Maren Knödler
Universitäres Krebszentrum Leipzig (UCCL), Universitätsklinikum Leipzig
Liebigstr. 20, 04301 Leipzig
+49 341/9712560
+49 341/9712569
maren.knoedler[at]medizin.uni-leipzig[dot]de
Prof. Dr. med. Ines Gockel
Klinik für Viszeral-, Transplantations-, Thorax- und Gefäßchirurgie
Universitätsklinikum Leipzig

