
Hepatobiliäre Karzinome – Therapiekonzepte
Arndt Vogel, Paul Schirmer, Martha Kirstein
Interdisziplinäre, multimodale Therapieansätze sind essenziell für die erfolgreiche Behandlung hepatobiliärer Tumoren. Neue molekulare Substanzen insbesondere aus dem Bereich der Immuntherapie erscheinen vielversprechend. Mit großer Wahrscheinlichkeit werden diese künftig Eingang in die Therapiealgorithmen des hepatozellulären sowie des Cholangiokarzinoms finden.
Schlüsselwörter: Cholangiokarzinom, Hepatozelluläres Karzinom, Chemotherapie, molekulare Therapie, lokoregionäre Therapie
Das hepatozelluläre Karzinom (HCC) ist die fünfthäufigste Krebs-Entität weltweit, rangiert jedoch hinsichtlich der krebsbedingten Todesursachen auf dem dritten Platz. In den letzten Jahren zeigte sich eine stetige Zunahme der Inzidenz – weltweit werden jedes Jahr mehr als 700.000 Fälle neu diagnostiziert. Auch in den westlichen Ländern ist ein steigender Trend festzustellen. Das HCC entsteht in 70–80% aller Fälle auf dem Boden einer Leberzirrhose, welche die Funktion der Leber in der Regel deutlich beeinträchtigt. Komplikationen der Leberzirrhose wie Blutungen aus Ösophagusvarizen, Aszites oder eine hepatische Enzephalopathie tragen zur hohen Mortalität und Morbidität der Patienten bei. Das über fünf Jahre kumulierte Risiko von zirrhotischen Patienten, ein HCC zu entwickeln, liegt zwischen 5% und 30%. Die hauptsächlichen Risikofaktoren für die Entstehung einer Leberzirrhose und damit eines HCC sind chronische Infektionen mit dem Hepatitis-B- (HBV) oder dem Hepatitis-C-Virus (HCV) und Alkoholabusus. Zudem wird das HCC-Risiko durch eine nicht alkoholbedingte Leberverfettung (NAFLD/NASH) erhöht [1].
Das Cholangiokarzinom (CCA) ist mit circa 5.000 Neuerkrankungen jährlich der zweithäufigste primäre Lebertumor in Deutschland mit einer 5-Jahres-Überlebensrate von unter 20%. Auch beim CCA ist ein Anstieg der Inzidenz in den entwickelten Ländern der westlichen Hemisphäre zu beobachten. Risikofaktoren für das CCA sind insbesondere Alter, Übergewicht, Hepatitis B und C, primär sklerosierende Cholangitis sowie in asiatischen Ländern der Leberegel.
Therapiekonzepte beim HCC
Stadiengerechte Therapiekonzepte
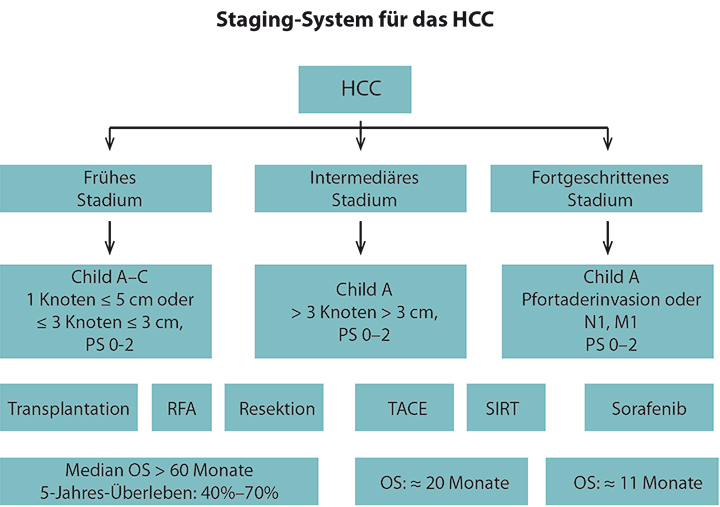
Bei allen Patienten mit einem HCC müssen neben dem Tumorstadium die Leberfunktion sowie der allgemeine Leistungszustand in die therapeutischen Entscheidungen einbezogen werden (Abb. 1). Neben dem Child-Pugh-Score wurden auch neuere Scores zur Beurteilung der Leberfunktion entwickelt (u. a. der ALBI-Score), deren Stellenwert sich künftig in prospektiven Studien zeigen muss. Grundsätzlich werden die potenziell kurativen Verfahren mit Lebertransplantation, Resektion und Ablation von den palliativen Optionen – der transarteriellen Chemoembolisation (TACE), der selektiven internen Radiotherapie (SIRT) sowie der Behandlung mit dem Multikinase-Inhibitor Sorafenib – unterschieden.
Obligat ist die Vorstellung jedes HCC-Patienten im Rahmen einer interdisziplinären Tumorkonferenz mit Vertretern aus Onkologie, Hepatologie, Chirurgie (möglichst mit hepatobiliärem/Transplantations-Schwerpunkt), interventioneller Radiologie, Nuklearmedizin sowie Strahlentherapie. Die Lebertransplantation stellt bei Patienten mit Leberzirrhose und HCC-Manifestation innerhalb der Milan-Kriterien (drei Herde < 3 cm oder ein Herd < 5 cm) das Verfahren der Wahl dar. Für diese Patienten lassen sich durch eine Lebertransplantation 5-Jahres-Überlebensraten von über 70% erzielen [2]. Der heute bestehende Organmangel erfordert Verfahren, mit denen die Zeit bis zur Transplantation überbrückt werden kann (sog. Bridging). Trotzdem versterben ca. 20% der Patienten vor einem Organangebot.
Neben der Transplantation zählen Leber-Teilresektion sowie Tumorablation – Radiofrequenz- oder Mikrowellen-Ablation (RFA/MWA) – zu den potenziell kurativen Therapieverfahren. Die Entscheidung für das jeweilige Verfahren ist individuell anhand Zahl und Größe der vorhandenen Tumoren, der Leberfunktion, des Ausmaßes der portalen Hypertension sowie des klinischen Allgemeinzustandes des Patienten zu treffen.
In der als Abstract publizierten Phase-III-Studie STORM konnten durch eine adjuvante Therapie mit Sorafenib die Remissionsraten und das Überleben nach Ablation oder Resektion eines HCC nicht verbessert werden [3]. Mit dieser Studie liegen aber erstmals prospektive Daten zum natürlichen Verlauf des frühen HCC (90% unilokulär, mediane Tumorgröße 35 mm) vor. Das mediane rezidivfreie Überleben lag bei 33 Monaten. Entsprechend ist damit bei mehr als 50% der Patienten im Verlauf mit einem Rezidiv zu rechnen.
Bei Patienten mit grenzwertig großen Tumoren (≤ 7 cm) kann auch im Sinne eines Downstagings, weniger wahrscheinlich einer reinen Neoadjuvanz, die RFA/MWA mit der TACE kombiniert werden. In einer prospektiven chinesischen Studie war durch die kombinierte Therapie eine signifikante Verbesserung des Überlebens zu erreichen [4].
Für Patienten, bei denen ein kuratives Vorgehen nicht möglich ist und die entweder ein solitäres oder multifokales HCC ohne wesentlichen extrahepatischen Befall sowie ein ECOG-Stadium < 2 bei einer Leberzirrhose im Child-Pugh-Stadium A oder B aufweisen, empfiehlt die deutsche Leitlinie den Einsatz einer TACE. Die Empfehlung basiert maßgeblich auf den Ergebnissen zweier randomisierter, kontrollierter Phase-III-Studien und einer Metaanalyse, die eine signifikante Verbesserung des Überlebens von mittels TACE behandelten Patienten gezeigt haben [5, 6]. Die Behandlung von Patienten mit nicht resektablem HCC mit mehreren TACE-Zyklen erzielte einen Überlebensvorteil von 51% gegenüber Patienten, die nicht mit einer TACE behandelt wurden [5].
In den vergangenen Jahren wurden zahlreiche negativ sowie positiv prognostische Faktoren – betreffend den Patienten, den Tumor und die Methode – identifiziert [7–9]. Für ein positives Ergebnis ist daher eine sorgfältige Selektion der Patienten essenziell. Im klinischen Alltag erfolgt die TACE häufig mehrfach. Entsprechend der Verträglichkeit und der Nebenwirkungen liegt das Therapieintervall zwischen vier Wochen und drei Monaten. Bislang fehlen allerdings evidenz-basierte Standards zu Therapiefrequenz und –interval sowie auch zur Methodik der TACE, die eine hohe Variabilität zwischen Zentren aufweist.
Als neueres palliatives, lokoregionäres Therapieverfahren ist die SIRT zu nennen. Der Einsatz der SIRT ist insbesondere bei großen HCC-Herden, Pfortader-Thrombose oder nach Progress unter TACE-Therapie zu erwägen. Aktuell wird die Effektivität der SIRT in einer Reihe von größeren Phase-III-Studien sowohl in der Kombination als auch im Vergleich zu einer Therapie mit Sorafenib geprüft.
Neben der internen Bestrahlung wird auch zunehmend der Stellenwert einer stereotaktischen und einer Protonenbestrahlung beim HCC untersucht. Erste kleinere Phase-II-Studien sowie retrospektive Untersuchungen haben die Sicherheit der Methoden gezeigt und lassen zudem auf eine gute Effektivität schließen, sodass die externe Bestrahlung wahrscheinlich in Zukunft vermehrt Einzug in die multimodalen Therapiekonzepte beim HCC finden wird [10, 11].
Für Patienten, die einer lokoregionären Therapie nicht zugänglich sind, stellt der Multikinase-Inhibitor Sorafenib, der sowohl die Tumor-Angiogenese als auch die Tumor-Proliferation hemmt, die bis dato einzige zugelassene, systemische Therapie dar. In der SHARP-Studie konnte eine Verlängerung des Gesamtüberlebens im Vergleich zu Placebo von 7,9 auf 10,7 Monate gezeigt werden, sodass der Einsatz von Sorafenib für Patienten mit erhaltener Leberfunktion (Child-Pugh A), gutem Allgemeinzustand (ECOG 0–2) und fortgeschrittenem HCC oder Progress nach lokoregionären Therapien empfohlen wird [12]. Eine Fortführung der Therapie über den symptomatischen oder radiologischen Progress hinaus erscheint dabei nicht sinnvoll.
Multimodale Therapiekonzepte beim HCC
Die Kombination von systemischer Therapie mit lokalen Therapieansätzen wurde aufgrund des Überlebensvorteils im palliativen Setting in verschiedenen Studien sowohl nach Resektion und RFA als auch mit TACE und SIRT geprüft.
In der SPACE-Studie wurde untersucht, ob durch die Kombination von TACE und Sorafenib die Zeit bis zur Tumorprogression verlängert werden kann. Diese Studie hat zwar statistisch den primären Endpunkt erreicht, ohne allerdings einen klinisch relevanten Nutzen nachzuweisen zu können [13].
Auch in einer placebokontrollierten japanischen Phase-III-Studie konnte durch ein sequenzielles Behandlungsregime, bei dem Sorafenib als Adjuvans nach TACE eingesetzt wurde, keine signifikante Verlängerung der Zeit bis zum Progress erreicht werden. Einschränkend muss allerdings festgehalten werden, dass bei einem Großteil der Patienten die Therapie nicht wie im Rahmen des Studienprotokolls geplant durchgeführt werden konnte [14].
Ähnlich negativ fielen zwei weitere Studien aus, in denen die Tyrosinkinaseinhibitoren Brivanib und Orantinib in Kombination mit TACE untersucht wurden, sodass derzeit eine kombinierte Behandlung außerhalb von Studien nicht empfohlen werden kann [15].
Eine in Deutschland selten angewandte und in der aktuellen Leitlinie nicht empfohlene Kombination ist die einer TACE mit einer externen Bestrahlung. Eine aktuelle Metaanalyse der verfügbaren Studien zeigte aber eine durchaus vielversprechende Verlängerung des Überlebens bei akzeptabler Toxizität, sodass diese Kombination in Studien prospektiv geprüft werden sollte [16].
In der Phase-II-Studie SORAMIC wird derzeit in einem primär kurativen ebenso wie in einem palliativen Arm die Kombination der RFA mit Sorafenib geprüft. Primärer Endpunkt der Studie ist die Zeit bis zur Progression im Frühstadium und die Gesamtüberlebenszeit bei fortgeschrittenem HCC.
Einsatz neuer Tyrosinkinaseinhibitoren beim HCC
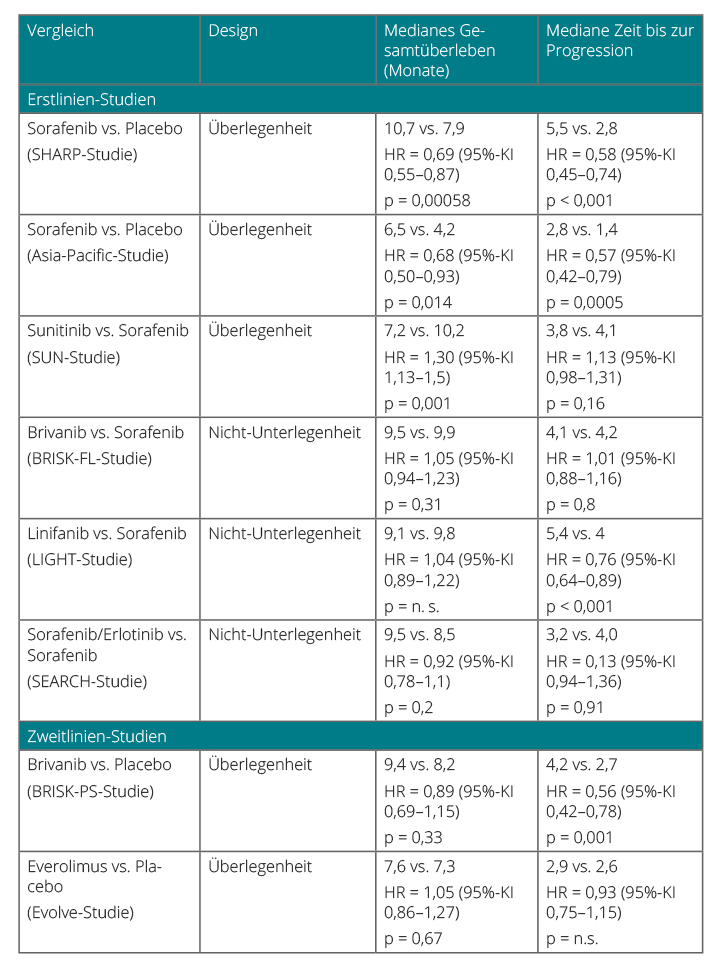
Eine Reihe neuer Tyrosinkinaseinhibitoren befindet sich derzeit in klinischer Entwicklung, bislang allerdings mit größtenteils ernüchternden Ergebnissen (Tabelle 1):
Untersuchungen mit den Angiogeneseinhibitoren Sunitinib und Brivanib, den Inhibitoren des Epidermal Growth Factor Receptor (EGFR) Erlotinib, Gefitinib, Lapatinib und Cetuximab, dem mTOR-Inhibitor Everolimus sowie dem Inhibitor der Mitogen-Activated ERK Kinase (MEK) Selumetinib waren bislang in der palliativen Situation wenig erfolgreich.
Eine Subgruppenanalyse der REACH-Studie liefert jedoch Hinweise, dass der Einsatz von Ramucirumab, einem Antikörper gegen den Vascular Endothelial Growth Factor Receptor (VEGFR) in der Zweitlinie bei Patienten mit Child-Pugh-Status A und erhöhtem AFP (> 400 ng/ml) effektiv erscheint. Basierend auf diesen Ergebnissen wurde aktuell eine neue Phase-III-Studie in diesem Patientenkollektiv begonnen.
Darüber hinaus wird der Inhibition der Tyrosinkinase des Rezeptors c-MET sowie seines Liganden, des Hepatocyte Growth Factor (HGF), ein therapeutischer Nutzen zugeschrieben. Nach ersten positiven Ergebnissen einer Phase-II-Studie läuft aktuell mit CELESTIAL eine Phase-III-Studie, in welcher Cabozantinib (XL184), ein oral verfügbarer, dualer MET/VEGFR2-Inhibitor, bei Patienten auch unabhängig vom individuellen
c-MET-Status eingesetzt wird. Weiterhin wurde gerade eine große Phase-III-Studie mit Tivantinib (ARQ197), einem weiteren erfolgsversprechenden c-MET-Inhibitor, bei Patienten mit c-MET-exprimierendem HCC abgeschlossen.
Insgesamt bleibt die Entwicklung der systemischen Behandlung des HCC anspruchsvoll. Zunehmend zeichnet sich aber eine schwierige Balance zwischen Toxizität der Behandlung und anti-tumoraler Wirkung ab, die eine signifikante Verbesserung des Überlebens von Patienten mit HCC ermöglicht. Eine mögliche Lösung dieses Dilemmas kann nur in der Identifizierung prädiktiver genetischer oder klinischer Faktoren liegen, die eine effektive Therapie in Subgruppen der HCC-Patienten ermöglicht.
Therapiekonzepte beim CCA
Kurative Therapiekonzepte
Die R0-Resektion stellt die einzige potenziell kurative Therapieoption für das CCA dar. Bei Fernmetastasierung ist ein chirurgisches Vorgehen kontraindiziert.
Wichtige prognostische Faktoren sind ein Lymphknoten-Befall, eine vaskuläre Invasion und der Differenzierungsgrad. Ist ein zu geringes verbleibendes Rest-Lebervolumen zu erwarten, können präoperativ verschiedene Verfahren zur Induktion einer Hypertrophie wie Pfortader-Embolisation, In-situ-Splittechnik oder ALPPS (Associating Liver Partition and Portal Vein Ligation for Staged Hepatectomy) eingesetzt werden. Chirurgische Ansätze können außerdem mit interventionellen Verfahren wie einer Radiatio oder einer thermischen Destruktion kombiniert werden.
Neoadjuvante und adjuvante Therapiekonzepte beim CCA
Nach chirurgischer Resektion zeigt sich innerhalb der ersten drei Jahre bei bis zu 85% der Patienten ein Rezidiv, sodass adjuvante Therapiekonzepte von großer Bedeutung sein könnten. Bis dato gibt es jedoch keine belastbaren Studienergebnisse, die einen Vorteil einer adjuvanten Therapie versus alleiniger Resektion belegen. Auch die Rolle der adjuvanten Bestrahlung oder kombinierten Radiochemotherapie ist bislang nicht klar definiert. Eine prospektive Studie zeigte keinen Vorteil einer postoperativen Bestrahlung bei extrahepatischen CCA [17]. Zu dem gleichen Ergebnis kam eine retrospektive Studie, in der 1.491 Patienten mit extrahepatischen CCA aus dem Surveillance, Epidemiology, and End Results (SEER)-Programm untersucht wurden, darunter 473 mit adjuvanter Radiatio behandelte [18]. In einer 2012 veröffentlichten Metaanalyse mit insgesamt 6.712 Patienten konnte ebenfalls kein signifikanter Vorteil einer adjuvanten Therapie nachgewiesen werden [19].
In Subgruppenanalysen zeigte sich neben einem Vorteil der Chemotherapie im Vergleich zur Radio-/Radiochemotherapie ohne letztlich jedoch signifikanten Unterschied im medianen Gesamtüberleben ein Überlebensvorteil der adjuvanten Behandlung bei Patienten mit Nachweis einer lymphogenen Metastasierung oder R1-Resektion. Bei Patienten mit hohem Risiko für eine Progression der Tumorerkrankung (N1, R1 oder beides) kann daher eine adjuvante Therapie diskutiert werden.
Neben anderen Phase-III-Studien wird derzeit in der internationalen Phase-III-Studie ACTICCA-1 der Arbeitsgemeinschaft Internistische Onkologie (AIO) der Stellenwert einer adjuvanten Therapie mit Gemcitabin/Cisplatin im Vergleich zu einer alleinigen Operation nach makroskopisch kompletter Resektion untersucht.
Einzelne Fallberichte beschreiben ein erfolgreiches präoperatives Downstaging bei primär nicht resektablen Patienten durch eine systemische Chemotherapie. Belastbare Daten für ein neoadjuvantes Therapiekonzept gibt es derzeit allerdings nicht.
Lokale Therapiekonzepte beim CCA
Eine präoperative endoskopische Gallengangs-Drainage sollte bei einer akuten Cholangitis, einem erhöhten Bilirubinwert (> 10 mg/dl) sowie vor einer ausgedehnten Leberresektion zum postoperativen Erhalt der funktionellen Leberreserve erfolgen. Goldstandard ist die endoskopische Drainage mittels endoskopisch retrograder Cholangiografie (ERC) und Stent-Implantation. In der palliativen Situation wird der Nutzen einer ein- oder beidseitigen Drainage und die Verwendung von Metall- vs. Plastik-Stents kontrovers diskutiert. Hierbei stehen den Vorteilen der Metall-Stents hinsichtlich des geringeren Okklusions-Risikos die fehlende Option der späteren Entfernung bei Tumoreinbruch mit konsekutiven Revisions- und Drainage-Schwierigkeiten gegenüber.
Einige prospektive Studien bescheinigen der photodynamischen Therapie (PDT) eine signifikante Verbesserung des Galle-Abflusses, der Lebensqualität und auch der Lebenserwartung im Vergleich zum Stenting alleine. Zur genaueren Bestimmung des Stellenwertes der PDT muss diese allerdings erst in prospektiven randomisierten klinischen Studien im Kontext der etablierten Chemotherapie-Verfahren untersucht werden.
Für die stereotaktische Bestrahlung (SBRT), die Protonentherapie und die SIRT gibt es ähnlich wie beim HCC mittlerweile eine Reihe von vielversprechenden, allerdings kleineren und primär retrospektiven bzw. einarmigen Studien [10, 20, 21]. Basierend auf diesen Daten wird aktuell in der ABC-07-Studie die Wirksamkeit der SBRT und in der SIRCCA-Studie die Wirksamkeit der SIRT in Kombination mit einer Gemcitabin-/Cisplatin-basierten Chemotherapie untersucht.
Eine weitere potenzielle Therapiealternative für das Chemotherapie-refraktäre CCA stellt die TACE dar. Im Gegensatz zum HCC gibt es hier allerdings nur kleinere retrospektive Arbeiten, die aber eine Wirksamkeit insbesondere bei intrahepatischen CCAs zeigen [22]. Dies gilt auch für weitere lokale Therapieverfahren wie die transpapilläre ERC-gesteuerte RFA, Afterloading-/Brachytherapie sowie die Chemosaturation, welche in Einzelfällen bereits heute in die multimodale Behandlung des CCA integriert werden können.
Palliative Therapiekonzepte beim CCA
Lange Zeit war die Monotherapie mit Gemcitabin Standard in der Behandlung des fortgeschrittenen CCA, ohne dass je eine Wirksamkeit in randomisierten Phase-III-Studien nachgewiesen worden wäre. In der 2010 veröffentlichten Phase-III-Studie ABC-02 wurde die Therapie mit Gemcitabin als Monotherapie einer Kombination von Gemcitabin und Cisplatin gegenübergestellt. Das mediane Überleben war in der Kombinationsgruppe signifikant länger als in der Gemcitabin-Monotherapie-Gruppe (11,7 vs. 8,1 Monate; Hazard Ratio 0,64; 95%-Konfidenzintervall 0,52–0,8; p < 0,001), ohne eine deutliche Zunahme der Toxizität [23]. Die Kombinationstherapie mit Gemcitabin und Cisplatin gilt daher heute als Standardtherapie des nicht-resektablen CCA in der Erstlinientherapie.
Im Fall von Kontraindikationen für eine Therapie mit Cisplatin, wie z. B. einer eingeschränkten Nierenfunktion, kann alternativ zu Cisplatin auch Oxaliplatin eingesetzt werden. Die Kombination aus Gemcitabin und Oxaliplatin wurde in mehreren Phase-II-Studien untersucht und zeigte ebenfalls Effektivität (Gesamtüberlebenszeit 8,3–11 Monate) und Sicherheit [24].
Neben der Gemcitabin-basierten Chemotherapie haben sich Fluoropyrimidine (FU), als Monotherapie oder kombiniert mit verschiedenen Substanzen, als wirksam beim CCA gezeigt. In Kombination mit Gemcitabin/Cisplatin wurde auch S-1, das orale Prodrug von 5-FU, welches vor allem in asiatischen Ländern Verwendung findet, in der palliativen Therapie des CCA untersucht [25]. Die Kombination mit Gemcitabin zeigte dabei eine Ansprechrate von 20% vs. 9,4%. Zu den aktuell prospektiv untersuchten Chemotherapie-Kombinationen gehören unter anderen FOLFIRINOX und Gemcitabin in Kombination mit nab-Paclitaxel analog zur Therapie des Pankreaskarzinoms.
Hinsichtlich einer Zweitlinientherapie existieren keine randomisierten Studien. Ein systematischer Review zur Zweitlinie fasste kürzlich die Ergebnisse von knapp 800 Patienten aus 14 Phase-II-Studien und mehreren retrospektiven Analysen und Kasuistiken zusammen [26]. Das mediane progressionsfreie und Gesamtüberleben lag bei 3,2 bzw. 7,2 Monaten. Es wurden zudem nur geringe Ansprechraten von 7,7% und Tumorkontrollraten von 48% ermittelt.
Wie aus den genannten retrospektiven Studien ersichtlich, ist es trotz unzureichender Evidenz in der Praxis nicht unüblich und wahrscheinlich gerechtfertigt, Patienten mit gutem Allgemeinzustand und Therapiewunsch eine Zweitlinientherapie anzubieten. Praktikabel erscheint in dem Fall ein Wechsel auf zuvor nicht verwendete und gut verträgliche Substanzen, z. B. nach Standard-Erstlinientherapie mit Gemcitabin und Cisplatin ein Wechsel auf eine 5-FU-basierte Therapie. Aktuell werden in der Phase-II-Studie PIITCAP CCA-Patienten nach Versagen einer Gemcitabin-basierten Therapie für eine Behandlung mit dem Chemotherapeutikum CAP7.1 – einer inaktiven Vorstufe von Etoposid, die durch eine Carboxylesterase präferenziell in Tumorzellen aktiviert wird – rekrutiert.
Neue molekulare Therapiekonzepte beim CCA
Zielgerichtete Therapien stehen auch beim CCA wie bei vielen anderen Tumorentitäten im Fokus des Interesses und werden in mehreren Studien untersucht. Bisher ist noch keine Substanz aus dieser Gruppe für die Therapie des CCA zugelassen. Derzeit am besten untersucht ist die EGFR-Inhibition. In der einarmigen Studie von Grünberger et al. wurden unter dem chimären EGFR-Antikörper Cetuximab in Kombination mit GEMOX Ansprechraten von 63% erreicht mit einer Komplettremission bei drei Patienten und einer sekundären Resektabilität bei fast 30% [27].
Enttäuschend waren diesbezüglich allerdings die Ergebnisse der randomisierten Phase-II-Studie BINGO, die keine Wirksamkeit von Cetuximab in Kombination mit GEMOX zeigen konnte [28]. Zuletzt erbrachte auch die beim ASCO-Kongress 2015 vorgestellte PICCA-Studie, in der die Wirksamkeit des EGFR-Inhibitors Panitumumab in der Kombination mit Gemcitabin/Cisplatin bei Patienten mit KRAS-Wildtyp untersucht wurde, ernüchternde Ergebnisse, und es konnte keine Verbesserung von progressionsfreiem oder Gesamtüberleben erreicht werden.
Anders als beim HCC zeigte Sorafenib weder in der Monotherapie noch in der Kombination mit Gemcitabin eine nennenswerte Aktivität [29]. Auch die kürzlich als Abstract publizierte ABC-03-Studie konnte keine Verbesserung des Überlebens unter einer Chemotherapie in Kombination mit dem VEGF-Inhibitor Cediranib oder mit Sorafenib zeigen [30].
Seit einiger Zeit sind Inhibitoren eines weiteren potenziellen onkogenen Zielproteins, der Kinase MEK, verfügbar. Der MEK1/2-Inhibitor Selumetinib wurde auch bei Patienten mit metastasiertem CCA getestet und zeigte in der Monotherapie eine wenig überzeugende Ansprechrate von 12%, ein progressionsfreies Überleben von 3,7 Monaten sowie ein Gesamtüberleben von 9,8 Monaten [31]. Zu weiteren zukünftigen Therapieansätzen, welche bisher aber nur in vitro oder im Tiermodell untersucht wurden, gehören Behandlungen, die sich gegen Tumor-assoziierte Fibroblasten (CAF) richten sowie Inhibitoren des Notch-, JAK2/STAT3- und Hedgehog-Signalwegs und Inhibitoren der Histondeacetylase 6 (HDAC-6).
Immuntherapie bei hepatobiliären Tumoren
Der Immuntherapie wird ein enormes therapeutisches Potenzial auch bei hepatobiliären Tumoren eingeräumt. Insbesondere für den Einsatz von Inhibitoren der immunologischen Checkpoints konnten beim ASCO-Kongress 2015 erste vielversprechende Daten gezeigt werden. Diese systemisch applizierten Antikörper führen zur Aktivierung tumorspezifischer T-Zellen und zeichnen sich typischerweise durch eine ausgeprägte und lange Wirksamkeit bei relativ guter Verträglichkeit aus.
In einer Phase-I/II-Studie wurde der Programmed-Death 1 (PD1)-Antikörper Nivolumab bei Patienten mit HCC eingesetzt. Hierbei lag bei der Hälfte der Patienten eine virale Hepatitis zugrunde, und 70% der Patienten waren mit Sorafenib vorbehandelt [32]. Es fand sich eine Ansprechrate von 18% über alle Dosislevel (0,1 bis 10 mg/kg) unabhängig von der zugrunde liegenden Lebererkrankung; die 1-Jahres-Überlebensrate von 62% war bei äußerst moderaten Nebenwirkungen sehr beeindruckend. In einer weiteren Phase-I-Studie konnte die Sicherheit der Immuntherapie in Kombination mit lokalen Therapien (TACE, RFA) gezeigt werden [33].
Auch beim CCA erscheint ein immuntherapeutischer Ansatz aussichtsreich. Auf dem letztjährigen ASCO-Kongress konnte durch Nivolumab eine signifikante biochemische und radiologische Remission bei Patienten mit gastrointestinalen Tumoren mit Mikrosatelliten-Instabilität (MSI) erreicht werden. In dem untersuchten Kollektiv befand sich auch ein Patient mit CCA, der unter der Immuntherapie ein biochemisches und radiologisches Ansprechen erzielte [34].
Im Rahmen des Europäischen Krebskongresses 2015 wurden aktuelle Daten aus der laufenden klinischen Phase-Ib-Studie KEYNOTE-028 für den PD-1-Inhibitor Pembrolizumab bei verschiedenen Malignomen vorgestellt [35]. In der Analyse von 24 intensiv vorbehandelten Patienten mit CCA zeigte sich eine Ansprechrate von 17,4%, und alle Patienten wiesen eine stabile Erkrankung auf. Die unerwünschten Ereignisse waren mit den bereits zuvor beschriebenen Sicherheitsdaten für Pembrolizumab vergleichbar.
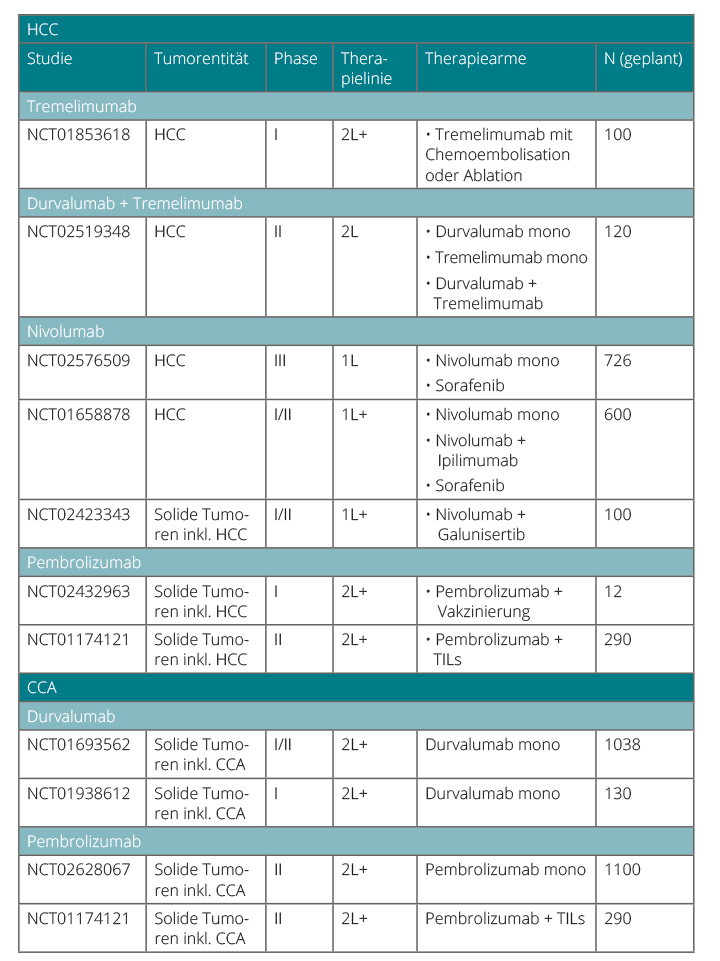
Wenn sich die Ergebnisse der ersten klinischen Studien im Rahmen von größeren Phase-III-Studien verifizieren lassen sollten (Tabelle 2), darf man davon ausgehen, dass die Immuntherapie in absehbarer Zeit auch integraler Bestandteil der multimodalen Therapie-Algorithmen bei hepatobiliären Tumoren sein wird.
Interessenskonflikte: Die Autoren geben an, dass keine Interessenskonflikte bestehen.
Literatur
1. El-Serag HB. Hepatocellular carcinoma. N Engl J Med 2011; 365: 1118-27.
2. Mazzaferro V et al. Predicting survival after liver transplantation in patients with hepatocellular carcinoma beyond the Milan criteria: A retrospective, exploratory analysis. Lancet Oncol 2009; 10: 35-43.
3. Bruix J et al. STORM: A phase III randomized, double-blind, placebo-controlled trial of adjuvant sorafenib after resection or ablation to prevent recurrence of hepatocellular carcinoma (HCC). J Clin Oncol 2014; 32(15S): 256s (ASCO 2014, Abstract #4006).
4. Peng ZW et al. Radiofrequency ablation with or without transcatheter arterial chemoembolization in the treatment of hepatocellular carcinoma: A prospective randomized trial. J Clin Oncol 2013; 31: 426-32.
5. Llovet JM et al. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: A randomised controlled trial. Lancet 2002; 359: 1734-9.
6. Lo CM et al. Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology 2002; 35: 1164-71.
7. Raoul JL et al. Evolving strategies for the management of intermediate-stage hepatocellular carcinoma: Available evidence and expert opinion on the use of transarterial chemoembolization. Cancer Treat Rev 2011; 37: 212-20.
8. Salem R et al. Radioembolization for hepatocellular carcinoma using Yttrium-90 microspheres: a comprehensive report of long-term outcomes. Gastroenterology 2010; 138: 52-64.
9. Sangro B et al. Radioembolization for hepatocellular carcinoma. J Hepatol 2012; 56: 464-73.
10. Hong TS et al. Multi-institutional phase II study of high-dose hypofractionated proton beam therapy in patients with localized, unresectable hepatocellular carcinoma and intrahepatic cholangiocarcinoma. J Clin Oncol 2016; 34: 460-8.
11. Wahl DR et al. Outcomes after stereotactic body radiotherapy or radiofrequency ablation for hepatocellular carcinoma. J Clin Oncol 2016; 34: 452-9.
12. Llovet JM et al. Sorafenib in advanced hepatocellular carcinoma. N Engl J Med 2008; 359: 378-90.
13. Lencioni R et al. Sorafenib or placebo in combination with transarterial chemoembolization (TACE) with doxorubicin-eluting beads (DEBDOX) for intermediate-stage hepatocellular carcinoma (HCC): Phase II, randomized, double-blind SPACE trial. J Clin Oncol 2012; 30 (4S): (ASCO-GI 2012, Abstract #LBA 154).
14. Kudo M et al. Phase III study of sorafenib after transarterial chemoembolisation in Japanese and Korean patients with unresectable hepatocellular carcinoma. Eur J Cancer 2011; 47: 2117-27.
15. Kudo M et al. Brivanib as adjuvant therapy to transarterial chemoembolization in patients with hepatocellular carcinoma: A randomized phase III trial. Hepatology 2014; 60: 1697-707.
16. Huo YR, Eslick GD. Transcatheter arterial chemoembolization plus radiotherapy compared with chemoembolization alone for hepatocellular carcinoma: A systematic review and meta-analysis. JAMA Oncol 2015; 1: 756-65.
17. Pitt HA et al. Perihilar cholangiocarcinoma. Postoperative radiotherapy does not improve survival. Ann Surg 1995; 221: 788-97; discussion 797-8.
18. Vern-Gross TZ et al. Survival outcomes in resected extrahepatic cholangiocarcinoma: Effect of adjuvant radiotherapy in a surveillance, epidemiology, and end results analysis. Int J Radiation Oncol Biol Physics 2011; 81: 189-98.
19. Horgan et al. Adjuvant therapy in the treatment of biliary tract cancer: a systematic review and meta-analysis. J Clin Oncol 2012; 30: 1934-40.
20. Al-Adra DP et al. Treatment of unresectable intrahepatic cholangiocarcinoma with yttrium-90 radioembolization: A systematic review and pooled analysis. Eur J Surg Oncol 2015; 41: 120-7.
21. Ibrahim SM et al. Treatment of unresectable cholangiocarcinoma using yttrium-90 microspheres: Results from a pilot study. Cancer 2008; 113: 2119-28.
22. Gusani NJ et al. Treatment of unresectable cholangiocarcinoma with gemcitabine-based transcatheter arterial chemoembolization (TACE): A single-institution experience. J Gastrointest Surg 2008; 12: 129-37.
23. Valle J et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med 2010; 362: 1273-81.
24. Eckel F, Schmid RM. Chemotherapy in advanced biliary tract carcinoma: A pooled analysis of clinical trials. Br J Cancer 2007; 96: 896-902.
25. Sasaki T et al. A randomized phase II study of gemcitabine and S-1 combination therapy versus gemcitabine monotherapy for advanced biliary tract cancer. Cancer Chemother Pharmacol 2013; 71: 973-9.
26. Lamarca A et al. Second-line chemotherapy in advanced biliary cancer: A systematic review. Ann Oncol 2014; 25, 2328-2338.
27. Gruenberger B et al. Cetuximab, gemcitabine, and oxaliplatin in patients with unresectable advanced or metastatic biliary tract cancer: A phase 2 study. Lancet Oncol 2010; 11: 1142-8.
28. Malka D et al. Gemcitabine and oxaliplatin with or without cetuximab in advanced biliary-tract cancer (BINGO): A randomised, open-label, non-comparative phase 2 trial. Lancet Oncol 2014; 15: 819-28.
29. Moehler M et al. Gemcitabine plus sorafenib versus gemcitabine alone in advanced biliary tract cancer: A double-blind placebo-controlled multicentre phase II AIO study with biomarker and serum programme. Eur J Cancer 2014; 50: 3125-35.
30. Valle JW et al. Cediranib or placebo in combination with cisplatin and gemcitabine chemotherapy for patients with advanced biliary tract cancer (ABC-03): A randomised phase 2 trial. Lancet Oncol 2015; 16: 967-78.
31. Bekaii-Saab T et al. Multi-institutional phase II study of selumetinib in patients with metastatic biliary cancers. J Clin Oncol 2011; 29: 2357-63.
32. El-Khoueiri AB et al. Phase I/II safety and antitumor activity of nivolumab in patients with advanced hepatocellular carcinoma (HCC): CA209-040. J Clin Oncol 2015; 33(S15): (ASCO 2015, Abstract #LBA101)
33. Duffy AG et al. A pilot study of tremelimumab - A monoclonal Antibody against CTLA-4 – in combination with either trans catheter arterial chemoembolization (TACE) or radiofrequency ablation (RFA) in patients with hepatocellular carcinoma (HCC). J Clin Oncol 2015; 33(15S): 229s (ASCO 2015, Abstract #4081).
34. Le DT et al. PD-1 blockade in tumors with mismatch repair deficiency. J Clin Oncol 2015; 33(15S): 5s (ASCO 2015, Abstract #LBA100).
35. Bang YJ et al. Safety and efficacy of pembrolizumab (MK-3475) in patients (pts) with advanced biliary tract cancer: Interim results of KEYNOTE-028. ESMO 2015, Abstract #525.

Korrespondierender Autor
Prof. Dr. med. Arndt Vogel
Medizinische Hochschule Hannover
Klinik für Gastroenterologie,
Hepatologie und Endokrinologie
Carl-Neuberg-Str. 1, 30625 Hannover.
+49 511 532 9590
+49 511 532 8392
vogel.arndt[at]mh-hannover[dot]de

