Neue Wege in der gastrointestinalen Onkologie
Editorial
Fortschritte in der Behandlung von Tumoren des oberen Gastrointestinaltrakts werden dringend erwartet: In der EUROCARE-5 Studie finden sich unter den zehn Krebsarten mit der schlechtesten Gesamtprognose fünf gastrointestinale Tumorentitäten, nämlich Karzinome des Magens, der Gallenblase, der Speiseröhre, der Leber und – mit der kritischsten Gesamtprognose in der gesamten Onkologie – des Pankreas [1].
Multidisziplinarität und Qualität
Ein entscheidender Schritt nach vorne wurde in der gastrointestinalen Onkologie durch die Implementierung multidisziplinärer Behandlungsverfahren getan. Sowohl in der Therapie des Magen- wie auch des Ösophaguskarzinoms war die Einführung der neoadjuvanten und perioperativen Therapie ein Meilenstein der vergangenen Jahre und senkte das Sterberisiko der Patienten mit lokal fortgeschrittener Erkrankung um etwa 30% [2, 3]. Die Datenlage bei den hepatobiliären Karzinomen lässt diesbezüglich noch keine endgültigen Schlüsse zu. Sicher ist aber für alle genannten Entitäten, dass eine qualitätsgesicherte Behandlung an Zentren mit ausgewiesener Expertise und Spezialisierung die Grundvoraussetzung für gute Behandlungsergebnisse ist. Die Last der Beweise nach mehr als zehn Jahren Forschung über Mengen und Zentrumsqualität ist erdrückend und spricht eindeutig für eine aktive Qualitätssicherung und Zentralisierung spezialisierter Leistungen [4, 5]. Die Qualitätsinitiative der Deutschen Krebsgesellschaft mit der Bildung spezialisierter Zentren ist ein europaweit beachtetes Modell. Selbstgewählte Verpflichtung zur Qualitätssicherung statt staatlich verordneter Zentralisierung ist das Motto, mit dem für die Patienten und Zuweiser erkennbare und vor allem bessere Behandlungsorte geschaffen werden [6].
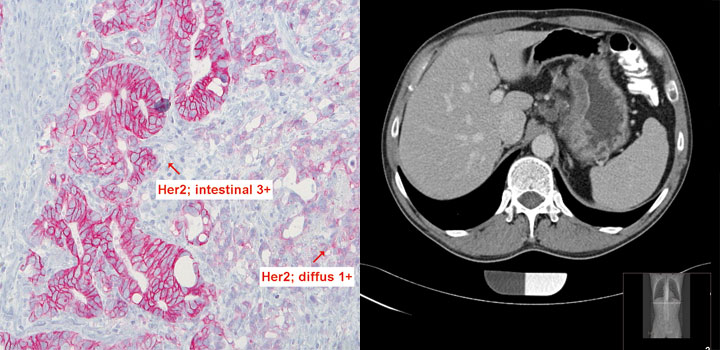
Personalisierte Therapie
Weitere Fortschritte sind auch von einer molekular stratifizierten Therapie zu erwarten. Dabei sind die gastrointestinalen Tumoren, wahrscheinlich wegen der Komplexität ihrer genetischen Alterationen, nicht Vorreiter in der personalisierten Therapie. Wichtige Erfolge gibt es aber auch hier. Die HER2-gerichtete Therapie des fortgeschrittenen HER2-positiven Magenkarzinoms mit Trastuzumab ist trotz der besonderen diagnostischen Herausforderungen zum festen Bestandteil des Behandlungsalgorithmus geworden. Sie verlängert das Überleben signifikant und wird nun auch im perioperativen, kurativ intendierten Behandlungsansatz geprüft [7]. Weitere, teils auf neuen molekularen Klassifikationen basierende zielgerichtete Behandlungsansätze sind in Sicht [7]. Beim Pankreaskarzinom macht die Auswahl der Chemotherapie auf der Basis genetischer Informationen Hoffnung auf bessere Erfolge. Die Beobachtungen konsolidieren sich, dass im Falle eines defekten DNA Reparatursystems (z. B. BRCA-Mutationen) Platin-Analoga eine besonders gute Wirksamkeit entfalten [8].
Immuntherapie
Während beim fortgeschrittenen Melanom und beim Lungenkarzinom Immuntherapeutika Zulassung und Einzug in die Behandlungsroutine gefunden haben, sind bei den gastrointestinalen Tumoren Checkpoint-Inhibitoren, Tumorvakzinen und zelluläre Therapien noch rein experimentell. Dennoch gibt es starke Hinweise, dass Karzinome des Dünndarms oder des hepatobiliären Systems mit Mikrosatelliten-Instabilität reichlich immunogene Zielstrukturen exprimieren und damit ein geeignetes Target für PD-1 Antikörper darstellen [9]. PD-L1 exprimierende Tumoren des Magens und Ösophagus zeigten ebenfalls in ersten kleineren Studien vielversprechende Ansprechraten auf Checkpoint-Inhibitoren. Die Beobachtung, dass molekular definierte Subgruppen des Magenkarzinoms eine besonders starke PD-L1-Expression aufweisen, gibt Anlass zur Hoffnung, dass effektive Immuntherapien in erreichbare Nähe rücken [7]. Auch beim Ösophaguskarzinom wurden jetzt Immuntherapie-Studien gestartet.
Ausblick
Das vorliegende Heft fasst die aktuellen Therapiestandards für die Tumoren des oberen Gastrointestinaltrakts zusammen. Die Autoren sind ausgewiesene Experten auf ihren Gebieten und vertreten führende Zentren. Alle Beiträge geben Ausblicke auf aktuelle Studienkonzepte und neue biologisch definierte Behandlungsansätze.
Literatur1. De Angelis R et al. Cancer survival in Europe 1999-2007 by country and age: Results of EUROCARE-5 – a population-based study. Lancet Oncol 2014; 15: 23-34.2. Cunningham D et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006; 355: 11-20.3. Shapiro J et al. Neoadjuvant chemoradiotherapy plus surgery versus surgery alone for oesophageal or junctional cancer (CROSS): Long-term results of a randomised controlled trial. Lancet Oncol 2015; 16: 1090-8.4. Birkmeyer JD et al. Hospital volume and surgical mortality in the United States. N Engl J Med 2002; 346: 1128-37.5. Markar SR et al. Surgical proficiency gain and survival after esophagectomy for cancer. J Clin Oncol 2016, Mar 7 [Epub ahead of print; DOI 10.1200/JCO.2015.65.2875].6. Ortmann O et al. Improving structural development in oncology: Transformation of theoretical health care standards and knowledge into a practical approach – 2nd European Roundtable Meeting (ERTM), May 8, 2015, Berlin, Germany. J Cancer Res Clin Oncol 2015, Oct 19 [Epub ahead of print].7. Lordick F, Janjigian YY. Clinical impact of tumour biology in the management of gastroesophageal cancer. Nat Rev Clin Oncol 2016, Mar 1 [Epub ahead of print; DOI 10.1038/nrclinonc.2016.15].8. Waddell N et al. Whole genomes redefine the mutational landscape of pancreatic cancer. Nature 2015; 518: 495-501.9. Le DT et al. PD-1 blockade in tumors with mismatch-repair deficiency. N Engl J Med 2015; 372: 2509-20.

Florian Lordick, Leipzig

