Chemoradiotherapie beim Ösophaguskarzinom mit herausragenden Ergebnissen
ASCO-GI
Regelmäßig Ende Januar lädt die American Society of Clinical Oncology (ASCO) nach San Francisco zur Tagung über gastrointestinale Tumoren (ASCO-GI). Dieses Jahr gab es dabei wieder eine Reihe interessanter neuester Daten vor allem zu nicht-kolorektalen Tumoren.
Ösophagus- und Magenkarzinom
Chemoradiotherapie mit herausragenden Ergebnissen
Eine Alternative zur chirurgischen Resektion bei Patienten mit Ösophaguskarzinom, die dafür zu fragil sind, kann die definitive Chemoradiotherapie sein. In der SCOPE-1-Studie hatten 258 Patienten eine solche Chemoradiotherapie (Cisplatin/Capecitabin mit 50 Gy Bestrahlung) alleine oder in Kombination mit dem EGFR-Antikörper Cetuximab erhalten. Bereits in der initialen Analyse hatten sich im Antikörper-Arm schlechtere Ergebnisse gezeigt [1]; die Langzeit-Auswertung, die Somnath Mukherjee, Oxford, in San Francisco vorstellte, bestätigte diesen negativen Ausgang [2]:
Nach median beinahe vier Jahren Nachbeobachtung lag die mediane Überlebenszeit in der Kontrollgruppe bei 34,5 Monaten, in der Cetuximab-Gruppe hingegen nur bei 24,7 Monaten (Hazard Ratio 1,25; p = 0,137), die 3-Jahres-Überlebensraten betrugen 47,2% vs. 37,6%, im Gegensatz zur initialen Auswertung ist dieser Unterschied allerdings statistisch nicht mehr signifikant. Auch beim progressionsfreien Überleben war die Kontrollgruppe mit median 24,1 vs. 15,9 Monaten numerisch überlegen (HR 1,28; p = 0,114). Interessanterweise, so Mukherjee, gab es für die Chemoradiotherapie bisher noch nie so gute Resultate; sie war in dieser Studie ähnlich wirksam wie die Operation – jedenfalls sind die 3-Jahres-Überlebensraten vergleichbar. Ein Grund für die höheren Progressionsraten im Cetuximab-Arm könnte sein, so Mukherjee, dass weniger Patienten in diesem Arm die volle Strahlendosis erhalten hatten.
Checkpoint-Inhibitor vielversprechend in der Salvagetherapie
Auch das lokalisierte Karzinom von Ösophagus und/oder Magen ist nicht immer heilbar: Mehr als die Hälfte der Tumoren rezidiviert nach einer potenziell kurativen Behandlung. Zusammen mit dem nicht unerheblichen Anteil an Patienten, bei denen die Erkrankung erst nach einer Metastasierung diagnostiziert wird, benötigt also weit mehr als jeder zweite Patient eine systemische Therapie zu Lebensverlängerung oder Palliation.
Hier gibt es dringenden Bedarf an neuen wirksamen Behandlungsoptionen, die nach einer Erst- und Zweitlinientherapie eingesetzt werden können. Immuntherapien, v. a. mit Checkpoint-Inhibitoren, haben in den letzten Jahren auf vielen Gebieten der Onkologie Aufsehen erregt. Der PD-1-Inhibitor Pembrolizumab wurde in der sehr umfangreichen Phase-Ib-Studie bei einer Vielzahl von Tumorentitäten in fortgeschrittenen Stadien mit Expression des PD1-Liganden PD-L1 getestet, darunter 23 Patienten mit Ösophaguskarzinomen oder Tumoren des gastroösophagealen Übergangs. Die sehr ermutigenden Ergebnisse für diese Kohorte konnte in San Francisco Toshihiko Doi, Chiba, präsentieren [3]:
Bei diesen Patienten musste bereits eine Standardtherapie versagt haben, der ECOG-Performancestatus musste bei 0 oder 1 gelegen haben. Sie erhielten Pembrolizumab in einer Dosierung von
10 mg/kg alle zwei Wochen für bis zu zwei Jahre, sofern keine Progression oder intolerable Toxizitäten auftraten. Primärer Endpunkt war die Gesamtansprechrate, wobei das Ansprechen im ersten halben Jahr alle acht Wochen und danach alle zwölf Wochen radiologisch geprüft wurde. Drei Viertel der Patienten litten an einem Plattenepithelkarzinom, die übrigen an Adenokarzinomen; 20 von ihnen (87%) hatten mindestens zwei Vortherapien für die metastasierte Erkrankung erhalten. Nach median 31-wöchiger Nachbeobachtungszeit hatten sieben Patienten (30,4%) angesprochen, wobei die Patienten mit Adenokarzinomen mit 40% besser abzuschneiden schienen als die mit den Plattenepithelkarzinomen (29%); bei drei weiteren Patienten (13%) war eine Krankheitsstabilisierung zu sehen, so Doi. Die progressionsfreie Überlebensrate nach sechs und nach zwölf Monaten lag bei 30,4% bzw. 21,7%. Fünf der insgesamt sieben registrierten Remissionen dauerten zum Zeitpunkt der Auswertung, nach median 40 Wochen, noch an (zwischen 24 und 46 Wochen).
Pankreaskarzinom
Adjuvante Therapie in High-volume-Zentren durchführen!
Es ist bekannt, dass die Operation eines Pankreaskarzinoms an einem Zentrum mit großer Erfahrung, d. h. hohen Patientenzahlen, mehr Erfolg verspricht als die Behandlung in weniger erfahrenen Händen. Ob das Gleiche für die adjuvante Therapie nach der Operation gilt, war bislang unklar. Margaret Mandelson vom Virginia Mason Medical Center in Seattle untersuchte diese Frage an einem Kollektiv von 245 Patienten, die an einem High-volume-Zentrum operiert, aber nur teilweise (139 von ihnen) auch dort, zu einem weiteren Teil von niedergelassenen Onkologen adjuvant behandelt worden waren [6]:
Die Patienten in den beiden Gruppen waren vergleichbar mit Ausnahme des Alters: Die in den High-volume-Zentren behandelten waren deutlich jünger (63,1 vs. 68,2 Jahren; p < 0,01). Die Therapie in erfahrenen Händen lohnte sich: Diese Patienten überlebten ab Diagnose ihres Pankreastumors median 44 Monate, die von weniger erfahrenen Kollegen behandelten nur 28 Monate (p < 0,01); nach fünf Jahren waren in der ersten Gruppe noch 38,6%, in der zweiten 24,8% der Patienten am Leben (p < 0,01). Dies lag nicht am Altersunterschied zwischen beiden Kollektiven: Wenn dieser statistisch berücksichtigt wurde, änderte das am Ergebnis nichts.
Patienten mit Pankreaskarzinom, bei denen eine kurative Therapie denkbar erscheint, sollten also in High-volume-Zentren nicht nur operiert, sondern auf jeden Fall auch adjuvant behandelt werden, so Frau Mandelson.
Prodrug in Subgruppen wirksam?
Das Pankreaskarzinom ist nach wie vor eine der tragischsten Diagnosen in der Onkologie, wobei es beinahe egal ist, ob der Tumor im resektablen oder im metastasierten Stadium diagnostiziert wird. Trotz einiger Fortschritte in den letzten Jahren wird daher weiter fieberhaft nach besseren systemischen Therapien gesucht. Eine Option schien Evofosfamid zu sein, ein Prodrug von Bromo-Isophosphoramid-Mustard, das bevorzugt unter hypoxischen Bedingungen aktiviert wird, wie sie beim Pankreaskarzinom als negativer Prognosefaktor gelten. In einer randomisierten Phase-II-Studie konnte Evofosfamid in Kombination mit Gemcitabin beim fortgeschrittenen Pankreaskarzinom gegenüber der Gemcitabin-Monotherapie Ansprechen, progressionsfreies Überleben und biochemisches Ansprechen (CA 19-9) signifikant verbessern [4].
In der Phase-III-Studie MAESTRO konnte dieses Konzept allerdings nicht wirklich überzeugend bestätigt werden, so Eric van Cutsem, Leuven [5]: 693 Patienten mit fortgeschrittenem, nicht resezierbarem Pankreaskarzinom hatten hier randomisiert und doppelblind Gemcitabin (1.000 mg/m2 i. v.) alleine oder in Kombination mit 340 mg/m2 Evofosfamid oral erhalten (beide Medikamente an den Tagen 1, 8 und 15 eines vierwöchigen Zyklus bis zum Eintreten einer Krankheitsprogression). Die Patienten durften sechs Monate vor Einschluss in die Studie keine neoadjuvante oder adjuvante Chemotherapie erhalten haben. Primärer Endpunkt war das Gesamtüberleben, wo das statistische Design der Studie den Nachweis einer Überlegenheit des Verum-Arms mit einer Hazard Ratio von 0,75 nachweisen sollte. Das gelang nicht, so van Cutsem (Tab. 1):
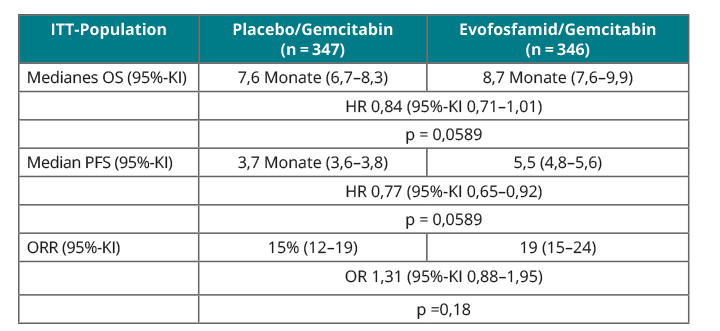
In der Intention-to-treat-Analyse war der Kombinations-Arm mit median 8,7 gegenüber 7,6 Monaten nur geringfügig und nicht signifikant überlegen (HR 0,84; p = 0,0589). Ähnliches galt für das progressionsfreie Überleben (median 5,5 vs. 3,7 Monate; HR 0,77; p = 0,0589) und die Gesamtansprechrate (19% vs. 15%; Odds Ratio 1,31; p = 0,18). Nebenwirkungen vom Grad 3 oder höher, die im Evofosfamid-Arm häufiger auftraten, waren v. a. hämatologischer Natur: Neutropenie (32,5% vs. 20,8%), Thrombozytopenie (31,7% vs. 5,6%) und Anämie (22,2% vs. 12,0%).
Obwohl der primäre Endpunkt verfehlt wurde, so van Cutsem, gibt es Hinweise auf ein positives Signal für eine Wirksamkeit von Evofosfamid: Möglicherweise gibt es eine Subgruppe von Patienten, die darauf ansprechen, und es ginge dann darum, diese Patienten anhand von biologischen Markern vorab zu identifizieren.
Rektumkarzinom
Neoadjuvante Radiochemotherapie: Weniger ist mehr
Die Standardbehandlung eines Rektumkarzinoms, das nicht metastasiert, aber wegen seiner Größe primär nicht operabel ist, besteht in einer simultanen Chemoradiotherapie mit fraktionierter Bestrahlung mit 50 Gy (28 Fraktionen) und einer 5-FU-Oxaliplation-Chemotherapie. In einer polnischen Phase-III-Studie wurde eine solche Behandlung bei Patienten mit Tumoren eines klinischen T3- oder T4-Stadiums randomisiert damit oder mit einer weniger aufwendigen Therapie behandelt, die aus fünfmal 5 Gy und eine Woche später der Gabe von drei Zyklen FOLFOX4 bestand. Wie Krzysztof Bujko, Warschau, berichtete [7], unterschieden sich die 261 Patienten in der experimentellen und die 254 in der Kontrollgruppe vor allem anhand der akuten Nebenwirkungen: Diese waren im experimentellen Arm mit 74% seltener (vs. 82%; p = 0,007); Toxizitäten vom Grad 3 oder höher waren mit 245 in beiden Armen gleich häufig. Was die Wirksamkeit anging, schien die kürzere Radiotherapie, gefolgt von der konsolidierenden Chemotherapie, tendenziell überlegen, auch wenn das keine statistische Signifikanz erreichte: Eine R0-Resektion (der primäre Endpunkt) wurde im experimentellen Arm bei 77%, im Kontrollarm bei 71% der Patienten erreicht (p = 0,081), eine Komplettremission fand der Pathologe bei 16% vs. 11,5% der Patienten vor (p = 0,19). Bei den 3-Jahres-Gesamtüberlebensraten erzielte die experimentelle Behandlung mit 73% vs. 64,5% beinahe einen signifikanten Vorteil (p = 0,055), während sich beim krankheitsfreien Überleben (53% vs. 52%; p = 0,74) und bei der kumulativen lokalen Rezidivrate (22% vs. 21%; p = 0,082) nach median
35 Monaten Nachbeobachtungszeit kein Unterschied zeigte.
Der Trend zu einem längeren Überleben, die geringere Toxizität und die mit dem knapperen Bestrahlungsplan verbundene Kosteneinsparung ebenso wie die größere Bequemlichkeit für den Patienten favorisieren eindeutig das Protokoll mit der nur fünfmaligen Bestrahlung und der konsolidierenden Chemotherapie, so Bujko.
Neuroendokrine Tumoren
Refraktär gegen Somatostatin-Analoga: Radiotherapeutikum hocheffektiv
Fortgeschrittene neuroendokrine Tumoren des Mitteldarms (midgut) werden in der Erstlinie mit Somatostatin-Analoga behandelt. Wenn sie darunter progredient sind, gibt es bisher nur sehr begrenzte Therapiemöglichkeiten. In der internationalen Phase-III-Studie NETTER-1, die Jonathan Strosberg, Tampa, in San Francisco vorstellte, wurde die Weiterbehandlung mit hochdosiertem Octreotid randomisiert mit einer neuen nuklearmedizinischen Option verglichen [8]: Die 230 Patienten mit metastasierten neuroendokrinen Dünndarmtumoren, die unter einer Standarddosierung der lang wirksamen Galenik von Octreotid (Octreotid LAR) von 20–30 mg alle drei bis vier Wochen progredient waren, erhielten im Kontrollarm 60 mg Octreotid LAR alle vier Wochen i. m., während sie im experimentellen Arm zur Symptomkontrolle 30 mg alle vier Wochen und zusätzlich viermal im Abstand von acht Wochen 177Lu-DOTA0-Tyr3-Octreotate in einer Dosierung von jeweils 29,6 GBq bekamen.
Primärer Endpunkt war das progressionsfreie Überleben, dessen Medianwert unter der nuklearmedizinischen Behandlung noch erreicht wurde, im Kontrollarm aber nur bei 8,4 Monaten lag. Das Risiko für Progression oder Tod wurde dadurch um beinahe 80% reduziert
(HR 0,21; p = 0,0001). Auch bei der Ansprechrate war das Radiopharmakon mit 18,8% versus 3,0% signifikant überlegen (p < 0,0004), und sogar die noch nicht wirklich ausgereiften Überlebensdaten suggerieren eine deutliche Überlegenheit mit 13 versus 22 Todesfällen (p < 0,019 bei der Interimsanalyse).
Josef Gulden
Literatur
1. Crosby T et al. Chemoradiotherapy with or without cetuximab in patients with oesophageal cancer (SCOPE1): a multicentre, phase 2/3 randomised trial. Lancet 2013; 14: 627-37.
2. Mukherjee S et al. Long term results and patterns of recurrence from SCOPE 1: A phase II/III randomised trial of definitive chemoradiotherapy (dCRT) plus or minus cetuximab (dCRT+C) in esophageal cancer. J Clin Oncol 2016; 34 (4S): (ASCO-GI 2016, Abstract #118).
3. Doi T et al. Updated results for the advanced esophageal carcinoma cohort of the phase Ib KEYNOTE-028 study of pembrolizumab (MK-3475). J Clin Oncol 2016; 34 (4S): (ASCO-GI 2016, Abstract #7).
4. Borad MJ et al. Randomized Phase II Trial of Gemcitabine Plus TH-302 Versus Gemcitabine in Patients With Advanced Pancreatic Cancer. J Clin Oncol 2015; 33: 1475-81.
5. van Cutsem E et al. Evofosfamide (TH-302) in combination with gemcitabine in previously untreated patients with metastatic or locally advanced unresectable pancreatic ductal adenocarcinoma: Primary analysis of the randomized, double-blind phase III MAESTRO study. J Clin Oncol 2016; 34 (4S): (ASCO-GI 2016, Abstract #193).
6. Mandelson MT et al. Resected pancreatic cancer (PC): Impact of adjuvant therapy (Rx) at a high-volume center (HVC) on overall survival (OS). J Clin Oncol 2016; 34 (4S): (ASCO-GI 2016, Abstract #191).
7. Bujko K et al. Neoadjuvant chemoradiation for fixed cT3 or cT4 rectal cancer: Results of a Polish II multicentre phase III study. J Clin Oncol 2016; 34 (4S): (ASCO-GI 2016, Abstract #489).
8. Strosberg JR et al. NETTER-1 phase III: Progression-free survival, radiographic response, and preliminary overall survival results in patients with midgut neuroendocrine tumors treated with 177-Lu-Dotatate. J Clin Oncol 2016; 34 (4S): (ASCO-GI 2016, Abstract #194).

