Krebserkrankungen und Thrombose
Diagnostik in der Onkologie
Eine Tumorerkrankung stellt für die Betroffenen eine schwere Bedrohung dar. Venöse Thromboembolien (TE) ohne erkennbare Ursache können auf eine okkulte Krebserkrankung hinweisen. Aber auch viele Tumorerkrankungen zeigen per se eine erhöhte Gerinnungsaktivierung und können eine TE auslösen. Neben der üblichen Anti-Tumor-Therapie ist daher bei manchen Tumorpatienten, die oft diverse Risikofaktoren für eine TE aufweisen, ein medikamentöser Thromboembolie-Schutz erforderlich.
Eine venöse Thromboembolie (VTE), insbesondere tiefe Venenthrombosen oder Lungenembolien, sind eine gerade bei Älteren häufige Herz-Kreislauf-Erkrankung. Verletzungen oder Operationen, zentralvenöse Verweilkatheter, eine längere Immobilität des Patienten und andere Einflussgrößen, ggf. in Verbindung mit kongenitalen Risikofaktoren, können der Trigger sein. Häufig bleibt aber die Ursache unklar. Allerdings wird innerhalb eines Jahres nach einer VTE bei bis zu 10% der Patienten eine Krebserkrankung diagnostiziert. Daher erfolgt nach einer VTE ohne erkennbare Ursache oft eine Suche nach okkulten Tumoren. Ob das sinnvoll und kosteneffektiv ist, bleibt aber umstritten.
Bei Tumorpatienten andererseits findet man häufig thromboembolische Ereignisse, insbesondere bei Pankreas-, Magen- und Hirntumoren, gefolgt von Ovarial-, Lungen- und Kolonkarzinomen sowie hämatologischen Neoplasien. Auch arterielle Verschlüsse treten bei Krebspatienten häufiger auf, bis hin zu Myokardinfarkten oder Schlaganfällen. Die Inzidenz einer VTE bei Tumorpatienten liegt je nach Art der Erkrankung, Behandlung und anderen Risiken zwischen 0,5% und über 20%. In der Vienna Cancer and Thrombosis Study (CATS) wurde eine kumulative Wahrscheinlichkeit für das Auftreten einer klinisch manifesten VTE bei Krebspatienten innerhalb eines Jahres von 7–8% gefunden [1]. Rezidive sind häufig; das Auftreten einer VTE beeinflusst den Verlauf einer Krebserkrankung negativ, d. h. man findet ein etwa dreifach erhöhtes Mortalitätsrisiko.
Ursachen für eine Thromboembolie bei Tumoren
Maligne Geschwülste können überall im Körper Metastasen bilden, auf die der Organismus u. a. mit einer massiven inflammatorischen Reaktion und Veränderungen des Komplementsystems und der Hämostase reagiert. Verschiedene Proteine dieser Systeme zeigen eine Akute-Phasen-Reaktion. Oft steigt die Zahl der Plättchen und es verändert sich deren Funktion. An der Oberfläche von Tumorgewebe läuft der Kampf mit den Abwehrzellen des Körpers. Aus Tumorzellen und der geschädigten Gefäßwand in der Umgebung sowie aus aktivierten Monozyten kommen verschiedene Substanzen in direkten Kontakt mit Blut (Abb. 1), darunter Tissue-Factor (TF), der wichtigste physiologische Aktivator der Gerinnung, aber auch ein Protein mit vielen anderen Funktionen, z. B. in der Angiogenese und der Regulation der Apoptose. TF wird von den meisten Tumorzellen auf der Oberfläche exprimiert. Mikropartikel, kernlose, subzelluläre Membranvesikel mit einem Durchmesser von < 1 μm, die von der Oberflächenmembran vieler Tumorzellen abgeschnürt werden, sind ebenfalls reich an TF. Die bei der Entzündungsreaktion freigesetzten neutrophilen Netze (NETs) mit Histonen und DNA aus dem Chromatin von Neutrophilen aktivieren und verstärken die Gerinnung, u. a. über eine Anheftung von Fibrin, Thrombozyten und von Willebrand-Faktor.
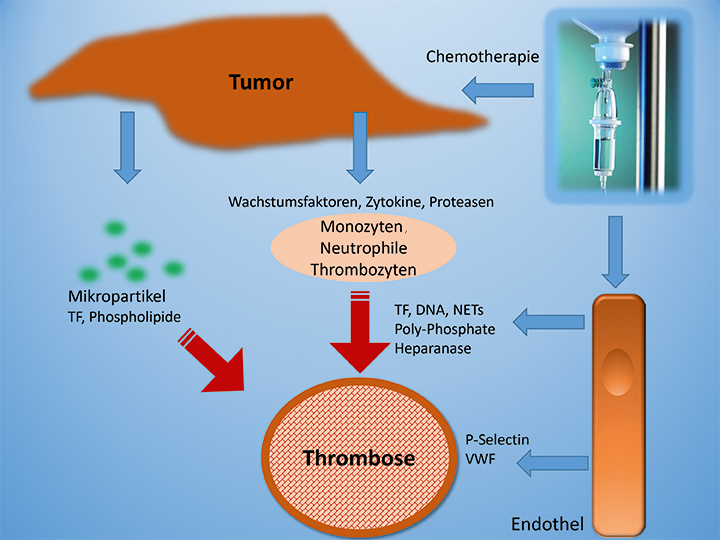
Der venöse Blutstrom kann durch Tumorinfiltration oder externe Kompression größerer Gefäße, Metastasen sowie durch zentrale Venen-Verweilkatheter gestört sein, was die Entstehung von Gerinnseln begünstigt. Chirurgische Eingriffe, Bestrahlungen oder Chemotherapie setzen gerinnungsaktive Substanzen frei und können das Gefäßendothel schädigen. Aus zerstörten Zellen und Plättchen freigesetzte Polyphosphate und möglicherweise auch zellfreie DNA aktivieren die Gerinnung über Faktor XII, also den „endogenen“ Weg, und sorgen so für eine verstärkte Thrombin-Bildung. Aus Plättchen freigesetzte Polyphosphate verstärken auch die Resistenz eines Fibrin-Gerinnsels gegenüber dem körpereigenen Fibrinolyse-System.
Manche Tumoren bilden Proteasen, die direkt die Gerinnung aktivieren, z. B. die Faktor X aktivierende Cystein-Protease Cancer Procoagulant, die bei Erwachsenen ausschließlich in Tumorgewebe nachweisbar ist. In Tumorgeweben und Blutzellen von Tumorpatienten findet man eine gesteigerte Expression des „Fibrinogen-Like Protein 2“
(FGL-2). Diese membranständige Prothrombinase kann direkt Thrombin bilden. Neben vielfältigen Funktionen in der innaten Immunabwehr, in der Regulation der Angiogenese und bei der Ausbreitung von Tumoren kann FGL-2 daher lokal indirekt Fibrin erzeugen und Plättchen, Monozyten, Endothel und andere Gerinnungsfaktoren aktivieren. Tumorpatienten zeigen daher oft Zeichen einer disseminierten intravasalen Gerinnung (DIG) mit oder ohne Verbrauchs-Koagulopathie, und auch eine hämolytische thrombotische Mikroangiopathie (TMA) kann auftreten.
Tumor-, aber auch Entzündungs- und Immunzellen aus dem Blut müssen im Entzündungsgebiet die Basalmembranen überwinden. Dabei ist das Enzym Heparanase, das von Leukozyten, Thrombozyten und vielen Tumorzellen exprimiert wird, von entscheidender Bedeutung. Heparanase spaltet Heparansulfat-Ketten von Proteoglykanen auf Zelloberflächen, der Basalmembran sowie der extrazellulären Matrix und ermöglicht so den Durchgang verschiedener Zellen durch die Basalmembran und fördert so auch die Metastasierung. Außerdem induziert Heparanase die Freisetzung angiogener Faktoren. Heparanase wirkt aber auch direkt prokoagulatorisch. Es fördert die Biosynthese und Aktivität von TF und stört auf Zelloberflächen die Inhibition von Faktor VIIa und Faktor Xa durch den Tissue Factor Pathway Inhibitor (TFPI), einen der wichtigsten Inhibitoren der Gerinnung. Eine starke Expression von Heparanase durch Tumorzellen kann bei einigen Karzinomen ein prognostischer Marker sein. Heparanase ist ein potenzielles Ziel für eine Anti-Tumor-Therapie, denn durch medikamentöse Inhibition lassen sich Entzündungsreaktionen und die Invasion und Metastasierung von Tumoren hemmen.
Labordiagnostik von Gerinnungsstörungen bei Tumorpatienten
Tumorpatienten mit dem in Europa weit verbreiteten Faktor-V-Leiden-Polymorphismus haben ein doppelt so hohes VTE-Risiko wie bei einem normalen Faktor-V-Status [2]. Neben den üblichen labordiagnostischen Verfahren hat sich bei Tumoren insbesondere die Bestimmung von D-Dimer (Fibrin-Spaltprodukt, Marker für Fibrin-Bildung und dessen Lyse) bewährt, daneben auch die von P-Selectin, der löslichen Form eines Adhäsionsproteins von Plättchen und anderen Zellen.
D-Dimer–haltige Fibrin-Fragmente werden auch von Leukozyten-Proteasen wie Elastase erzeugt. Sie werden in den üblichen D-Dimer-Tests mehr oder weniger miterfasst. Erhöhte D-Dimer-, aber auch Faktor-VIII-Werte sind prognostisch ungünstig. Bei der Interpretation der Werte ist die vielfach beschriebene Altersabhängigkeit von
D-Dimer zu beachten. Sehr hohe
D-Dimer-Spiegel findet man beim Lungenkrebs. D-Dimer und p-Selectin werden zusammen mit klinischen Parametern zur Risikostratifizierung von stationären und ambulanten Patienten eingesetzt, z. B. beim Vienna-Score,
einer Weiterentwicklung des Khorana-Scores. Er nutzt klinische Parameter wie die Art und Lokalisation des Krebses, den Body-Mass-Index (BMI), Blutbild und zusätzlich noch D-Dimer und
P-Selectin.
Bei Tumorpatienten beobachtet man mit Thrombin-Generierungstests eine gesteigerte Thrombin-Bildung. Diese Patienten weisen ein massiv gesteigertes VTE-Risiko auf [1]. Auch das Prothrombin-Aktivierungspeptid F1+2, Fibrin-Monomere, Thrombin-Antithrombin-Komplexe (TAT) und Mikropartikel sind oft erhöht. Die Messung von Mikropartikeln ist allerdings (mit Ausnahme eines automatisierten funktionellen Tests) präanalytisch schwierig und wenig standardisiert. Bei Patienten mit Zeichen einer DIG sollte der Fibrinogen-Spiegel, der oft recht tiefe Faktor XIII sowie das α-2-Antiplasmin kontrolliert werden, da gegebenenfalls eine Intervention z. B. mit Antifibrinolytika nötig sein könnte. Eine Messung der Plättchen-Funktion bei niedrigen Thrombozyten-Zahlen (z. B. bei Chemotherapie) ist schwierig. Sie kann aber zusammen mit dem Fibrinogen-Spiegel oder einer Thromboelastometrie-Messung und dem Hämatokrit herangezogen werden, wenn über eine Gabe von Thrombozyten-Konzentraten zu entscheiden ist. Ein gesteigertes mittleres Plättchen-Volumen (MPV) ist prognostisch günstig [3]. Hingegen sind hohe Thrombozyten- oder Leukozyten-Zahlen, wie sie bei einigen Patienten als Folge des Tumors auftreten, eher als Risiko für eine VTE zu werten.
Bei der Überwachung der Antikoagulation der Patienten mit niedermolekularen Heparinen (NMH) ist eine Bestimmung der anti-Faktor-Xa-Aktivität sinnvoll, insbesondere bei einer Dosissteigerung nach Rezidiven und bei Patienten mit eingeschränkter Nierenfunktion. Bei Heparin-Gabe (auch bei NMH!) muss an die Möglichkeit einer Heparin-induzierten Thrombozytopenie (HIT) gedacht werden, was eine laufende Kontrolle der Plättchenzahlen (gefährlich ist mehr das Ausmaß des Abfalls als die absolute Zahl) und gegebenenfalls einen raschen Test auf HIT-Antikörper erfordert. Nach Operationen ist dabei nach einem anfänglichen Abfall der nach einigen Tagen einsetzende Anstieg der Plättchen zu beachten. Bei Asparaginase-Therapie kann es zu einem Mangel an Antithrombin (ATIII) kommen, was die Wirksamkeit einer Therapie mit Heparinen bzw. Fondaparinux einschränkt.
Gerinnungshemmung bei Tumorpatienten
Die Fibrin-Bildung an der Oberfläche von Tumorzellen schirmt diese zu einem gewissen Maß vor Angriffen der körpereigenen Immunzellen ab. Daher ist unabhängig vom Risiko einer akuten VTE eine Verhinderung einer übermäßigen Fibrin-Bildung sinnvoll. Die Behandlung und Prophylaxe von thromboembolischen Ereignissen erfolgt bei Tumorpatienten bei einer Tumor-assoziierten VTE am häufigsten mit niedermolekularen Heparinen (NMH) oder Fondaparinux, seltener mit unfraktioniertem Heparin (UFH). NMH und Fondaparinux haben gegenüber Vitamin-K-Antagonisten hinsichtlich Thromboseschutz und Blutungsrisiko Vorteile und sind im Vergleich zu UFH einfacher anzuwenden. Die Plättchenzahl ist unbedingt zu berücksichtigen. In Studien zeigten verschiedene NMH-Präparate eine Reduktion von VTE bei Tumorpatienten, allerdings keine Verlängerung der Lebenserwartung.
Mit direkten oralen Antikoagulanzien (DOAC) hat man bisher noch nicht viele Erfahrungen bei Tumorpatienten. Eine primäre Thromboseprophylaxe mit NMH über einige Wochen wird nach größeren Eingriffen häufig postoperativ eingesetzt. Die Dauer hängt von der Art des Tumors ab. Der Nutzen einer generellen Thromboseprophylaxe bei hospitalisierten onkologischen Patienten und besonders auch bei ambulanten onkologischen Patienten mit Chemotherapie wird kontrovers diskutiert. Nur bei erhöhtem Thromboserisiko findet auch präventiv eine Low-Dose-Prophylaxe mit Aspirin statt.
Einige Bestandteile von Heparinen hemmen Heparanase, was eine antimetastatische Aktivität von Heparinen mit erklärt. Eine Blockade von Zelladhäsions-Molekülen durch Heparin stört die Wechselwirkung von Tumorzellen mit Thrombozyten, Leukozyten und Endothelzellen und senkt vermutlich die Metastasierungsrate. Die Hemmung von Thrombin beeinflusst wahrscheinlich Thrombin-induzierte Signalkaskaden, was unter anderem die Angiogenese beeinträchtigt. Eine durch Heparin gesteigerte TFPI-Freisetzung (und damit eine Hemmung der gesamten Gerinnungskaskade) geht mit einer verminderten Gefäßneubildung einher. Solche Wirkungen hängen von der Kettenlänge der Heparine und der generellen Zusammensetzung ab, denn Heparin ist ja ein komplexes Stoffgemisch.
Ausblick
Rasante Fortschritte in der komplexen Biologie der Tumorerkrankungen lassen erhoffen, dass man auch die Begleiterscheinungen wie Gerinnungsstörungen besser versteht und sie besser, vielleicht auch individueller therapieren kann. Die Grundlagenforschung zeigt, dass viele der komplexen Interaktionen auch nicht eindeutig der Gerinnung zugeordnet werden können, sodass eine Therapie der Gerinnungsstörung manchmal gleichzeitig eine Anti-Tumor-Therapie ist und umgekehrt. Potenzielle neue pharmakologische Ziele wie Polyphosphate, DNA oder Heparanase sind daher sowohl unter dem Aspekt der Hämostase wie auch einer möglichen Antitumorwirkung zu betrachten.
Literatur
1. Ay C et al. Prediction of venous thromboembolism in patients with cancer by measuring thrombin generation: results from the Vienna Cancer and Thrombosis Study. J Clin Oncol 2011; 29: 2099-103.
2. Pabinger J et al. Factor V Leiden mutation increases the risk for venous thromboembolism in cancer patients - results from the Vienna Cancer And Thrombosis Study (CATS). J Thromb Haemost 2015; 13: 17-22.
3. Riedl J et al. Association of mean platelet volume with risk of venous thromboembolism and mortality in patients with cancer. Results from the Vienna Cancer and Thrombosis Study (CATS). Thromb Haemost 2014; 111: 670-8.

Dr. Hans-Jürgen Kolde
Consulting Diagnostics,
Medical Technology, Life Sciences
In der Au 16
82229 Seefeld-Hechendorf
+ 49 8152 999 2779
h.-j.kolde[at]t-online[dot]de

