Eisenüberladung bei myelodysplastischem Syndrom
Kasuistik
Fall
Bei dem 62-jährigen Patienten wurde Anfang 2005 zur Abklärung einer unklaren Bi-Zytopenie (Hb 9,2 g/dl, Leukozyten 2.500/µl, Thrombozyten 460.000/µl) eine Knochenmark-Punktion durchgeführt. In der Zytologie ergab sich eine refraktäre Anämie mit Ringsideroblasten (RARS nach FAB- und WHO-Klassifikation), zytogenetisch fiel eine 20q-Deletion auf, die eine gute prognostische Bedeutung hat. In der Histologie zeigte sich keine Knochenmark-Fibrose, sodass ein myelodysplastisches Syndrom (MDS) diagnostiziert wurde. An Begleiterkrankungen waren eine koronare Herzerkrankung (NYHA II), eine chronische Niereninsuffizienz, eine chronisch-obstruktive Lungenerkrankung bei Nikotinabusus, Übergewicht mit einem Body-Mass-Index von 35 und eine tiefe Beinvenenthrombose im Jahr 2003 bekannt.
Ab März 2005 fühlte sich der Patient durch seine symptomatische Anämie mit Luftnot, Schwäche und Schwindel bei seiner Arbeit als selbständiger Inhaber und Leiter eines Restaurants stark beeinträchtigt, sodass mit der Transfusion von zwei Erythrozytenkonzentraten alle vier Wochen begonnen wurde. Der Versuch einer Behandlung mit Erythropoetin blieb erfolglos.
Verlauf
Unter der Transfusionstherapie stieg das Serum-Ferritin von anfänglich unter 500 µg/l bis Juni 2006 auf mehr als 2.000 µg/l an, sodass ein Behandlungsversuch mit dem Chelator Deferoxamin (40 mg/kg und Tag s. c. mit einer Pumpe verabreicht) unternommen wurde. Der Versuch war nicht erfolgreich, auch weil der Patient die umständliche Applikationsweise nicht akzeptierte; das Serum-Ferritin stieg auf über 3.000 µg/l an, wo es bis Anfang 2010 blieb. Als der Patient sich zu dieser Zeit mit passabler Nierenfunktion (GFR 64 ml/min, Serum-Kreatinin 1,13 mg/dl) in unserer Klinik vorstellte, wurde mit einer Deferasirox-Chelationstherapie (Startdosis 20 mg/kg und Tag bei morgendlicher Einnahme) begonnen.
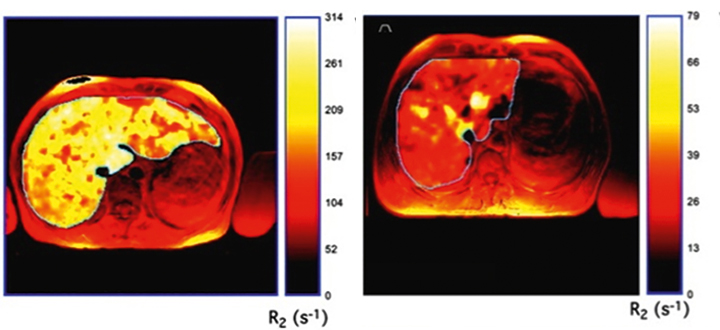
Die Folge war ein starker Durchfall, der schlagartig etwa zwei Stunden nach der Einnahme begann und sieben- bis achtmal pro Tag auftrat, begleitet von einem Anstieg des Serum-Kreatinins auf 1,65 mg/dl. Weil ihn das verständlicherweise bei seiner Arbeit im Restaurant stark beeinträchtigte, bat der Patient dringend um einen Abbruch dieser Therapie. Nach einer Unterbrechung und unter der Gabe von Loperamid für wenige Tage sistierten die Durchfälle, bei ausreichender Flüssigkeitszufuhr normalisierte sich das Serum-Kreatinin, und die glomeruläre Filtrationsrate lag über 60 ml/min. Die Deferasirox-Therapie wurde daraufhin mit einer initialen Dosis von nur 10 mg/kg wieder begonnen und langsam in Schritten von 5 mg/kg auf 20 mg/kg und Tag gesteigert. Außerdem wurde dem Patienten empfohlen, das Medikament abends einzunehmen, weil das nächtliche Auftreten der Nebenwirkungen seinen Tagesablauf weniger stören würde. Unter dieser Behandlung konnte der Serum-Ferritin-Wert von etwa 3.000 µg/l innerhalb von knapp zwei Jahren auf etwas über 2.000 µg/l gesenkt werden. Insbesondere war in der Kernspintomografie zwischen März und August 2010 eine Abnahme der Leber-Eisenkonzentration von 15,3 auf 9,4 mg/g Trockengewicht nachweisbar (Abb. 1). Der Patient, der anfänglich zwei Erythrozytenkonzentrate alle vier Wochen benötigte, kam zu diesem Zeitpunkt mit zwei Konzentraten alle acht bis zehn Wochen aus.
Diskussion
Ein MDS ist eine erworbene klonale Knochenmark-Erkrankung, die meist im höheren Alter auftritt, durch insuffiziente Hämatopoese charakterisiert ist, in der Regel mit einer Anämie, aber häufig auch mit anderen Zytopenien einhergeht, eine Dysplasie in mindestens einer hämatopoetischen Zelllinie sowie eine Tendenz zur leukämischen Transformation aufweist [1]. Die Inzidenz steigt – u. a. wegen der höheren Lebenserwartung der Bevölkerung. Seit einigen Jahren gibt es eine ganze Reihe therapeutischer Optionen, deren Auswahl durch die Prognose anhand des International Prognostic Scoring System (IPSS; [2]) oder des „WHO classification-based prognostic scoring system“ [3] bestimmt wird. Unser Patient hatte aufgrund des Vorliegens von Zytopenien in zwei Zelllinien, eines günstigen Karyotyps und fehlender Blasten im Knochenmark einen IPSS von Intermediär-1. Laut DGHO-Leitlinie [4] gibt es hier lediglich für Patienten mit 5q-Deletion, die in unserem Fall nicht vorlag, eine zugelassene kausale Therapie (Lenalidomid). Erythropoetin und Valproinsäure werden off-label eingesetzt, ersteres war bei unserem Patienten erfolglos versucht worden. Ebenfalls zugelassen und empfohlen ist für Patienten, die regelmäßige Erythrozyten-Transfusionen erhalten, eine Eisenchelation. Diese supportivtherapeutische Maßnahme sollte vor allem bei niedrigem Risiko frühzeitig in das Gesamt-Therapiekonzept integriert werden, weil diese Patienten meist noch eine lange Lebenserwartung haben und durch überschüssiges Eisen verursachte Organtoxizitäten bei ihnen deshalb besondere Bedeutung haben.
Die Zufuhr von Eisen beträgt bei einem polytransfundierten Patienten bis zu 15.000 mg pro Jahr, die natürliche Ausscheidung dagegen lediglich 400–500 mg pro Jahr. Eine solche Eisenüberladung wirkt sich auf viele Organsysteme, vor allem auf Herz, Leber und endokrine Organe aus und schädigt deren Funktion. Dass eine Eisenchelation bei Patienten mit niedrigem oder Intermediär-1-Risiko nach IPSS ein unabhängiger Prognosefaktor ist, konnte in einer französischen Studie mit knapp hundert Patienten mit hoher statistischer Signifikanz nachgewiesen werden, wo sich die Gesamtüberlebensdauer unter einer Chelationstherapie von Median 51 auf 115 Monate mehr als verdoppelte (p < 0,0001; [5]).
Bestimmt wird die Eisenbelastung durch den Serum-Ferritin-Wert. In einer Registerstudie des European LeukemiaNet mit über tausend Patienten mit einem neu diagnostizierten MDS war eine Transfusionsabhängigkeit der wichtigste prognostische Faktor für das Gesamtüberleben [6]: Patienten mit 1.000 µg/l Ferritin oder mehr hatten ein beinahe vierfach höheres Mortalitätsrisiko als diejenigen mit Werten unter 300 µg/l. Der Serum-Ferritinwert ist ein indirekter Marker, der auch aus anderen Gründen, vor allem durch Entzündungen, ansteigen kann. Deshalb bemühen wir uns, die Eisenbelastung in der Leber direkt zu messen, wie das heute mittels spezieller kernspintomografischer Verfahren routinemäßig möglich ist (Abb. 1). In absehbarer Zeit wird sich wohl auch die kardiale Eisenbelastung in ähnlicher Weise zuverlässig bestimmen lassen.
Zur Eisenchelation gibt es mehrere Möglichkeiten: Deferoxamin (Desferal®) muss mittels einer Pumpe kontinuierlich subkutan appliziert werden, was von den meisten Patienten als sehr belastend empfunden wird. Unser Patient wurde anfänglich damit behandelt und war nach kurzer Zeit nicht mehr bereit, diese Therapie durchzuführen. Die Einnahme von Deferasirox (Exjade®) ist einfacher, führt aber regelmäßig vor allem zu Durchfällen, die ebenfalls ein Problem darstellen können. Angesichts der Bedeutung der Eisenchelation für die Prognose des transfusionsabhängigen Patienten ist ein sorgfältiges Nebenwirkungsmanagement hier besonders wichtig: Durch eine eventuelle Unterbrechung der Einnahme und die Gabe von Medikamenten wie Loperamid kann man die Durchfälle meist rasch stoppen. In der aktualisierten europäischen Leitlinie [7] wird mittlerweile empfohlen, grundsätzlich mit 500 mg/d anzufangen, die man schrittweise um je
5 mg/kg pro Woche erhöht, bis die angestrebte Zieldosis erreicht ist, die von der Transfusionsbelastung abhängt. In mehreren umfangreichen Studien konnte durch eine effektive Eisenchelation mit Deferasirox außerdem eine Verbesserung der Hämatopoese in allen drei Zellreihen bei bis zu 20% der Patienten erreicht werden [8–10].
Literatur
1. Haferlach T (Hrsg.). Myelodysplastische Syndrome von A bis Z. Stuttgart 2014.
2. Greenberg et al. International scoring system for evaluating prognosis in myelodysplastic syndromes. Blood 1997; 89: 2079-88.
3. Malcovati et al. Time-dependent prognostic scoring system for predicting survival and leukemic evolution in myelodysplastic syndromes. J Clin Oncol 2007; 25: 3503-10.
4. Hofmann WK et al. Myelodysplastische Syndrome (MDS). Onkopedia-Leitlinie [https://www.onkopedia.com/de/onkopedia/guidelines/myelodysplastische-syndrome-mds/@@view/html/index.html].
5. Rose C et al. Does iron chelation therapy improve survival in regularly transfused lower risk MDS patients? A multicenter study by the GFM (Groupe Francophone des Myélodysplasies). Leuk Res 2010; 34: 864-70.
6. de Swart L et al. Transfusion-dependency ist he most important prognostic factor for survival in 1000 newly diagnosed MDS patients with low- and intermediate-1 risk MDS in the European LeukemiaNet MDS registry. Blood 2011; 118(21): 1195-6 (ASH 2011, Abstract #2775).
7. Nolte F et al. Updated recommendations on the management of gastrointestinal disturbances during iron chelation therapy with deferasirox in transfusion dependent patients with myelodysplastic syndrome – emphasis on optimized dosing schedules and new formulations. Leuk Res 2015; 39: 1028-33.
8. Gattermann N et al. Hematologic responses to deferasirox therapy in transfusion-dependent patients with myelodysplastic syndromes. Haematologica 2012; 97: 1364-71.
9. Angelucci E et al. Deferasirox chelation therapy in transfusion dependent MDS patients. Final report from the Gimema MDS0306 prospective trial. Blood 2012; 120 (ASH 2012, Abstract #425).
10. List AF et al. Deferasirox reduces serum ferritin and labile plasma iron in RBC transfusion-dependent patients with myelodysplastic syndrome. J Clin Oncol 2012; 30: 2134-9.
Prof. Dr. Wolf-Karsten Hofmann
III. Medizinische Klinik (Hämatologie und Onkologie)
Universitätsmedizin Mannheim
Theodor-Kutzer-Ufer 1–3, 68167 Mannheim

