Integrierte histologische und molekulare Diagnostik von Gliomen
Bastian Malzkorn, Jörg Felsberg, Guido Reifenberger
Die neuropathologische Diagnostik von Gliomen erfolgt bis dato lichtmikroskopisch gemäß der Klassifikation der Weltgesundheitsorganisation (World Health Organization, WHO) für die Tumoren des zentralen Nervensystems [1]. Hiernach werden die Gliome in verschiedene astrozytäre, oligodendrogliale und ependymale Tumorentitäten sowie unterschiedliche Malignitätsgrade (WHO-Grade I–IV) eingeteilt. Die histologische Typisierung und Gradierung von Gliomen kann allerdings im Einzelfall schwierig sein – zum Beispiel wenn die Diagnose anhand von nur sehr kleinen Biopsieproben gestellt werden muss oder wenn sich mikroskopisch nicht eindeutig richtungsweisende Differenzierungsmerkmale nachweisen lassen. Außerdem können Patienten trotz gleicher histologischer Diagnose sehr heterogene Krankheitsverläufe zeigen und unterschiedlich auf die Therapie ansprechen. Dies lässt vermuten, dass die in der WHO-Klassifikation definierten Gliom-Entitäten jeweils aus biologisch unterschiedlichen Subgruppen bestehen; eine Hypothese, die in umfangreichen molekularen Analysen inzwischen für verschiedene Gliome einschließlich des Glioblastoms eindeutig belegt werden konnte [2]. Ergänzend zur histologischen Tumordiagnose hat daher die Bestimmung molekularer Biomarker zunehmend an Bedeutung gewonnen [3]. Zu unterscheiden sind dabei diagnostische Biomarker zur Präzisierung der Tumorklassifikation, prognostische Biomarker zur besseren Vorhersage der individuellen Prognose und prädiktive Biomarker, die das Ansprechen auf eine bestimmte Therapie vorhersagen. Außerdem wurden neue Methoden entwickelt, die mittels Mikroarray-Technologie oder Hochdurchsatz-Sequenzierung die gleichzeitige Analyse zahlreicher Marker bzw. die Bestimmung diagnostischer Gensignaturen erlauben. Wir geben hier einen kurzen Überblick über diese aktuellen Entwicklungen und das Konzept der Integration von histologischen und molekularen Befunden, das in der neuen WHO-Klassifikation 2016 verfolgt werden wird [4].
Biomarker-basierte molekulare Klassifikation von Gliomen
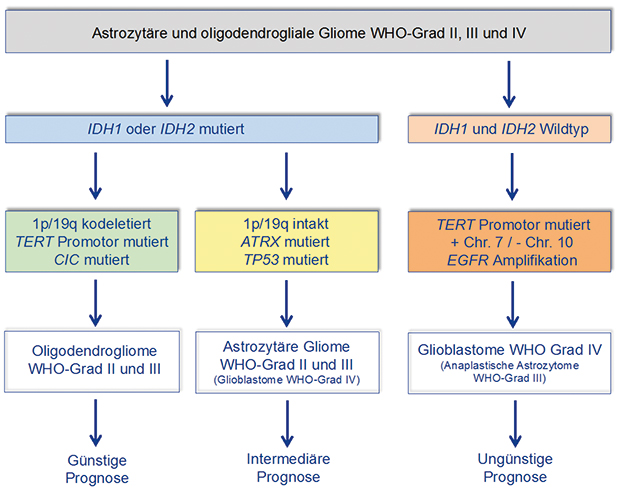
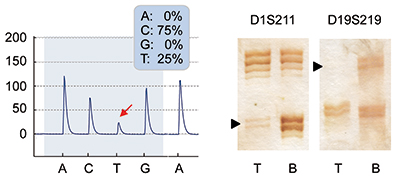
Abb. 1 gibt einen Überblick über den aktuellen Stand der molekularen Stratifizierung von astrozytären und oligodendroglialen Gliomen der WHO-Grade II–IV. Hiernach werden diese Tumoren primär anhand von Mutationen in den Genen für Isocitratdehydrogenase 1 oder 2 (IDH1, IDH2) in IDH-mutierte und IDH-Wildtyp- (nicht-mutierte) Gliome differenziert. Die IDH-mutierten Gliome werden dann in zwei Gruppen unterteilt: (1) oligodendrogliale Tumoren (WHO- Grad II oder III) mit Kodeletion der Chromosomenarme 1p und 19q (Abb. 2) sowie Mutationen im TERT-Promotor und (2) astrozytäre Tumoren (WHO-Grad II und III), die keine 1p/19q-Kodeletion, dagegen aber Mutationen in den Genen ATRX und TP53 aufweisen [5]. IDH-mutierte Glioblastome (WHO-Grad IV) sind insgesamt selten (< 10% aller Glioblastome) und finden sich gehäuft bei jüngeren Erwachsenen und bei Patienten mit sekundären Glioblastomen, die sich aus einem vorbestehenden niedriggradigen Astrozytom entwickelt haben. Die meisten Glioblastome entstehen aber de novo mit kurzer Anamnese (primäre Glioblastome) und zeigen keine IDH-Mutationen. Sie machen die Mehrheit der IDH-Wildtyp-Gliome aus und sind molekulargenetisch typischerweise durch Gewinne auf Chromosom 7, Verluste von Chromosom 10, TERT-Promotor-Mutationen und Amplifikationen verschiedener Proto-Onkogene gekennzeichnet, darunter am häufigsten des Gens für den epidermalen Wachstumsfaktorrezeptor (EGFR, [2]). Die Prognose von Patienten mit diffusen Gliomen der WHO-Grade II und III ist eng mit der o. g. genetischen Einteilung verbunden, d. h. Patienten mit IDH-mutierten und 1p/19q-kodeletierten oligodendroglialen Tumoren zeigen einen günstigeren Verlauf als Patienten mit IDH-mutierten astrozytären Gliomen [5]. Die Prognose für Patienten mit einem IDH-Wildtyp-Glioblastom ist mit einer medianen Überlebenszeit von 14–16 Monaten nach wie vor ungünstig [6].
- Unter den IDH-Wildtyp Glioblastomen gibt es eine vorwiegend bei Kindern und Jugendlichen auftretende Gruppe von Tumoren mit Mutationen im H3F3A-Gen, das für das Histon H3.3 kodiert [7–9]. Diese umfassen zwei funktionell relevante Hotspot-Mutationen, K27M und G34R/V, wobei H3.3-K27M-mutierte Gliome hauptsächlich in Mittellinien-nahen Strukturen, d. h. Thalamus, Brücke (diffuse intrinsische Pons-Gliome) und Rückenmark, vorkommen und mit einer ungünstigen Prognose einhergehen.
- Von den o. g. das Hirngewebe diffus infiltrierenden, mehrheitlich höhergradigen Gliomen sind die niedrigradigen Gliome mit umschriebenem Wachstum abzugrenzen, die typischerweise bei Kindern und Jugendlichen auftreten und eine günstige Prognose nach Tumorresektion zeigen. Zu dieser Gruppe gehört mit dem pilozytischen Astrozytom (WHO-Grad I) der häufigste ZNS-Tumor des Kindesalters. Das Wachstum dieser Tumoren beruht auf einer überschießenden Aktivierung des Mitogen-aktivierten Kinase-Signalweges, die am häufigsten durch Genduplikationen und Fusionen des BRAF-Gens, seltener durch eine aktivierende BRAF-V600E-Mutation oder Veränderungen in anderen Genen dieses Signalweges bedingt ist [10]. BRAF-V600E-Mutationen finden sich auch in bis zu 70% der pleomorphen Xanthoastrozytome, hier häufig kombiniert mit homozygotem Verlust des CDKN2A-Tumorsuppressorgens [11], und ca. 30% der Gangliogliome [12]. Die mit der autosomal dominant erblichen tuberösen Sklerose (TSC) assoziierten subependymalen Riesenzellastrozytome (WHO-Grad I) sind durch Mutationen in den Genen TSC1 oder TSC2 gekennzeichnet, die zu einer aberranten Aktivierung des mTOR-Signalweges führen [13].
- Ependymale Tumoren lassen sich anhand ihrer DNA-Methylierungsprofile in neun verschiedene Subgruppen einteilen, davon jeweils drei in spinalen, infratentoriellen und supratentoriellen Tumoren [14]. Durch spezifische genetische Mutationen sind allerdings bislang nur drei dieser Subgruppen definiert. Dies sind Mutationen des Gens für die Neurofibromatose 2 (NF2) in spinalen intramedullären Ependymomen sowie spezifische Genfusionen der Gene RELA oder YAP1 in supratentoriellen Ependymomen [14]. Supratentorielle Ependymome mit RELA-Fusion zeichnen sich klinisch durch eine ungünstige Prognose aus.
Prädiktive Biomarker für Gliome
Aktuell gibt es zwei Biomarker mit prädiktiver klinischer Bedeutung in malignen Gliomen. Dies sind der Nachweis einer Methylierung des Promotors des Gens für die O6-Methylguanin-DNA-Methyltransferase (MGMT) in Glioblastomen und von 1p/19q-Kodeletionen in anaplastischen Gliomen [15]. MGMT ist ein DNA-Reparaturenzym, das die Wirkung einer alkylierenden Chemotherapie mit DNA-Alkylanzien wie Nitrosoharnstoffen und Temozolomid (TMZ) abschwächen kann. Gliome mit epigenetischer Inaktivierung des MGMT-Gens durch eine Promotor-Methylierung, wie sie in etwa 40% der Glioblastome ohne IDH-Mutation vorkommt, sind daher mit einem besseren Ansprechen auf Chemotherapie und längerem Überleben der Glioblastom-Patienten assoziiert [16]. Insbesondere bei älteren Glioblastom-Patienten jenseits des 60. Lebensjahres dient der MGMT-Promotorstatus laut Ergebnissen zweier unabhängiger Phase-3-Studien [17, 18] als prädiktiver Marker zur Therapieentscheidung zwischen alleiniger Radiotherapie oder alleiniger Chemotherapie.
- Der Nachweis von 1p/19q-Kodeletionen dient nicht nur als diagnostischer Marker für oligodendrogliale Tumoren, sondern hat auch eine prädiktive Rolle für Patienten mit anaplastischen Gliomen des WHO-Grades III. Langzeitauswertungen zweier unabhängiger Therapiestudien ergaben, dass Patienten mit 1p/19q-kodeletierten Tumoren ein si-gnifikant besseres Langzeitüberleben zeigen, wenn sie postoperativ mit einer kombinierten Strahlen- und Chemotherapie mit Procarbazin, Lomustin und Vincristin statt mit alleiniger Strahlentherapie behandelt wurden [19, 20]. Dieser Überlebenszeitunterschied zeigte sich nicht für Patienten mit anaplastischen Gliomen ohne 1p/19q-Kodeletion.
- Neben diesen beiden etablierten Markern zeichnen sich weitere molekulare Tests mit potentieller prädiktiver Bedeutung für bestimmte Gliom-Patienten ab. Dies sind z. B. (1) TSC1/TSC2-Mutationen in subependymalen Riesenzellastrozytomen als Marker für eine Therapie mit dem mTOR-Inhibitor Everolimus [21], (2) eine BRAF-V600E-Mutation als Marker für eine gezielte Therapie mit BRAF-Inhibitoren bei Patienten mit pleomorphem Xanthoastrozytom oder BRAF-mutiertem Glioblastom [22, 23], (3) eine H3F3A-K27M-Mutation als Marker für neuartige epigenetische Therapieansätze bei pädiatrischen Patienten mit malignen Hirnstamm-Gliomen [24, 25] (4) eine IDH1-R132H-Mutation als Marker für eine gezielte Therapie mit IDH-Inhibitoren [26] oder einer Tumor-spezifischen Vakzinierung [27], und (5) EGFRvIII-Mutationen als Marker für eine spezifische Peptid-basierte Vakzinierung von Glioblastom-Patienten [28].
Methoden für die molekulare Testung von Gliomen
Viele der für die Klassifikation von Gliomen relevanten Biomarker lassen sich heutzutage bereits durch immunhistochemische Färbungen nachweisen. Hierzu gehören die in > 90% der IDH-mutierten Gliome vorliegende IDH-R132H-Mutation [29], BRAF-V600E- [30], H3F3A-K27M- [31] und EGFRvIII-Mutationen [32], sowie der Verlust der Expression von ATRX im Zellkern [33]. Zum Nachweis von immunhistochemisch nicht detektierbaren Genmutationen werden DNA-Sequenzierungen mittels Sanger-Sequenzierung oder Pyro-Sequenzierung eingesetzt [2]. Mithilfe der Fluoreszenz-in-situ-Hybridisierung (FISH) können u. a. 1p/19q-Kodeletion, Genamplifikationen (z. B. des EGFR-Gens) und Genfusionen (z. B. KIA1549-BRAF in pilozytischen Astrozytomen und C19orf95-RELA in supratentoriellen Ependymomen) nachgewiesen werden. Die Bestimmung der MGMT-Promotor-Methylierung erfolgt meist mittels Methylierungs-spezifischer PCR oder Pyro-Sequenzierung von Natriumbisulfit-modifizierter DNA [34].
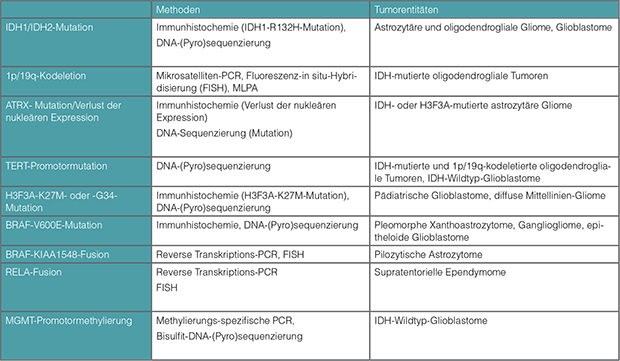
Tab. 1 fasst die derzeit wichtigsten Methoden zur Testung der jeweiligen
Gliom-assoziierten Marker zusammen.
- Neben der individuellen Testung einzelner Marker zeichnen sich vielversprechende neue Ansätze zur gleichzeitigen Bestimmung zahlreicher Marker bzw. genetischer und epigenetischer Profile ab. Diese umfassen Mikroarray-basierte Ansätze zur Epigenom-weiten Bestimmung von tumorspezifischen DNA-Methylierungsprofilen und die Hochdurchsatz-Sequenzierung von Hirntumor-spezifischen Gen-Panels. Insbesondere die Mikroarray-basierte Bestimmung von DNA-Methylierungsprofilen hat sich als eine hervorragende Methode zur molekularen Klassifizierung von ZNS-Tumoren erwiesen, die auch an routinemäßig in Formalin fixierten und in Paraffin eingebetteten Proben funktioniert. Mit diesem Verfahren konnten u. a. Glioblastome [35], anaplastische Gliome [36] und Ependymome [14] in biologisch unterschiedliche Subgruppen unterteilt werden. Zusätzlich erlaubt die Methode die Bestimmung von Veränderungen der DNA-Kopienzahl, d. h. es können über das gesamte Genom hinweg Gewinne und Verluste genetischen Materials nachgewiesen werden. Außerdem kann auch der MGMT-Methylierungsstatus bestimmt werden [37]. Mithilfe der Gen-Panel-Sequenzierung können gleichzeitig die wichtigsten Gliom-assoziierten Gene auf Mutationen und Veränderungen der Genkopien-Zahl hin analysiert werden. Zusätzlich erlaubt die Methode auch die Bestimmung prädiktiver Mutationen für gezielte Therapieansätze.
Integrierte histologische und molekulare Diagnostik von Gliomen
Die enormen Fortschritte in der molekularen Charakterisierung von Gliomen haben es notwendig gemacht, die aktuell noch rein histologisch ausgerichtete WHO-Klassifikation der ZNS-Tumoren [1] zu überarbeiten und die neuen Erkenntnisse zur molekularen Diagnostik dabei zu berücksichtigen. Hierbei wird das Konzept einer integrierten histologischen und molekularen Diagnostik verfolgt [4]. Dies bedeutet, dass zu der histologischen Typisierung (Ebene 1) und WHO-Gradierung (Ebene 2) noch die Ergebnisse der molekularen Testung (Ebene 3) hinzugefügt werden. Alle drei Ebenen werden dann zu einer integrierten Diagnose (Ebene 4) zusammengefügt. Ein Beispiel für eine solche integrierte Diagnose ist „Oligodendrogliom, WHO-Grad II, IDH-mutiert und 1p/19q-kodeletiert“. Die revidierte WHO-Klassifikation wird im Frühjahr 2016 erscheinen.
Literatur
1. Louis DN, Ohgaki H, Wiestler OD, Cavenee WK. WHO classification of tumours of the central nervous system, 4. ed. World Health Organization classification of tumours, vol 1. IARC Press, Lyon, 2007.
2. Weller M et al. Glioma. Nature Reviews Disease Primers 2015; 15017 [doi:10.1038/nrdp.2015.17].
3. Capper D, Reifenberger G. Klassifikation von Gliomen: Aktuelle Fortschritte und Perspektiven. Nervenarzt 2015; 86: 672, 674-6, 678-80.
4. Louis DN et al. International Society of Neuropathology-Haarlem consensus guidelines for nervous system tumor classification and grading. Brain Pathol 2014; 24: 429-35.
5. The Cancer Genome Atlas Research Network (2015) Comprehensive, integrative genomic analysis of diffuse lower-grade gliomas. New Engl J Med 2015; 372: 2481-98.
6. Gilbert MR et al. Dose-dense temozolomide for newly diagnosed glioblastoma: A randomized phase III clinical trial. J Clin Oncol 2013; 31: 4085–91.
7. Schwartzentruber J et al. Driver mutations in histone H3.3 and chromatin remodelling genes in paediatric glioblastoma. Nature 2012; 482: 226–31.
8. Khuong-Quang D et al. K27M mutation in histone H3.3 defines clinically and biologically distinct subgroups of pediatric diffuse intrinsic pontine gliomas. Acta Neuropathol 2012; 124: 439–47.
9. Wu G et al. Somatic histone H3 alterations in pediatric diffuse intrinsic pontine gliomas and non-brainstem glioblastomas. Nat Genet 2012; 44: 251–3.
10. Jones DT et al. MAPK pathway activation in pilocytic astrocytoma. Cell Mol Life Sci 2012; 69: 1799–811.
11. Weber RG et al. Frequent loss of chromosome 9, homozygous CDKN2A/p14(ARF)/CDKN2B deletion and low TSC1 mRNA expression in pleomorphic xanthoastrocytomas. Oncogene 2007; 26: 1088–97.
12. Schindler G et al. Analysis of BRAF V600E mutation in 1,320 nervous system tumors reveals high mutation frequencies in pleomorphic xanthoastrocytoma, ganglioglioma and extra-cerebellar pilocytic astrocytoma. Acta Neuropathol 2011; 121: 397–405.13. Chan JA et al. Pathogenesis of tuberous sclerosis subependymal giant cell astrocytomas: Biallelic inactivation of TSC1 or TSC2 leads to mTOR activation. J Neuropathol Exp Neurol 2004; 63: 1236–42.
14. Pajtler KW et al. Molecular classification of ependymal tumors across all CNS compartments, histopathological grades, and age groups. Cancer Cell 2015; 27: 728–43.
15. Weller M et al. EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma. Lancet Oncol 2014; 15: e395-e403.
16. Hegi ME et al. MGMT gene silencing and benefit from temozolomide in glioblastoma. New Engl J Med 2005; 352: 997–1003.
17. Wick W et al. Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly: The NOA-08 randomised, phase 3 trial. Lancet Oncol 2012; 13: 707–15.
18. Malmström A et al. Temozolomide versus standard 6-week radiotherapy versus hypofractionated radiotherapy in patients older than 60 years with glioblastoma: The Nordic randomised, phase 3 trial. Lancet Oncol 2012; 13: 916–26.
19. Cairncross G et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: Long-term results of RTOG 9402. J Clin Oncol 2013; 31: 337–43.
20. van den Bent MJ et al. Adjuvant procarbazine, lomustine, and vincristine chemotherapy in newly diagnosed anaplastic oligodendroglioma: Long-term follow-up of EORTC brain tumor group study 26951. J Clin Oncol 2013; 31: 344–50.
21. Krueger DA et al. Everolimus for subependymal giant-cell astrocytomas in tuberous sclerosis. New Engl J Med 2010; 363: 1801–11.
22. Chamberlain MC. Salvage therapy with BRAF inhibitors for recurrent pleomorphic xanthoastrocytoma: A retrospective case series. J Neurooncol 2013; 114: 237–40.
23. Kleinschmidt-DeMasters BK et al. BRAF VE1 immunoreactivity patterns in epithelioid glioblastomas positive for BRAF V600E mutation. Am J Surg Pathol 2015; 39: 528–40.
24. Hashizume R et al. Pharmacologic inhibition of histone demethylation as a therapy for pediatric brainstem glioma. Nat Med 2014; 20: 1394–6.
25. Grasso CS et al. Functionally defined therapeutic targets in diffuse intrinsic pontine glioma. Nat Med 2015; 21: 555–9.
26. Rohle D et al. An inhibitor of mutant IDH1 delays growth and promotes differentiation of glioma cells. Science 2013; 340: 626–30.
27. Schumacher T e t al. A vaccine targeting mutant IDH1 induces antitumour immunity. Nature 2014; 512: 324–7.
28. Reardon DA et al. ReACT: Overall survival from a randomized phase II study of rindopepimut (CDX-110) plus bevacizumab in relapsed glioblastoma. Neurosurgery 2015; 62 (Suppl 1): 198–9 (Congress of Neurological Surgeons 2015, Abstract #107).
29. Capper D et al. Characterization of R132H mutation-specific IDH1 antibody binding in brain tumors. Brain Pathol 2010; 20: 245–54.
30. Capper D et al. Assessment of BRAF V600E mutation status by immunohistochemistry with a mutation-specific monoclonal antibody. Acta Neuropathol 2011; 122: 11–9.
31. Bechet D et al. Specific detection of methionine 27 mutation in histone 3 variants (H3K27M) in fixed tissue from high-grade astrocytomas. Acta Neuropathol 2014; 128: 733–41.
32. Weller M e t al. Assessment and prognostic significance of the epidermal growth factor receptor vIII mutation in glioblastoma patients treated with concurrent and adjuvant temozolomide radiochemotherapy. International journal of cancer. Int J Cancer 2014; 134: 2437–47.
33. Abedalthagafi M et al. The alternative lengthening of telomere phenotype is significantly associated with loss of ATRX expression in high-grade pediatric and adult astrocytomas: A multi-institutional study of 214 astrocytomas. Modern Pathol 2013; 26: 1425–32.
34. Wick W et al. MGMT testing − the challenges for biomarker-based glioma treatment. Nat Rev Neurol 2014; 10: 372–85.
35. Sturm D et al. Hotspot mutations in H3F3A and IDH1 define distinct epigenetic and biological subgroups of glioblastoma. Cancer Cell 2012; 22: 425–37.
36. Wiestler B et al. Integrated DNA methylation and copy-number profiling identify three clinically and biologically relevant groups of anaplastic glioma. Acta Neuropathol 2014; 128: 561–71.
37. Bady P et al. MGMT methylation analysis of glioblastoma on the Infinium methylation BeadChip identifies two distinct CpG regions associated with gene silencing and outcome, yielding a prediction model for comparisons across datasets, tumor grades, and CIMP-status. Acta Neuropathol 2012; 124: 547–60.

Korrespondierender Autor:
Prof. Dr. med. G. Reifenberger
Institut für Neuropathologie
Heinrich-Heine-Universität Düsseldorf
Universitätsstraße 1, 40225 Düsseldorf
+49 211 81 18660
reifenberger[at]med.uni-duesseldorf[dot]de

