Die adjuvante Therapie hirneigener Tumoren
Marion Rapp, Marcel Kamp, Michael Sabel
Aufgrund des infiltrativen Wachstums ist bei Gliomen vom WHO-Grad II–IV eine komplette Resektion nicht möglich. Daher ergibt sich die Notwendigkeit einer adjuvanten Therapie der verbliebenen Tumoranteile. Hierzu stehen als adjuvante Verfahren Strahlentherapie und Chemotherapie (im Wesentlichen mit Alkylanzien) zur Verfügung. Die Therapieempfehlungen sind abhängig von der neuropathologischen Diagnose, dem molekularen Subtyp des Tumors sowie dem Alter und dem klinischen Zustand des Patienten.
Die adjuvante Therapie des Glioblastoms (WHO-Grad IV)
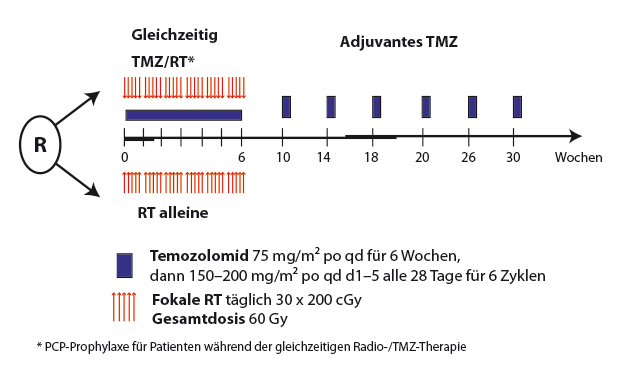
Der aktuelle Goldstandard in der primären Therapie des Glioblastoms wurde 2006 von R. Stupp et al. definiert. In einer multizentrischen EORTC-Studie wiesen sie einen Überlebensvorteil durch die kombinierte Radiochemotherapie mit Temozolomid (TMZ) mit anschließender TMZ-Chemotherapie im Vergleich zur alleinigen Strahlentherapie nach [1]. Nach der operativen Resektion wird eine etwa sechswöchige kombinierte Radiochemotherapie durchgeführt, an die sich nochmals sechs Zyklen TMZ anschließen (Abb. 1). MRT-Kontrollen (72 Stunden postoperativ, sechs Wochen nach Abschluss der Radiatio, dann alle drei Monate) überwachen das Therapieansprechen. Als wichtiger prädiktiver Marker für dieses Ansprechen konnte die Methylierung des Promotors des Gens für die O6-Methylguanin-Methyltransferase (MGMT) identifiziert werden [2]. MGMT ist ein Reparaturenzym, das durch Alkylanzien ausgelöste DNA-Schäden reparieren kann. Durch die Methylierung des Promotors wird die Synthese des Reparaturenzyms ausgeschaltet, sodass es zu einem besseren Therapieansprechen bei alkylierender Chemotherapie kommt.
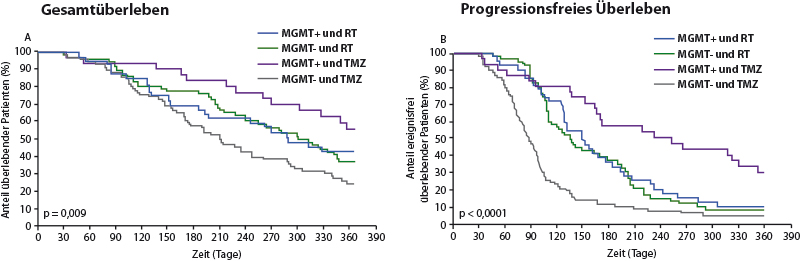
Eine besondere Stellung nach Erstdiagnose eines Glioblastoms nehmen ältere Patienten ein. So konnte eine Studie nachweisen, dass bei Patienten > 65 Jahren mit positivem MGMT-Methylierungsstatus eine alleinige TMZ-Therapie einer Strahlentherapie nicht unterlegen ist, während bei Patienten ohne MGMT-Methylierung nicht auf eine Bestrahlung verzichtet werden kann (Abb. 2, [3]). Allerdings sind die Gesamtüberlebenszeiten in dieser Studie dramatisch schlechter als in der Stupp-Studie.
Die adjuvante Therapie anaplastischer Gliome (WHO-Grad III)
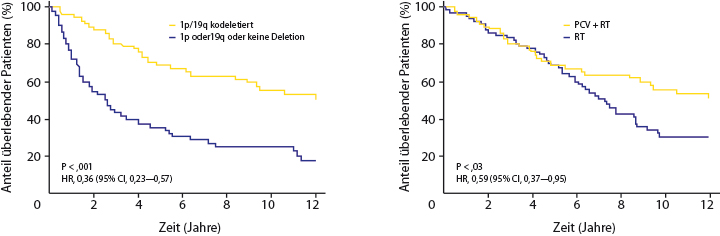
Anaplastische Gliome werden neuropathologisch weiter unterteilt in Oligodendrogliome und Astrozytome [4]. Für erstere konnte ein besseres Therapieansprechen und ein längeres medianes Überleben nachgewiesen werden [5]. 2009 zeigte eine multizentrische Studie, dass Strahlentherapie verglichen mit einer Chemotherapie mit TMZ oder PCV (Procarbazin, Carmustin, Vincristin) in der Primärtherapie anaplastischer Gliome gleichwertig ist [6], was eine individuelle Therapieplanung ermöglichte. Aktuelle Studien unterstreichen allerdings die Sonderstellung der oligodendroglial differenzierten Tumoren. Die Mehrzahl dieser Tumoren weißt einen „Loss of Heterozygosity“ der Chromosomen-Abschnitte 1p/19q auf , was mit einer besonders günstigen Prognose verbunden ist.
Eine Langzeit-Überlebensanalyse mit über zwölf Jahren Beobachtungszeit bestätigte nicht nur das bessere Therapieansprechen von Patienten mit oligodendroglialen Tumoren, sondern zeigte einen signifikanten Benefit dieser Patienten nach PCV-Chemotherapie mit nachfolgender Strahlentherapie verglichen mit alleiniger Strahlentherapie (Abb. 3, [5]). Die Ergebnisse dieser Studie legen demnach eine sequenzielle Chemoradiotherapie als Primärtherapie bei Patienten mit anaplastischen oligodendroglial differenzierten Tumoren nahe.
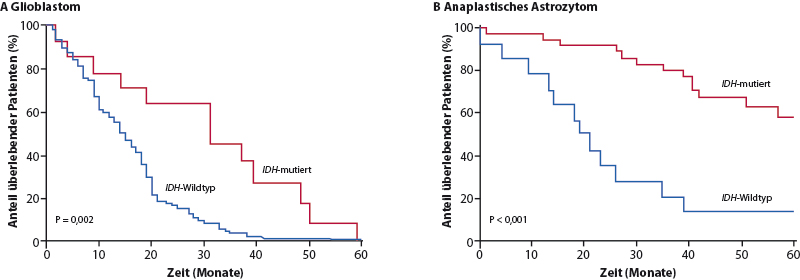
Als weiterer wichtiger molekularer Marker konnte der Mutationsstatus des Gens für die Isocitrat-Dehydrogenase (IDH1) identifiziert werden [7], der vor allem bei anaplastischen Gliomen und Glioblastomen nachgewiesen wurde, die sich aus diffusen Gliomen entwickelt haben. Tumoren mit dieser Mutation zeigen unabhängig von der Therapie eine bessere Prognose. Andererseits konnte eine Untergruppe von anaplastischen Astrozytomen identifiziert werden, die einen Glioblastom-ähnlichen klinischen Verlauf zeigen und daher wie die Glioblastome bereits in der Primärtherapie mit einer kombinierten Radiochemotherapie behandelt werden sollten (Abb. 4).
Die adjuvante Therapie der diffusen Gliome (WHO II)
Die adjuvante Therapie bei langsam wachsenden, diffusen Gliomen wird weiterhin kontrovers diskutiert. Aufgrund der sicheren malignen Transformation der WHO-Grad-II-Tumoren zu den WHO-Graden III/IV besteht Konsens über die Notwendigkeit, den Transformationszeitpunkt frühestmöglich zu identifizieren [8]. Hierzu werden nach Alter, Geschlecht, Tumorgröße, Tumorlokalisation sowie Darstellung in der MRT- und FET-PET-Diagnostik „High-risk“-Patienten identifiziert, die frühzeitig mittels Radio- bzw. Chemotherapie behandelt werden sollten [9]. Die Anwendung einer adjuvanten Therapie wird bei dieser Diagnose in Abhängigkeit von den Risikofaktoren individuell mit dem Patienten besprochen und geplant.
Bei allen Patienten ist eine regelmäßige MRT-Kontrolle absolut notwendig, um den Krankheitsverlauf engmaschig beurteilen zu können.
Literatur
1. Stupp R et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma. New Engl J Med 2005; 352: 987-96.
2. Hegi ME et al. MGMT gene silencing and benefit from temozolomide in glioblastoma. New Engl J Med 2005; 352: 997-1003.
3. Wick W et al. Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly: The NOA-08 randomised, phase 3 trial. Lancet Oncol 2012; 13: 707-15.
4. Capper D et al. Classification of gliomas. Current progress and perspectives. Nervenarzt 2015; 86: 672, 674-6, 678-80.
5. Cairncross G et al. Phase III trial of chemoradiotherapy for anaplastic oligodendroglioma: Long-term results of RTOG 9402. J Clin Oncol 2013; 31: 337-43.
6. Wick W et al. NOA-04 randomized phase III trial of sequential radiochemotherapy of anaplastic glioma with procarbazine, lomustine, and vincristine or temozolomide. J Clin Oncol 2009; 27: 5874-80.
7. Yan H et al. IDH1 and IDH2 mutations in gliomas. New Engl J Med 2009; 360: 765-73.
8. Pignatti F et al. Prognostic factors for survival in adult patients with cerebral low-grade glioma. J Clin Oncol 2002; 20: 2076-84.
9. Rapp M et al. Clinical value of O-(2-[(18)F]-fluoroethyl)-L-tyrosine positron emission tomography in patients with low-grade glioma. Neurosurg Focus 2013; 34: E3.

Dr. Marion Rapp
Oberärztin Neurochirurgische Klinik, Arbeitsgruppe Neuroonkologie
Psychoonkologin (WPO)
Universitätsklinikum Düsseldorf
Moorenstraße 5, 40225 Düsseldorf
+49 211 8107458
+49 211 81 17674
marion.rapp[at]med.uni-duesseldorf[dot]de

