Computer-unterstützte Erkennung von Krebszellen mittels DNA-Karyometrie
Alfred Böcking, Jin Chen, David Friedrich, Dietrich Meyer-Ebrecht
Zusammenfassung
In der mikroskopischen Diagnostik bedeuten Dysplasien und Borderline-Veränderungen den vagen Verdacht auf das Vorliegen bösartiger Tumorzellen, der der weiteren Abklärung bedarf. Subjektive Malignitäts-Gradierungen bösartiger Tumoren sind zudem oft wenig valide und reproduzierbar. Die DNA-Zytometrie als eine adjuvante diagnostische Methode erlaubt im Falle des Nachweises von Aneuploidie die Identifizierung von (prospektiv) malignen Zellen. Das Ausmaß an Aneuploidie ist bei vielen bösartigen Tumoren zudem ein valider prognostischer Index. Digitale bildanalytische morphometrische Klassifikatoren, die gewebespezifisch malignitätsverdächtige und maligne Zellkerne identifizieren, erlauben erstmalig eine Computer-unterstützte automatische Messung ihrer DNA-Gehalte. Zusammen mit einem motorisierten Mikroskop (Abb. 1) sind damit diagnostische Analysen morphologisch verdächtiger Zellkerne mit einem vertretbaren Zeitaufwand und hohen prädiktiven Werten möglich. Die neue DNA-Karyometrie ist als IGeL-Leistung abrechenbar.
Definition
Die DNA-Karyometrie stellt eine Kombination aus digitaler morphologischer Klassifizierung von Kernen verschiedener Zelltypen und Messung des DNA-Gehaltes in den als morphologisch krebsverdächtig bewerteten Zellen dar. Ihr Zweck ist im Wesentlichen die Erkennung bösartiger Tumorzellen, aber auch die Bestimmung ihres Malignitätsgrades, z. B. beim Prostatakarzinom.
Indikationen
Histologie
Indikationen sind die Abklärung der Dignität von Dysplasien der Schleimhäute, z. B. des Mundes [1], des Kehlkopfs [2], der Bronchien [3], des Barret-Ösophagus [4], des Magens (Abb. 2; [5]), der Gallengänge [6], des Dickdarms bei Colitis ulcerosa [7] sowie von Borderline-Tumoren der Haut [8], des Ovars (Abb. 3a; [9]) und der Plazenta (bei Partialmole oder Verdacht auf Chorionkarzinom (Abb. 3b; [10]). Der Nachweis von DNA-Stammlinien-Aneuploidie, der einer klonalen chromosomalen Aneuploidie entspricht, deutet auf eine Malignität der untersuchten Gewebe hin. Weitere Indikation ist das Malignitäts-Grading des Prostatakarzinoms (Abb. 3c, [11]). Lage und Zahl von DNA-Stammlinien korrelieren hier eng mit der Prognose.
Zytologie
Indikationen sind die Abklärung der Dignität von Dysplasien der Schleimhäute, z. B. des Mundes [1], des Kehlkopfes [2], der Bronchien [3], des Barret-Ösophagus [4], des Magens (Abb. 2; [5]), der Gallengänge [6], des Dickdarms bei Colitis ulcerosa [7] und des Muttermundes (Abb. 3d; [12]), weiter die Abklärung der Dignität unklarer Feinnadelpunktate, z. B. der Lungen, der Leber, des Pankreas sowie die Abklärung der Dignität suspekter Zellen in Körperflüssigkeiten, z. B. Sputen [13], Pleuraergüssen [14], Aszites [14] und Urinen [15]. Der Nachweis von DNA-Stammlinien-Aneuploidie spricht auch hier für Malignität der untersuchten Zellen.
Biologische Grundlagen
Klonal vorkommende chromosomale Aneuploidie ist ein Spezifikum maligner Zellen. Die „Mitelman Database of Chromosome Aberrations and Gene Fusions in Cancer“ [16], listet 65.780 publizierte Karyogramme maligner menschlicher Tumoren, die alle chromosomale Aneuploidie aufweisen. Andererseits ist klonal auftretende chromosomale Aneuploidie in nicht-malignen Zellen nicht bekannt. Das bedeutet, dass der Nachweis einer klonalen chromosomalen Aneuploidie dem Nachweis von maligne transformierten Zellen entspricht. Dementsprechend ist der Nachweis des zytometrischen Äquivalents DNA-Stammlinien-Aneuploidie ebenfalls beweisend für das Vorliegen maligner Zellen. Nicht klonale chromosomale Aneuploidie und eine dieser entsprechende sogenannte Einzelzell-Aneuploidie sind dagegen lediglich suspekt auf das Vorliegen von Malignität, für diese jedoch nicht letztlich beweisend [17].
Technologie
Untersuchungsmaterialien
Geeignet sind sämtliche zytologischen Präparate, unabhängig von ihrer Fixation und Färbung sowie Formalin-fixierte, in Paraffin eingebettete Gewebe.
Präparation und Färbung
Gewebe: In gefärbten Schnitten aus Formalin-fixierten, in Paraffin eingebetteten Geweben werden diagnostisch relevante Areale markiert. Gegebenenfalls werden 60 μm dicke Schnitte, die Gewebe mit externen Referenzzellen, z. B. Fibroblasten enthalten, zugefügt. Diese werden zusammen einer gezielten Zellvereinzelung mit Pepsin unterzogen. Die Suspensionen isolierter Zellkerne werden auf Objektträger zentrifugiert und spezifisch nach Feulgen für DNA gefärbt.
Zellen: Vorgefärbte zytologische Präparate werden in Xylol entdeckelt und anschließend nach Feulgen mit Pararosanilin oder Thionin gefärbt. Dabei lösen sich alle Farbstoffe vorheriger Färbungen heraus.
Scannen der Präparate
Auf dem Objekttisch des motorisierten Mikroskops (Abb. 1) wird der Objektträger, zusammen mit gegebenenfalls aufgebrachten Markierungen, bei niedriger Primärvergrößerung gescannt. Interaktiv können am Monitor auf dem so entstandenen Bild Markierungen derjenigen Areale angebracht werden, in welchen ein systematisches Scannen bei hoher Vergrößerung (40x-Objektiv) erfolgen soll. Um das automatische Fokussieren pro Gesichtsfeld zu erleichtern, können für ausgesuchte Areale deren Fokus-Ebenen vordefiniert werden. Sodann beginnt ein automatisches, systematisches Scannen aller Gesichtsfelder innerhalb der markierten Arale. Dazu werden jeweils sechs Bilder in verschiedenen Fokusebenen gespeichert, von denen nur das mit den meisten scharf abgebildeten Zellkernen weiter verarbeitet wird.
Digitale Klassifikation
Zunächst werden sämtliche gefärbten Objekte in ihrer exakten Form und Größe identifiziert und mit hochspezifischen Masken versehen, innerhalb derer die weitere Bildanalyse und gegebenenfalls DNA-Messung erfolgt. Mittels digitaler Klassifikatoren, die von Zytopathologen Gewebe- bzw. Fixations-spezifisch trainiert wurden [18], wird jedes Objekt einer der folgenden acht Klassen zugeordnet: Artefakte, defokussierte Zellkerne, Kern-Doubletten, Kerne von Lymphozyten, Granulozyten, Fibroblasten, Makrophagen, normale Epithel- oder Mesothelzellen, malignitätsverdächtige (dyskaryotische) Epithel- oder Mesothelzellen.
DNA-Messung
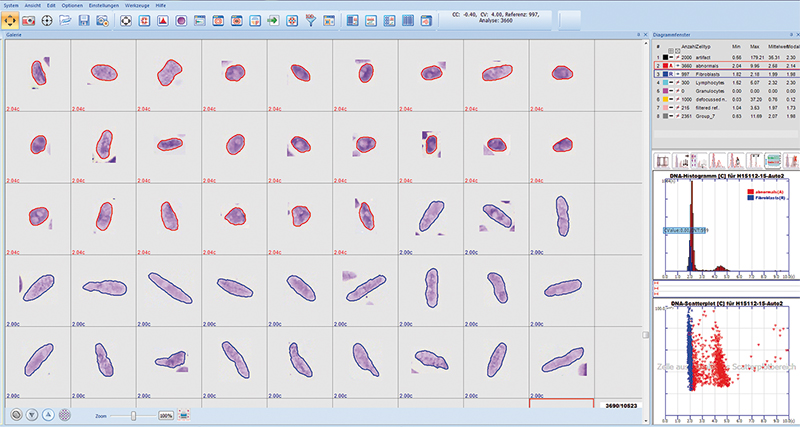
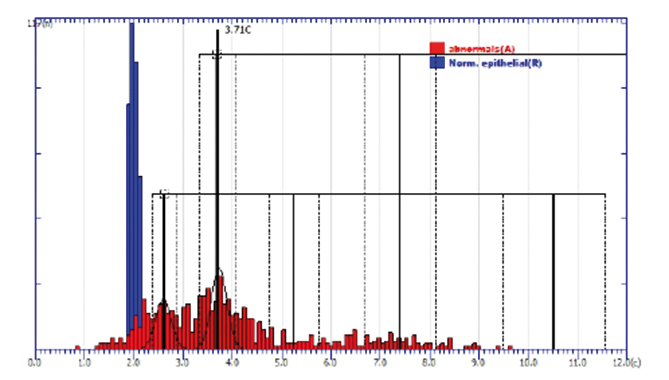
Nach interner Kalibrierung mit der Integrierten Optischen Dichte (IOD) der vom Nutzer definierten gesunden Referenzzellen (z. B. Fibroblasten, Abb. 2) erfolgt die Bestimmung des relativen DNA-Gehaltes in allen Kernen der zur Analyse anstehenden abnormen oder atypischen Zellen (1c entspricht der DNA-Menge eines haploiden Chromosomensatzes). Der Fehler der Messung liegt für Lymphozyten derzeit bei einem CV von 2–3%. Die Ergebnisse werden in DNA-Histogrammen (Anzahl vs. DNA) und Scatter-Plots (Fläche vs. DNA) dargestellt [19].
Kontrolle
Der Pathologe kontrolliert die korrekte Segmentierung der Zellkerne sowie deren Klassifikation interaktiv an einer sogenannten Bildgalerie (Abb. 2). Dort kann er gegebenenfalls die Segmentierung der Objekte korrigieren, diese umklassifizieren oder löschen. Das System gibt Warnmeldungen aus, sobald bestimmte, von der European Society for Analytical Cellular Pathology (ESACP) festgelegte Qualitätsstandards der diagnostischen DNA-Bildzytometrie (Zahl, CV und CC der Referenzzellen, minimale Zahl der Analysezellen) unterschritten worden sind [20].
Diagnostische Interpretation
Sogenannte DNA-Stammlinien-Aneuploidie, welche gewebeunabhängig auf Malignität hindeutet, wird automatisch identifiziert, sobald ein Peak des DNA-Histogramms mit zusätzlichen Werten bei seiner Verdoppelung identifiziert worden ist [20]. Sogenannte DNA-Einzelzell-Aneuploidie, deren Feststellung gewebespezifisch vom Grad der darin physiologischerweise vorkommenden euploiden Polyploidisierung abhängt, wird oberhalb eines programmierten, spezifischen Schwellenwertes festgestellt (z. B. > 9c bei Proben vom Muttermund). Die diagnostische Interpretation kann auch interaktiv am Monitor durch subjektive Identifizierung von Peaks und Stammlinien am DNA-Histogramm erfolgen. In den finalen diagnostischen Bericht werden nur vom Pathologen verifizierte diagnostische Interpretationen der Messergebnisse aufgenommen.
Dokumentation
Pro Messung wird ein dreiseitiger DNA-Karyometrie-Bericht ausgegeben, welcher neben dem DNA-Histogramm und einem Scatter-Plot repräsentative Abbildungen gemessener Referenz- und Analyse-Zellkerne sowie standardisierte Indizes der DNA-Verteilung und die von einem Pathologen autorisierte diagnostische bzw. prognostische Interpretation der Messergebnisse enthält.
Innovative Aspekte
DNA-Messungen an Zellkernen zu diagnostischen und prognostischen Zwecken sind seit den 1960er-Jahren bekannt [21]. Zunächst verwendete man dazu Mikroskop-Photometer. Ab den 1980er-Jahren wurden TV- und zunehmend auch digitale Kameras in Verbindung mit Mikroskopen eingesetzt, welche heute den Einsatz bildanalytischer Methoden zur Klassifizierung von gefärbten Objekten und Zellkernen erlauben. Der Einsatz dieser Methodik zu diagnostischen und prognostischen Zwecken wurde durch vier Konsensus-Reports der European Society for Analytical Cellular Pathology (ESACP) hochgradig standardisiert [19, 20]. Da immer noch eine Auswahl zu messender Zellkerne per Hand erforderlich war, erforderte diese Methodik einen zu hohen Zeitaufwand, um in der Routinediagnostik wirtschaftlich einsetzbar zu sein. Grobe bildanalytische Vorklassifikationen von Zellkernen erlaubten bisher nicht, automatisch zwischen gesunden und malignitätsverdächtigen Kernen eines Zelltyps wie z. B. Plattenepithelien vom Muttermund oder Mesothelien in Körperhöhlen-Ergüssen zu unterscheiden. Damit gingen bei DNA-Messungen kleinere Populationen malignitätsverdächtiger Zellen in der Überzahl unverdächtiger Zellen meist unter („Stecknadel im Heuhaufen“).
Erst die Einführung von Zellkern-Klassifikatoren, die von Zytopathologen gewebe- bzw. fixationsspezifisch trainiert werden [18], erlaubt es, nicht nur gesunde Referenzzellen automatisch zu detektieren, sondern auch Kerne malignitätsverdächtiger oder eindeutig maligner Zellen anhand ihrer spezifischen Morphologie (Dyskaryosen) mit einer Genauigkeit von ca. 93,5% zu erkennen [22]. Dies macht in Kombination mit einem Computer-gesteuerten, motorisierten Mikroskop (Abb. 1) ein automatisches Scannen von Routine-Präparaten möglich, was eine Reduktion der erforderlichen Interaktionszeit für eine Messung durch Bedienungspersonal von bisher ca. 60 Minuten auf ca. 10 Minuten erlaubt. Zusammen mit einer angemessenen Entlohnung als IGeL-Leistung (siehe unten) wird die Methode damit erstmals wirtschaftlich darstellbar.

Unabhängig vom DNA-Gehalt der Zellkerne kann auch die Zahl bzw. der Anteil bildanalytisch als verdächtig klassifizierter Zellkerne in einer Probe dazu verwendet werden, diese als malignitätsverdächtig zu bewerten, sodass sie einer weiteren Begutachtung oder Abklärung zugeführt werden können. Damit eröffnet sich die Möglichkeit, das Verfahren auch zum Screening zellhaltiger Proben auf das Vorliegen von Tumorzellen einzusetzen (z. B. Bronchialsekrete, Ergüsse, Sputen, Urine).
Wesentlicher Vorteil der DNA-Karyometrie ist die Möglichkeit der Messung einer mindestens um den Faktor 10 größeren Zahl an Zellkernen gegenüber der konventionellen DNA-Bildzytometrie. Dies ermöglicht angesichts der Seltenheit verdächtiger Kerne in den meisten Zellproben bzw. der bekannten zytogenetischen Heterogenität maligner Tumoren eine sehr viel repräsentativere diagnostische bzw. prognostische Aussage. Der geringere zeitliche Aufwand für die Bedienung des Gerätes macht die Methode zudem überhaupt erst wirtschaftlich darstellbar.
Diagnostische Resultate
Nur der Einsatz eines motorisierten Mikroskopes und die automatische Zuweisung von Zellkernen in ihre entsprechenden Klassen durch digitale Klassifikatoren ermöglichen eine vollständige Erfassung aller auf einem Objektträger befindlichen Objekte. Alle vom System erfassten diagnostisch/prognostisch relevanten Zellkerne können durch einen Pathologen am Monitor und im Mikroskop verifiziert werden. Damit liegt die vollständige Verantwortung weiterhin in seiner Hand. Im Prinzip sind die mit der klassischen manuellen, d. h. interaktiven DNA-Bildzytometrie publizierten diagnostischen und prognostischen Ergebnisse auf die DNA-Karyometrie übertragbar, da auch bei dieser letztlich eine vom Pathologen getroffene und zu verantwortende Auswahl vermessener Zellkerne zugrunde liegt. Da diese aber ein Vielfaches an Zellkern-DNA-Messungen beinhaltet, dürften deren diagnostische Ergebnisse sensitiver und die prognostischen repräsentativer sein. Falsch-positive diagnostische Ergebnisse haben wir damit bisher nicht beobachtet. Bei einem Vergleich beider Verfahren bei Prostatakarzinomen konnten wir durch die DNA-Karyometrie in 30% der Fälle einen höheren DNA-Grad der Malignität feststellen. Die niedrigeren Beurteilungen durch die DNA-Bildzytometrie an weniger Zellen stellen damit Untergradierungen dar.
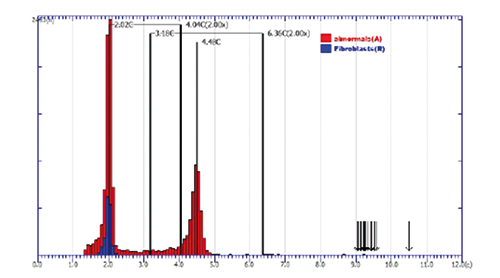
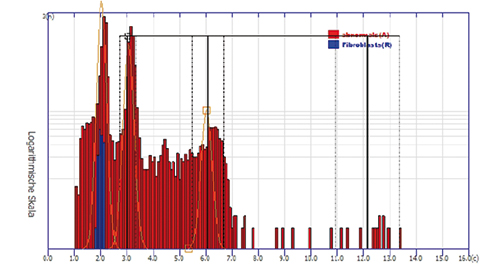
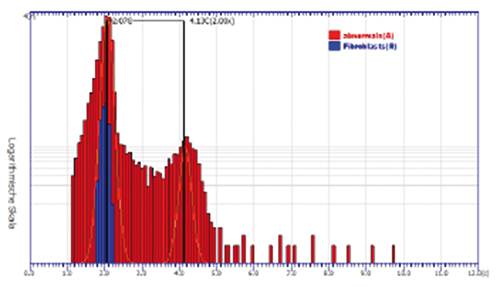
Gebärmutterhals:
In Abstrichen der Gruppe Pap. III und IIID erzielt die DNA-Zytometrie bei Nachweis sogenannter Stammlinien-Aneuploidie einen positiven Prädiktionswert (PPV) von 76,3% für die Vorhersage eines histologischen Befundes CIN ≥ 3 innerhalb von drei Monaten (Abb. 3d; [12]).
Mundschleimhaut:
Die Sensitivität für die zytologische Identifizierung eines Plattenepithelkarzinoms der Mundschleimhaut an Bürsten-Abstrichen konnte durch DNA-Zytometrie von 91,3% auf 97,8% gehoben werden, die Spezifität von 95,1% auf 100% [1].
Bronchiale Schleimhaut:
An zytologisch suspekten Bronchial-Sekreten konnte durch DNA-Zytometrie eine Sensitivität zur Erkennung eines Bronchialkarzinoms von 83% erreicht werden, die Spezifität betrug 100% [3].
Ergüsse:
In zytodiagnostisch unklaren, malignitätsverdächtigen Pleuraergüssen und Aszites-Flüssigkeiten betrug die Sensitivität der DNA-Zytometrie zur Erkennung von Tumorzellen 82,9%, der positive Prädiktionswert 96,7% [14].
Prostatakarzinome:
Vier Level 1b-Studien berichten über die Hinzufügung signifikanter prognostischer Information zum subjektiven Gleason-Score bezüglich der Vorhersage einer nach radikaler Prostatektomie festgestellten Überschreitung der Organ-Kapsel durch DNA-Zytometrie (Abb. 3a; [11]).
Vergütung
Für die herkömmliche DNA-Bildzytometrie gibt es die EBM-Ziffer 19330 „Zytologische Untersuchung eines Materials mit DNA-Bestimmung“. Diese sieht eine DNA-Messung an mindestens 100 Zellkernen vor und wird derzeit mit 29,38 € entlohnt. Die DNA-Karyometrie als IGeL-Leistung dagegen beinhaltet eine vorangehende digitale bildanalytische Klassifikation von Kernen verschiedener Zelltypen und anschließende DNA-Messung an morphologisch als abnorm bzw. atypisch bewerteten Zellen. In der Regel erfolgt eine Messung sämtlicher abnormer bzw. atypischer Zellkerne auf einem Objektträger oder von mindestens 1.000 solchen Kernen. Bei der DNA-Karyometrie ist der DNA-Messung demnach eine digitale bildanalytische Identifizierung aller morphologisch als abnorm oder atypisch bewerteten Zellkerne in einem Präparat vorgeschaltet. In der Regel wird die DNA entweder in mehreren zehntausend oder allen auf einem Objektträger befindlichen abnormen/atypischen Kernen gemessen. Hierfür können aufgrund eines Beschlusses der Gebührenkommission des Bundesverbandes Deutscher Pathologen vom 28.02.2015 einem GKV-Patienten nach vorheriger Einholung seines Einverständnisses 153,- € an zytologischen und 194,- € an histologischen Proben berechnet werden.
Literatur
1. Böcking A et al. Role of brush biopsy and DNA-cytometry for prevention, diagnosis, therapy, and follow-up care of oral cancer. J Oncol 2011, doi:10.1155/2011/875959
2. Böcking A et al. Diagnosis and grading of malignancy in squamous epithelial lesions of the larynx with DNA-cytophotometry. Cancer 1985; 56: 1600-4.
3. Schramm M et al. Equivocal cytology in lung cancer diagnosis. Cancer Cytopathol 2011; 119: 177-92.
4. Kerkhof M et al. Biomarkers for risk stratification of neoplastic progression in Barret´s esophagus. Cell Oncol 2007; 29: 507-17.
5. Böcking A et al. DNA-distribution in gastric cancer and dysplasia. Zhang YC, Kawai K (eds.): Precancerous conditions and lesions of the stomach. Springer, Berlin, Heidelberg (1993) 103-20.
6. Schramm M et al. Adjuvant fluorescent in situ hybridization in equivocal biliary and pancreatic duct cytology- Pathologe 2012; Suppl 1: 119.
7. Gerling M et al. Aneuploidy-associated gene expression signatures characterize malignant transformation in ulcerative colitis. Infl Bowel Dis 2013; 19: 691-703.
8. Vogelbruch M et al. Differentiation between malignant and benign follicular adnexal tumours of the skin by DNA image cytometry. Brit J Dermatol 2002; 146: 238-43.
9. Kristensen GB et al. Large-scale genomic instability predicts long-term outcome for women with invasive stage I ovarian cancer. Ann Oncol 2003; 14: 1494-500.
10. Gschwendtner A et al. DNA ploidy determination of early molar pregnancies by image analysis. Arch Pathol Lab Med 1998; 122: 1000-4.
11. Böcking A et al. DNA-cytometric grading of prostate cancer. Systematic review with desciptive data analysis. Pathol Discov 2014; 2: 1-20.
12. Grote HJ et al. Identification of progressive cervical epithelial cell abnormalities using DNA-image cytometry. Cancer Cytopathol 2004; 102: 373-9.
13. Auffermann W, Böcking A. Early detection of precancerous lesions in dysplasias of the lung by rapid DNA image cytometry. Analyt Quant Cytol Histol 1985; 7: 219-26.
14. Motherby H et al. Immunocytochemistry and DNA-image cytometry in diagnostic effusion cytology. II. Diagnostic accuracy in equivocal smears. Anal Cell Oncol 1999; 19: 59-66.
15. Planz B et al. Diagnosis of bladder cancer with urinary cytology, immunocytology and DNA-image-cytometry. Anal Cell Pathol 2001; 22: 103-9.
16. Mitelman Database of Chromosome Aberrations and Gene Fusions in Cancer (2015). Mitelman F, Johansson B and Mertens F (Eds.), cgap.nci.nih.gov/Chromosomes/Mitelman
17. Böcking A. Comparability of tumor-cytogenetics and -DNA-cytomery. Letter to the editor. Mol Cytogenetics 2015; 8: 28.
18. Friedrich D. Effective improvement of cancer diagnostics and prognostics by computer-assisted cell image analysis. Dissertation, Rheinisch Westfälische Technische Hochschule Aachen, Fakultät für Ingenieurwissenschaften 2015
19. Giroud F et al. 1997 ESACP consensus report on diagnostic DNA image cytometry. Part II: Specific recommendations for quality assurance. Anal Cell Pathol 1998; 17: 201-8.
20. Haroske G et al. Fourth updated ESACP consensus report on diagnostic DNA image cytometry. Anal Cell Pathol 2001; 23: 89-95.
21. Sandritter W et al. Photometric cytodiagnosis of vaginal smears. J Natl Cancer Inst 1964; 32: 1221-8.
22. Friedrich D et al. Identification of prostate cancer cell nuclei for DNA-grading of malignancy. Bildverarbeitung für die Medizin. Springer Berlin Heidelberg (2012) 334-339.
Prof. (em.) Dr. med. Alfred Böcking, FIAC
Institut für Cytopathologie am
Universitätsklinikum Düsseldorf,
jetzt:
Institut für Pathologie am Krankenhaus Düren
alfred.boecking[at]web[dot]de.
Dr. Jin Chen
Motic, Xiamen, PR.China
chenj[at]motic[dot]com.
Dr. David Friedrich
ehemals: Lehrstuhl für Bildverarbeitung
der RWTH Aachen,
jetzt:
Firma Definiens, München
dfriedrich[at]definiens[dot]com.
Prof. (em.) Dr. Dietrich Meyer-Ebrecht
Lehrstuhl für Bildverarbeitung
der RWTH Aachen
meyer-ebrecht[at]rwth-aachen[dot]de.

