Für Patienten mit vorbehandeltem und möglicherweise refraktärem multiplem Myelom werden dringend neue Therapieoptionen gebraucht: Als erster Vertreter der Klasse der Inhibitoren von Histonacetylasen (HDAC) und als erste epigenetisch wirksame Substanz beim multiplen Myelom wurde nun der pan-HDAC-Inhibitor Panobinostat zugelassen [1, 2]. In der Zulassungsstudie PANORAMA-1 verlängerte Panobinostat in Kombination mit dem Proteasominhibitor Bortezomib das progressionsfreie Überleben von Patienten, die mindestens zwei Vorbehandlungen einschließlich Bortezomib und einer immunmodulatorischen Substanz erhalten hatten, um 7,8 Monate [3].
Das Multiple Myelom, so Hartmut Goldschmidt, Heidelberg, ist durch eine monoklonale Vermehrung von Plasmazellen im Knochenmark gekennzeichnet und fällt daher insbesondere durch eine vermehrte Produktion kompletter oder inkompletter monoklonaler Immunglobuline auf. Das klinische Bild ist vielgestaltig, oft unspezifisch und kann zum Beispiel durch Hyperkalzämie und Knochendestruktion mit dem Risiko für pathologische Frakturen sowie erhöhte Infektanfälligkeit und Niereninsuffizienz kompliziert werden. Häufige Symptome sind Fatigue, Knochenschmerzen und Gewichtsverlust [4].
Therapiert wird das Myelom heute – neben der autologen Stammzelltransplantation bei fitten Patienten – vor allem mit Proteasominhibitoren und immunmodulatorischen Substanzen. Trotz großer therapeutischer Fortschritte in den letzten Jahren weisen hohe Rezidivraten von über 90% nach Standardtherapien auf einen hohen Bedarf an neuen Therapieoptionen hin [4–6]. Patienten mit rezidiviertem oder rezidiviertem und refraktärem multiplem Myelom haben eine besonders ungünstige Prognose. Mit besonderen Erwartungen sehen die Hämatologen auf Medikamente mit neuartigem Wirkmechanismus, mit denen sich die Aktivität von Standardregimes verstärken lässt [6].
Die Wirkung von Panobinostat, so Hermann Einsele, Würzburg, beruht auf einer breiten Hemmung aller Klassen von Histondeacetylasen (HDAC), wodurch es an den Zielmolekülen zu einer verstärkten Acetylierung kommt. Durch diesen Eingriff in die epigenetische Zellprogrammierung, die beim Multiplen Myelom gestört ist und vermutlich die Expression von Tumorsuppressorgenen negativ beeinflusst, können HDAC-Inhibitoren zu einer Hemmung der Proliferation von Myelomzellen und zu ihrer Apoptose führen [7]. Außerdem scheint Panobinostat den Aggresom-Signalweg zu hemmen, wodurch es zu synergistischen Effekte in Kombination mit Proteasominhibitoren kommt [8]. Es gibt auch bereits klinische Daten, die belegen, dass sich HDAC-Inhibitoren besonders gut als Kombinationspartner für andere onkologische Therapeutika eignen könnten [9].
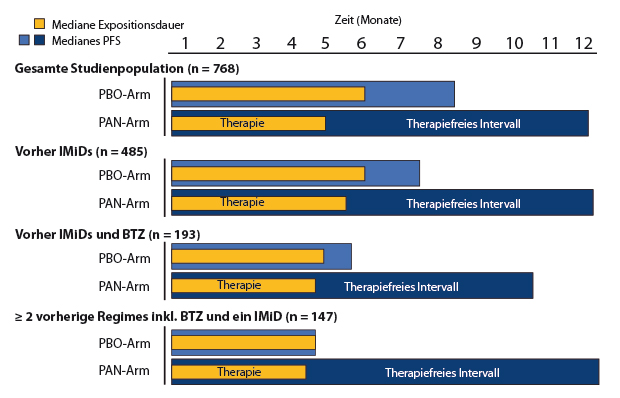
Die Zulassung von Panobinostat basiert wesentlich auf den Ergebnissen einer vorab geplanten Subgruppenanalyse [3] der randomisierten, doppelblinden Phase-III-Studie PANORAMA-1, in der 768 Patienten mit rezidiviertem oder rezidiviertem und refraktärem multiplem Myelom eine Zweier-Kombination aus Bortezomib und Dexamethason und dazu randomisiert entweder Panobinostat oder Placebo erhalten hatten [6]. Eine Gruppe von 147 Patienten hatte vor der Studientherapie mindestens zwei Vortherapien bekommen, darunter auch Bortezomib und einen Immunmodulator. Bei diesen Patienten wurde die mediane progressionsfreie Überlebenszeit durch Panobinostat im Vergleich zu Placebo von 4,7 auf 12,5 Monate, also um median 7,8 Monate verlängert (Hazard Ratio 0,47; 95%-Konfidenzintervall 0,31–0,72; [3]). Auch die Ansprechrate war unter Panobinostat mit 59% höher als unter Placebo (39%), ebenso die Rate an kompletten oder nahezu kompletten Remissionen (22% vs. 8%). Nach einer medianen Therapiedauer von 4,5 Monaten war für weitere median acht Monate kein Progress zu beobachten, d. h. während dieser Zeit benötigten die Patienten keine Therapie und wurden demzufolge auch nicht durch Arzneimittel-bedingte Nebenwirkungen belastet (Abb. 1; [3]). „Panobinostat kann demnach eine neue Therapieoption für Patienten mit rezidiviertem oder rezidiviertem und refraktärem multiplem Myelom sein", so das Resümee von Andreas Günther, Kiel, der als ärztlicher Leiter die klinische Prüfung von Panobinostat in Deutschland überwachte.
Das Verträglichkeitsprofil bei den stark vorbehandelten Patienten war vergleichbar mit dem in der Gesamtpopulation der PANORAMA-1-Studie [3, 6].
Die häufigsten nicht-hämatologischen Nebenwirkungen von Panobinostat sind gastrointestinaler Natur (Diarrhö, Fatigue, Übelkeit und Erbrechen). An hämatologischen Toxizitäten traten Thrombozytopenie, Anämie, Neutropenie und Lymphopenie auf. Zum Therapieabbruch führten Diarrhö (4,5%), Asthenie und Fatigue (jeweils 2,9%) sowie Pneumonie (1,3%; [10]). Mit einem Schweregrad 3 oder 4 traten am häufigsten Thrombozytopenien (67% Panobinostat vs. 31% Placebo), Lymphozytopenien (53% vs. 40%), Diarrhö (26% vs. 8%), Asthenie und Fatigue (24% vs. 12%) sowie periphere Neuropathien auf (18% vs. 15%; [3]). Die unerwünschten Ereignisse ließen sich in der Regel mit supportiven Maßnahmen gut beherrschen [11].
Bortezomib wurde in PANORAMA-1 zweimal wöchentlich intravenös verabreicht, so Günther, während heute in der Praxis wegen des besseren Sicherheitsprofils, v. a. des reduzierten Neuropathie-Risikos, die subkutane Gabe die Regel ist. Das könnte auch die Verträglichkeit der Kombination von Panobinostat mit Bortezomib und Dexamethason verbessern [6].
jfg
Literatur
1. Grønbæk K et al. Epigenetic changes in cancer as potential targets for prophylaxis and maintenance therapy. Basic Clin Pharmacol Toxicol 2008; 103: 389-96.
2. Maes K et al. Epigenetic modulating agents as a new therapeutic approach in multiple myeloma. Cancers 2013; 5: 430-61.
3. Einsele H et al. Subgroup analysis by prior treatment among patients with relapsed or relapsed and refractory multiple myeloma in the panorama 1 study of panobinostat or placebo plus bortezomib and dexamethasone. Haematologica 2015; 100 (s1): 1 (EHA 2015, Abstract #102).
4. DGHO Leitlinie Multiples Myelom. Online verfügbar unter www.onkopedia.com/de/onkopedia/guidelines/multiples-myelom/@@view/html/index.html. Letzter Zugriff am 10. September 2015.
5. Goldschmidt H et al. Strategien beim rezidivierten/refraktären multiplem Myelom. Onkologe 2014; 20: 250-6.
6. San-Miguel JF et al. Panobinostat plus bortezomib and dexamethasone versus placebo plus bortezomib and dexamethasone in patients with relapsed or relapsed and refractory multiple myeloma: A multicentre, randomised, double-blind phase 3 trial. Lancet Oncol 2014; 15: 1195-206.
7. Malek NP et al. Neue Medikamente in der Onkologie. Internist 2014; 55: 359-66.
8. Hideshima T et al. Mechanism of action of proteasome inhibitors and deacetylase inhibitors and the biological basis of synergy in multiple myeloma. Mol Cancer Ther 2011; 10: 2034-42.
9. Qiu T et al. Effects of treatment with histone deacetylase inhibitors in solid tumors: A review based on 30 clinical trials. Future Oncol 2013; 9: 255-69.
10. Novartis data on file.
11. Richardson PG et al.: PANORAMA 2: Panobinostat in combination with bortezomib and dexamethasone in patients with relapsed and bortezomib-refractory myeloma. Blood 2013; 122: 2331-7.
12. Fachinformation Farydak®; Stand: August 2015.
Zulassungs-Pressekonferenz „Farydak® − die neue Therapieoption beim Multiplen Myelom" am 15.9.2015 in Frankfurt am Main, veranstaltet von Novartis Pharma GmbH, Nürnberg.

