Tyrosinkinaseinhibitoren (TKI) der zweiten Generation wie Nilotinib sind den Substanzen der ersten Generation überlegen, was Tiefe der Remission, klinische Wirksamkeit und Verträglichkeit in der Therapie der chronischen myeloischen Leukämie (CML) betrifft. Sie bieten deshalb die Möglichkeit, in Zukunft bei einem Teil der Patienten, die sehr gut ansprechen, die TKI-Therapie dauerhaft abzusetzen.
Wie Prof. Dietger Niederwieser, Leipzig, ausführte, gehört die Therapie der CML zu den erfolgreichsten Entwicklungen der Krebsmedizin in den letzten Jahrzehnten. Mit dem 1953 in die Therapie eingeführten Busulfan ließ sich eine 10-Jahres-Überlebensrate von 11% erreichen. Diese nahm mit Einführung neuer Substanzen bzw. Therapien wie Hydroxyurea (1964), Stammzelltransplantation (1975) und Interferon-alpha (1983) in der Folgezeit Schritt für Schritt zu.
Prävalenz steigt, weil die meisten Patienten lange überleben
Erst mit dem Erstgenerations-TKI Imatinib (Zulassung 2001) wurde die Therapie mit einer 10-Jahres-Überlebensrate von 84% wirklich erfolgreich. Mit der Zweitgenerationssubstanz Nilotinib (Tasigna®) werden 90% überschritten. Die Folge dieser Entwicklung ist, dass die Prävalenz der CML derzeit jedes Jahr um 20-25% steigt, weil die Patienten nicht mehr sterben, sondern mit ihrer chronischen Krankheit sehr lange leben, betonte Prof. Thoralf Lange, Weißenfels/Leipzig.
Bisher erhalten die Patienten dazu allerdings eine Dauertherapie mit TKI. Dies könnte sich in Zukunft ändern, so Lange. Zumindest bei etwa einem Viertel der Patienten dürfte es möglich sein, die Therapie ganz abzusetzen. Dies erscheint aus einer Reihe von Gründen attraktiv: Zum Beispiel können TKI chronische, niedriggradige Nebenwirkungen wie z. B. eine Schwellung der Tränensäcke verursachen, die die Lebensqualität beeinträchtigen. Außerdem wird mit zunehmendem Alter der Patienten das Thema Wechselwirkungen immer relevanter, und TKI können während Schwangerschaft und Stillzeit nicht eingenommen werden. Schließlich bedeutet eine lebenslange Therapie auch einen enormen Kostenfaktor.
Langfristige Remission ohne TKI erscheint möglich
Aussichtsreich erscheint ein Absetzen erst, wenn eine tiefe molekulare Remission auf eine BCR-ABL-Konzentration von unter 0,01% (eine Reduktion um 4 log-Stufen, MR4) erreicht ist. Das ist eine log-Stufe mehr als eine gute molekulare Remission (Major Molecular Response, MMR, d. h. eine Abnahme der BCR-ABL-Transkripte auf weniger als 0,1%; Abb. 1). Mit Nilotinib erreicht etwa jeder zweite Patient mindestens eine MR4, wie Lange hervorhob. Derzeit wird mit der Substanz auch eine Reihe von Absetzstudien durchgeführt.
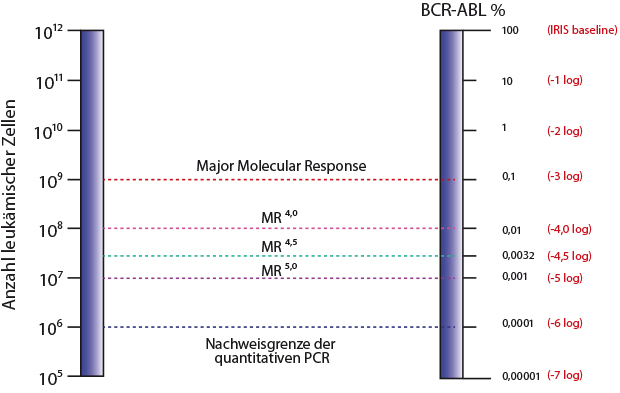
Standardisiertes molekulares Monitoring erforderlich
Eine wesentliche Voraussetzung für die Umsetzung solcher Konzepte stellt das molekulare Monitoring dar – zum einen für die korrekte Auswahl der Patienten, zum anderen in der Nachsorge nach dem Absetzen. Macht sich ein molekulares Rezidiv mit Wiederanstieg der Transkripte bemerkbar, kann das nachfolgende hämatologische Rezidiv durch eine erneute Therapie abgefangen werden, erläuterte Dr. Georg-Nikolaus Franke, Leipzig. Außerhalb von kontrollierten Studien wird ein Absetzen der Therapie derzeit noch nicht empfohlen.
Als sensitivste Methode ist derzeit die quantitative Realtime-PCR im Einsatz. Ihre Nachweisgrenze liegt etwa bei einem Anteil an BCR-ABL-Transkripten von fünf bis sechs Logstufen (MR5 bis MR6 = 0,001% bis 0,0001%). Doch nur die Messergebnisse von Laboren mit Standardisierung sind vergleichbar und zuverlässig genug für die weitreichende Entscheidung, die Therapie abzusetzen. Zertifizierte Speziallabore mit Standardisierung für die CML-Diagnostik gibt es aber nur wenige in Deutschland. Eines davon befindet sich am Universitätsklinikum Leipzig.
Angelika Bischoff
Laborworkshop zur chronischen myeloischen Leukämie (CML) am 10.9.2015 in Leipzig, veranstaltet von Novartis Oncology, Nürnberg.

