Neues zu Leukämien
ASCO/EHA/ICML 2015
Gegenüber Lymphomen und Multiplem Myelom waren die Ergebnisse im Leukämie-Bereich bei ASCO- und EHA-Kongress dieses Jahr nicht so aufsehenerregend. Interessantes gabe es trotzdem, zum Beispiel scheint sich das Immuntoxin Inotuzumab Ozogamicin einen Platz in der Therapie der ALL zu erobern. Bei der CLL gibt es einen neuen Prognoseindex, und hier macht die Anwendung der neuen Inhibitoren des B-Zell-Rezeptor-Signalwegs auch in Kombinationen Fortschritte.
ALL
Immuntoxin auch bei akuten Leukämien hochwirksam
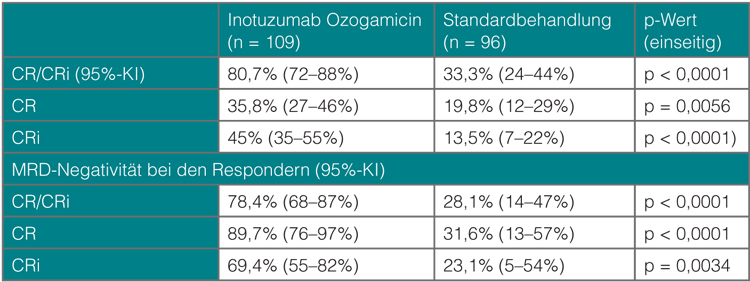
Bei den meisten Patienten mit akuter lymphatischer Leukämie (ALL) exprimieren die Blasten das CD22-Antigen, gegen das das Immuntoxin Inotuzumab Ozogamicin gerichtet ist – ein humanisierter CD22-Antikörper, an den das Zytostatikum Calicheamicin gekoppelt ist. In einer Phase-II-Studie hatte es bei erwachsenen Patienten mit rezidivierter und refraktärer ALL in Monotherapie gute Wirksamkeit und Verträglichkeit auch bei mehrmaliger Anwendung im Wochenabstand gezeigt. In einer auch in Deutschland durchgeführten Phase-III-Studie wurde es daher randomisiert mit einer Standardtherapie (Fludarabin/Cytarabin, Cytarabin/Mitoxantron oder Hochdosis-Cytarabin) verglichen [1]. Die Daten zum ersten primären Endpunkt, dem kompletten Ansprechen mit (CR) oder ohne vollständige hämatologische Erholung (CRi), präsentierte beim EHA-Kongress in Wien Daniel DeAngelo, Boston: Inotuzumab Ozogamicin war dabei der Standardbehandlung weit überlegen, ebenso, was das Erreichen einer MRD-Negativität bei den Respondern betraf (Tab. 1). Auch die mediane Dauer der Remissionen war im Inotuzumab-Arm signifikant länger (4,6 versus 3,1 Monate; Hazard Ratio 0,55; p = 0,0169).
Das Sicherheitsprofil des Immunkonjugats entsprach den bisherigen Erfahrungen; am häufigsten waren Zytopenien, aber auch hepatobiliäre Toxizitäten und Venenverschlüsse (VOD) traten im experimentellen Arm deutlich häufiger auf. Hier konnten mehr als doppelt so viele Patienten wie im Kontrollarm eine allogene Stammzelltransplantation erhalten (n = 48 vs. n = 20). Von den 15 Fällen von Venenverschluss in der experimentellen Gruppe traten fünf während der medikamentösen Behandlung und zehn nach der Transplantation auf; zwei davon waren tödlich. Die häufigeren Toxizitäten müssen auch unter dem Aspekt gesehen werden, dass die Patienten im experimentellen Arm median drei Behandlungszyklen erhielten, die im Kontrollarm nur einen.
Die Daten zum ersten primären Endpunkt Ansprechen (einschließlich MRD-Negativität) sind sehr vielversprechend und könnten bedeuten, dass mit Inotuzumab Ozogamicin eine neue Therapieoption für Patienten mit rezidivierter und refraktärer ALL zur Verfügung steht. Abzuwarten bleiben die Überlebensdaten, deren Auswertung noch auf sich warten lässt.
Auch ältere Patienten profitieren von Inotuzumab Ozogamicin
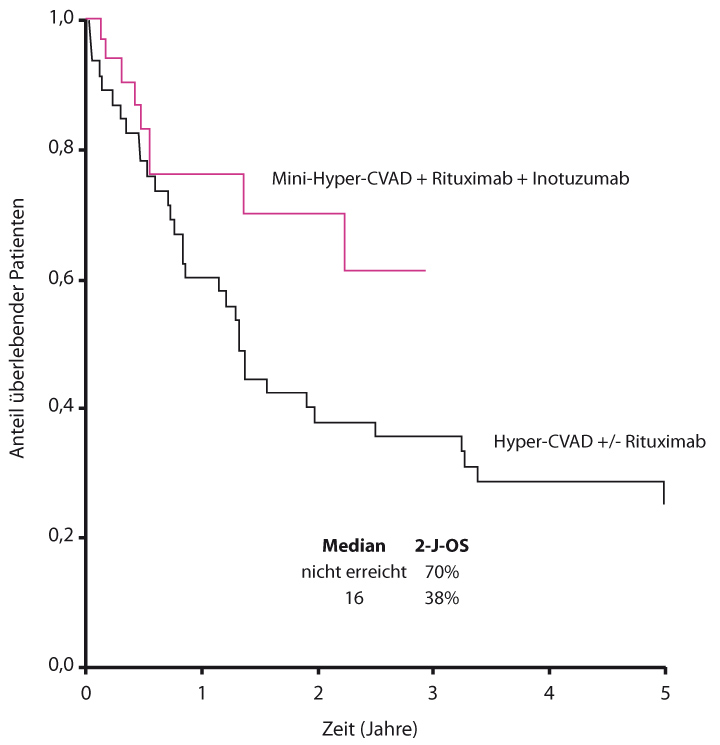
Ältere Patienten haben wie fast überall auch bei der ALL eine deutlich schlechtere Prognose, weil sie intensive Chemotherapien meist nicht mehr gut tolerieren. Hier könnte die zielgerichtete Applikation einer Chemotherapie direkt auf die leukämischen Zellen, wie Inotuzumab Ozogamicin sie ermöglicht, zu Fortschritten führen. Kollegen am M. D. Anderson Cancer Center in Houston und an der University of California in Irvine behandelten in einer Phase-II-Studie bisher 33 Patienten im medianen Alter von 69 Jahren mit einem Dosis-reduzierten Hyper-CVAD-Regime (Mini-Hyper-CVAD) und während der ersten vier Zyklen zusätzlich mit Rituximab und einer intrathekalen Chemotherapie. Außerdem erhielten sie pro Zyklus eine Dosis Inotuzumab Ozogamicin [2].
Von den 30 auswertbaren Patienten, so Elias Jabbour, Houston, erzielten 29 mit dieser Behandlung eine komplette Remission, davon fünf mit unvollständiger Wiederherstellung der Thrombozytenzahlen. Alle Patienten mit kompletter Remission wurden auch MRD-negativ, wobei die MRD mittels Durchflusszytometrie gemessen wurde. Beim letzten Nachbeobachtungstermin waren 24 Patienten (73%) am Leben, davon 23 in kompletter Remission. Im Vergleich mit einer historischen Kohorte von 46 älteren ALL-Patienten, die Hyper-CVAD mit oder ohne Rituximab erhalten hatten, schnitten die Patienten mit einer 2-Jahres-Überlebensrate von 70% gegenüber 38% sehr gut ab; der Unterschied war mit p = 0,06 nicht ganz signifikant (Abb. 1).
Die Verträglichkeit war akzeptabel mit lediglich zwei Venenverschlüssen vom Grad 2, und Inotuzumab Ozogamicin in Ergänzung eines Intensitäts-reduzierten Chemotherapie-Protokolls könnte sich angesichts solcher Resultate zu einem neuen Standard für ältere ALL-Patienten entwickeln.
Bispezifischer Antikörper bei Älteren genauso wirksam wie bei Jüngeren
Eine weitere neue Therapie für Patienten mit fortgeschrittener ALL, die kurz vor der Zulassung steht, ist der bispezifische Antikörper Blinatumomab, der sowohl das CD19-Antigen auf B-Zellen als auch CD3 auf T-Lymphozyten bindet und beide Zellen dadurch in so engen Kontakt bringt, dass die
T-Zelle die leukämischen Blasten hocheffizient abtöten kann. Dieses Medikament hat in zwei Phase-II-Studien mit Erwachsenen mit rezidivierter oder refraktärer B-Precursor-ALL zu 69% bzw. 43% kompletten Remissionen mit oder ohne vollständige hämatologische Erholung geführt. Dass die Behandlung auch für ältere, d. h. über 65-Jährige die gleiche Wirksamkeit zeigt, ergab eine Subgruppenanalyse, die Hagop Kantarjian, Houston, in Wien vorstellte [3]: Über die Hälfte der 36 älteren Patienten (56%) kam unter dem T-Cell-Engager in eine komplette Remission, zwölf davon wurden sogar MRD-negativ. Nach median rund 30 Monaten Nachbeobachtung sind zehn Patienten (28%) am Leben, sechs davon in anhaltender Remission. Die Wirksamkeit von Blinatumomab war damit bei den älteren Patienten ähnlich gut wie im Gesamtkollektiv, und das bei vergleichbarer Verträglichkeit.
CLL
Ein neuer Prognoseindex für die CLL
Um die Prognose von Patienten mit chronischer lymphatischer Leukämie (CLL) zu beurteilen, werden seit Jahrzehnten die Staging-Systeme nach Rai (überwiegend in den USA) und Binet (vor allem in Europa) angewendet. Nach Einführung von immer mehr neuen wirksamen Therapien in den letzten Jahren darf man annehmen, dass die prognostische Differenzierung der Patienten damit nicht mehr ausreichend gut ist. Die Anzahl klinischer, biologischer und genetischer Prognosemarker ist bei der CLL groß, aber es gibt bisher kein allgemein akzeptiertes Scoring-System wie etwa die verschiedenen internationalen Indizes bei Non-Hodgkin-Lymphomen (IPI, FLIPI, MIPI etc.). Die Deutsche CLL-Studiengruppe hat daher in einem internationalen Kooperationsprojekt mit einer Reihe von anderen Studiengruppen einen „International Prognostic Index“ für die CLL (CLL-IPI) entwickelt und in Chicago und beim Lymphom-Kongress in Lugano erstmals vorgestellt [4, 5].
Anhand der Daten von 3.472 Patienten, die an acht Phase-III-Studien in Frankreich, Deutschland, Großbritannien, den USA, Skandinavien und Polen teilgenommen haben, wurden 26 verschiedene Prognosefaktoren analysiert. Das mediane Alter der Patienten lag bei 61 Jahren, die mediane Beobachtungszeit der Überlebenden in den Studien bei 80 Monaten. Das gesamte Kollektiv wurde randomisiert etwa im Verhältnis 2:1 in eine Trainings- und eine interne Validierungs-Kohorte unterteilt. Hauptendpunkt bei der Auswertung mit multivariaten statistischen Methoden, so Nadine Kutsch, Köln, war das Gesamtüberleben.
In der Trainings-Kohorte wurden fünf unabhängige Prädiktoren für ein schlechteres Überleben identifiziert: ein Alter von über 65 Jahren (Hazard Ratio 1,7), das klinische Stadium (Binet B/C bzw. Rai I-IV; HR 1,6), das Vorliegen
einer 17p-Deletion und/oder einer TP53-Mutation (HR 4,2), unmutiertes IGHV (HR 2,6) und die Konzentrationen von β2-Mikroglobulin (> 3,5 mg/l; HR 2,0). Im finalen multivariaten Modell wurden die beiden ersten Risikofaktoren mit je einem, die beiden letzten mit je zwei und der zytogenetische Faktor mit vier Punkten gewichtet, sodass man jedem Patienten einen prognostischen Score zuteilen kann, der zwischen 0 und 10 Punkten variieren kann (Abb. 2 links). Daraus lassen sich vier Risikogruppen bilden: niedriges Risiko (0–1 Punkte), intermediäres (2–3 Punkte), hohes Risiko (4–6 Punkte) und sehr hohes Risiko
(7–10 Punkte; s. Abb. 2 links).
Dass diese Einteilung klinisch relevant ist und tatsächlich zwischen prognostisch unterschiedlichen Gruppen diskriminieren kann, zeigen die 5-Jahres-Überlebensraten, die für die vier so definierten Gruppen im Trainings-Set bei 93%, 79%, 64% und 23% lagen (p < 0,001 gegenüber der jeweils nächstniedrigeren Risikogruppe). In der internen Validierungs-Kohorte konnte dies ebenso bestätigt werden wie in einer zusätzlichen externen Kohorte von 845 Patienten mit neu diagnostizierter CLL von der Mayo Clinic in Rochester: Dort lagen die 5-Jahres-Überlebensraten für die vier Risikogruppen bei 97%, 91%, 68% und 21% (p < 0,001).
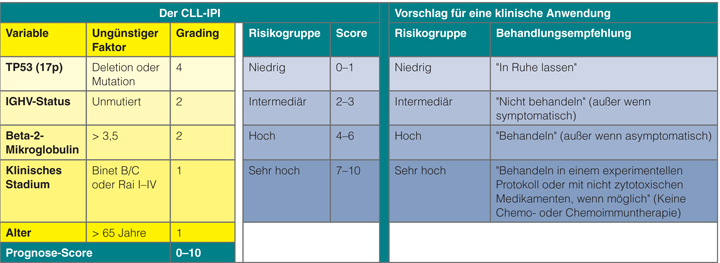
Abgesehen davon, dass diese Klassifikation sich natürlich für die Stratifizierung von CLL-Patienten in klinischen Studien eignet, lässt sie sich auch in der täglichen Praxis anwenden (Abb. 2 rechts): Patienten in der Niedrigrisiko-Gruppe sollte man „in Ruhe lassen“ („Do not touch“), Patienten mit intermediärem Risiko ebenfalls nicht behandeln, solange sie nicht symptomatisch sind („Do not treat“), während diejenigen in der Hochrisiko-Gruppe auf jeden Fall einer Behandlung bedürfen („Treat“), zumindest dann, wenn sie nicht asymptomatisch sind. Patienten in der Gruppe mit sehr hohem Risiko sollten keine Chemo- oder Chemoimmuntherapie erhalten, weil sie darauf mutmaßlich nicht ansprechen werden, sondern sie sollten, wenn möglich, mit den neuen, nicht-zytotoxischen Medikamenten behandelt oder am besten in eine der vielen derzeit laufenden klinischen Studien mit neuen Therapiekonzepten eingeschlossen werden.
Ibrutinib in Kombination mit Chemoimmuntherapie
Die CLL ist nach wie vor nicht heilbar, daher ist das Ziel einer Rezidivtherapie die Krankheitskontrolle und das Erreichen einer möglichst lang andauernden Remission. Eine bisherige Standardtherapie in dieser Situation ist die Immunchemotherapie aus Bendamustin und dem CD20-Antikörper Rituximab, aber im letzten Jahr sind neue Substanzklassen in der CLL-Therapie auf den Plan getreten, darunter Inhibitoren des vom B-Zell-Rezeptor ausgehenden Signalübertragungswegs, der bei B-Zell-Lymphomen generell und auch bei der CLL eine wichtige Rolle spielt. Ibrutinib beispielsweise, ein Inhibitor der Bruton-Tyrosinkinase (Btk) wird in der NCCN-Leitlinie als bevorzugte Therapie in der rezidivierten Situation empfohlen. In der Phase-III-Studie HELIOS wurde er daher mit Bendamustin plus Rituximab (BR) kombiniert und randomisiert mit der alleinigen Gabe von BR verglichen [6].
Die 587 eingeschlossenen Patienten mit vorbehandelter CLL oder kleinem lymphozytischem Lymphom (SLL) erhielten maximal sechs Zyklen BR und dazu randomisiert und beginnend an Tag 2 des ersten Zyklus entweder 420 mg/d Ibrutinib oder Placebo, so Asher Chanan-Khan, Jacksonville. Ibrutinib ebenso wie Placebo wurden kontinuierlich bis zu einer Krankheitsprogression oder bis zum Auftreten inakzeptabler Toxizitäten gegeben. War ein Patient in der Placebogruppe progredient, so konnte er in einem in der Studie vorgesehenen Crossover-Design Ibrutinib erhalten.
Primärer Endpunkt war das progressionsfreie Überleben, und hier war die Ibrutinib-Kombination nach median 17 Monaten Follow-up deutlich und hochsignifikant überlegen: Der Medianwert war noch nicht erreicht, während er im Kontrollarm bei 13,3 Monaten lag. Die Hazard Ratio lag mit 0,203 so tief wie man es in kontrollierten Studien nur selten zu sehen bekommt, d. h. das Risiko für Progression oder Tod war durch die Zugabe von Ibrutinib um rund 80% reduziert worden
(p < 0,0001).
Auch bei den Ansprechraten war der Ibrutinib-Arm mit 82,7% versus 67,8% signifikant überlegen, und der Vorteil beim Gesamtüberleben verfehlte mit einer Hazard Ratio von 0,63, d. h. einer Risikoreduktion um 37% und einem p-Wert von 0,0598 die statistische Signifikanz nur knapp; dabei muss man berücksichtigen, dass 90 Patienten aus der Kontrollgruppe (31%) bereits von der Crossover-Option Gebrauch gemacht hatten, wodurch ein Überlebensvorteil durch Ibrutinib statistisch verwässert werden dürfte.
Das Sicherheitsprofil von Ibrutinib plus BR deckte sich mit den bekannten Nebenwirkungen der drei Substanzen: Die häufigsten Toxizitäten bestanden in Zytopenien, Übelkeit und Diarrhö. Die HELIOS-Studie ist damit die zweite Phase-III-Studie nach der RESONATE-Studie, in der Ibrutinib bei Patienten mit rezidivierter CLL das Rezidivieren einer vorbehandelten CLL/SLL-Erkrankung hochsignifikant hinauszögern kann.
Chronische myeloproliferative Erkrankungen
Zweitgenerations-BCR-ABL-Inhibitor bei CML deutlich überlegen
Die chronische myeloische Leukämie steht als Mustererkrankung nicht umsonst für einen der größten Erfolge der modernen Onkologie: Weil sie im Wesentlichen durch einen einzelnen Gendefekt (die BCR-ABL-Fusion) bedingt ist und die Zellen eine vergleichsweise geringe Mutationstendenz aufweisen, ist die Therapie mit BCR-ABL-Tyrosinkinaseinhibitoren langfristig so erfolgreich wie bei kaum einer anderen Krebserkrankung. Allerdings gibt es auch hier Weiterentwicklungen: Zweit-Generations-Inhibitoren wie Nilotinib und Dasatinib zeigen in den Zulassungsstudien auch nach Jahren eine deutlich höhere Wirksamkeit als die Vorgängersubstanz Imatinib – etwa Nilotinib in der ENESTnd-Studie, deren 6-Jahres-Resultate Timothy Hughes, Adelaide, beim EHA-Kongress in Wien vorstellte [7]: Unter zweimal 300 mg/d Nilotinib zeigten sich im Vergleich zu 400 mg/d Imatinib hochsignifikant höhere Raten an guten molekularen Remissionen, d. h. BCR-ABL-Werte ≤0,1% (77,3% versus 61%;
p < 0,0001), an besonders tiefen molekularen Remissionen (MR4,5, d. h. BCR-ABL ≤ 0,0032%: 55,7% vs. 32,9%;
p < 0,0001) und niedrigere Progressionsraten zu akzelerierter Phase bzw. Blastenkrise.
In allen Studienarmen war ein früher Abfall der BCR-ABL-Konzentrationen nach drei Monaten Therapie auf unter 1% nach dem internationalen Standard prädiktiv für ein späteres tiefes molekulares Ansprechen: Sie hatten nach sechs Jahren deutlich höhere Raten an MR4,5 (73,6% unter zweimal
300 mg/d Nilotinib bzw. 72,1% unter 400 mg/d Imatinib) gegenüber vor allem denjenigen, deren Titer nach drei Monaten noch über 10% gelegen hatten (8,3% bzw. 15,9%). Auch nach sechs Jahren bestätigte sich, dass deutlich mehr Patienten in den beiden Nilotinib-Armen Eine MR4,5 erreicht hatten (56% bzw. 55%) als im Imatinib-Arm (33%). Eine solche tiefe molekulare Remission ist aber eine Voraussetzung für die Teilnahme an Studien, in denen das kontrollierte Absetzen der Medikation und das Halten einer „therapiefreien Remission“ erprobt wird.
Ähnliches gilt für den anderen Zweitgeneration-BCR-ABL-Inhibitor Dasatinib: In der SPIRIT-2-Studie wurden bei über 800 Patienten mit neu diagnostizierter CML 100 mg/d Dasatinib mit 400 mg/d Imatinib verglichen [8]. Nach gut drei Jahren, so Stephen O´Brien, Newcastle, hatten deutlich mehr Patienten im Imatinib-Arm wegen suboptimalen Ansprechens die Therapie beendet (10,3% vs. 0,7% unter Dasatinib). Unter dem Zweitgenerations-Inhibitor hatten signifikant mehr Patienten nach einem Jahr eine gute molekulare Remission (MR3, d. h. BCR-ABL ≤ 0,1%) erreicht als mit Imatinib (58,4% vs. 43,1%; p < 0,001), aber bei den Progressionsraten und beim Gesamtüberleben ist bisher kein signifikanter Unterschied zwischen beiden Gruppen zu erkennen.
Optimierung des Therapiemanagements
Das Ziel einer tiefen molekularen Remission – die Voraussetzung für die Teilnahme an Absetzstudien – können manche Patienten bereits mit dem Erstgenerations-TKI Imatinib erreichen; das hat sich zum Beispiel in der STIM- und der TWISTER-Studie gezeigt. Eine größere Chance, bereits in der Erstlinientherapie in eine tiefe Remission zu kommen, hat man aber mit Zweitgenerations-Inhibitoren, und diese Ergebnisse können offenbar durch zunehmende Erfahrung in der Praxis und ein optimiertes Therapiemanagement noch verbessert werden, wie die finale Auswertung der ENEST1st-Studie zeigt, die Andreas Hochhaus, Jena, in Wien präsentierte [9].
In der einarmigen Studie hatten 1.089 Patienten mit CML in der chronischen Phase, die vorher höchsten drei Monate lang mit Imatinib behandelt worden waren, Nilotinib in der Standarddosierung von zweimal täglich
300 mg erhalten. Nach 18 Monaten hatte beinahe jeder zweite Patient (48%) mindestens eine MR4 erreicht, bei 32% war es sogar eine MR4,5; nach zwei Jahren waren mehr als die Hälfte der Patienten (55,2%) in einer MR4. Progressionen zu akzelerierter Phase oder Blastenkrise waren mit sechs Fällen (0,6%) sehr selten.
Interessant ist ein Vergleich zwischen ENESTnd (Rekrutierung zwischen 2007 und 2008) und ENEST1st (Rekrutierung zwischen 2010 und 2012), den Hochhaus anstellte: Der Anteil der Patienten, die nach zwölf Monaten eine gute molekulare Remission (MMR) erreicht hatten, war in ENEST1st mit 69% deutlich höher als in ENESTnd mit dem Zweitgenerations-Inhibitor (55%); ähnliches galt für eine MR4,5 nach einem Jahr (21% vs. 11%). Die zunehmende Erfahrung mit der Gabe der neueren Medikamente, so Hochhaus, scheint also mit einer Optimierung des Therapiemanagements und dadurch auch mit noch besseren Resultaten assoziiert zu sein. Die Ergebnisse stützen die Gabe von Zweitgenerations-Inhibitoren als Erstlinientherapie bei Patienten mit neu diagnostizierter CML in der chronischen Phase.
BCR-ABL-Mutationen: Next Generation Sequencing geeignet
Punktmutationen in der Kinasedomäne des BCR-ABL-Fusionsproteins sind die häufigsten Ursachen für die Entwicklung einer Resistenz gegen Tyrosinkinaseinhibitoren (TKI). Das Mutations-Screening erfolgt bisher routinemäßig per Sanger-Sequenzierung, aber Methoden des Next Generation Sequencing (NGS) sind in rascher Entwicklung begriffen und werden von immer mehr diagnostischen Labors angewendet. Die Zuverlässigkeit der Anwendung in verschiedenen Labors wurde jetzt in einem europäischen Ringversuch getestet [10]. Jedes von elf Labors in sieben europäischen Ländern erhielt 22 verblindete Kontrollproben, von denen jeweils 17 Zellen mit unterschiedlichen Konzentrationen von zwölf verschiedenen BCR-ABL-Mutationen zusammen mit nicht mutierten Genen enthielten; die übrigen fünf Proben waren mit nicht mutierten Kinase-Genen versetzt, so Thomas Ernst, Jena, beim EHA-Kongress.
203 der insgesamt 242 Proben wurden korrekt bestimmt (84%). Dabei zeigten neun Labors ausgezeichnete Leistungen mit der korrekten Identifizierung von 21 der 22 Proben in zwei Labors; zwei weitere Labors bestimmten 20 und fünf Labors 19 Proben richtig. Darin waren auch neue Mutationen enthalten, die in der Natur bisher nicht aufgetreten sind, sowie in fünf Fällen Mutationen mit einer Konzentration von weniger als 20% der Allele. Auch bei der Quantifizierung der mutierten Allele war die Konkordanz hoch, und alle Proben, die keine Mutationen enthielten, wurden von sämtlichen Labors korrekt identifiziert.
Dieser Ringversuche zeigt, dass Amplicon-basiertes Deep Sequencing in multiplen Laboratorien technisch machbar und mit einer hohen Konkordanz-Rate assoziiert ist. Expertise in NGS und in der Charakterisierung von BCR-ABL-Mutationen ist allerdings notwendig, um korrekte Ergebnisse zu erhalten.
Polycythaemia vera: Ruxolitinib auch nach 80 Wochen wirksam
Der JAK1/2-Inhibitor Ruxolitinib ist bei der Polycythaemia vera einer herkömmlichen Therapie überlegen, wie die ersten Ergebnisse der Phase-III-Studie RESPONSE gezeigt haben. Die 80-Wochen-Daten, die in Wien präsentiert wurden, belegen eine deutliche Besserung von Symptomatik und Lebensqualität [11]. Primärer Endpunkt der Studie, in der die Patienten randomisiert entweder Ruxolitinib (zweimal 10 mg/d) oder die beste sonst verfügbare Therapie erhalten hatten, war eine Kombination aus der Kontrolle des Hämatokrits und einer Reduktion des Milzvolumens um mindestens 35%, so Jean-Jacques Kiladjian, Paris. Diesen Endpunkt hatten 22,7% der Patienten in der Verum-, aber nur 0,9% in der Kontrollgruppe erreicht (Odds Ratio 28,64; p < 0,0001). Bei den einzelnen Komponenten des primären Endpunkts war die Überlegenheit des JAK-Inhibitors noch ausgeprägter: 40% der Patienten im Ruxolitinib-Arm, aber nur 0,9% derer im Kontrollarm erzielten eine mindestens 35%ige Verkleinerung der Milz, der Hämatokrit konnte bei 60% versus 20% der Patienten kontrolliert werden. 84,5% der Patienten im Verum-Arm nahmen nach mindestens 80 Wochen (median 111 Wochen) noch Ruxolitinib ein, in der Kontrollgruppe wurde kein einziger Patient mehr mit der ursprünglich eingesetzten Therapie behandelt. Von den 98 Patienten, die nach 32 Wochen noch Ruxolitinib erhalten hatten, benötigten 89,8% bis zur 80. Woche keine Phlebotomie.
Die Behandlung mit Ruxolitinib verbesserte Symptome und Lebensqualität, gemessen mit dem EORTC QLQ-C30-Fragebogen, deutlich und anhaltend in sämtlichen Domänen, während sie unter der Kontrollbehandlung bestenfalls gleich blieben, sich in vielen Fällen sogar verschlechterten.
Literatur
1. DeAngelo D et al. EHA 2014, Abstract #LBA2097.
2. Jabbour E et al. Haematologica 2015; 100 (s1): 7 (EHA 2015, Abstract S114).
3. Kantarjian H et al. Haematologica 2015; 100 (s1): 8 (EHA 2015, Abstract S115).
4. Kutsch N et al. J Clin Oncol 2015; 33 (15S): 374s (ASCO 2015, Abstract #7002).
5. Bahlo J et al. Hematol Oncol 2015; 33 (Suppl 1): 127-8 (ICML 2015, Abstract #054).
6. Chanan-Khan A et al. J Clin Oncol 2015; 33 (15S): 375s (ASCO 2015, Abstract #7005).
7. Hughes TP et al. Haematologica 2015; 100 (s1): 61 (EHA 2015, Abstract #S228).
8. O´Brien S et al. Haematologica 2015; 100 (s1): 182 (EHA 2015, Abstract #S489).
9. Hochhaus A et al. Haematologica 2015; 100 (s1): 180-1 (EHA 2015, Abstract #S486).
10. Ernst T et al. Haematologica 2015; 100 (s1): 326 (EHA 2015, Abstract #S814).
11. Kiladjian JJ et al. Haematologica 2015; 100 (s1): 161 (EHA 2015, Abstract #S447).

Prof. Dr. med. Karl-Anton Kreuzer
Klinik I für Innere Medizin
Universitätsklinikum Köln
Kerpener Straße 62
50937 Köln
+49 221 47897626
+49 221 47897627
karl-anton.kreuzer[at]uni-koeln[dot]de
Artikel als PDF downloaden.

