Neues zum Multiplen Myelom
ASCO/EHA
Die Entwicklung in der onkologischen Therapie scheint manchmal in Wellen vor sich zu gehen: Zu bestimmten Zeiten stehen bestimmte Tumorentitäten oder Wirkmechanismen ganz besonders auf der Tagesordnung, derzeit zum Beispiel die Checkpoint-Inhibitoren, die überwiegend bei soliden Tumoren erprobt und eingeführt werden. Auch beim Multiplen Myelom ist gerade eine sehr aktive Zeit angebrochen: Neue Substanzklassen wie die Histondeacetylase-Inhibitoren, Zweitgenerations-Proteasominhibitoren, und – endlich auch beim Myelom – monoklonale Antikörper beherrschten das Feld bei den Jahrestagungen der ASCO in Chicago und der EHA in Wien.
Histondeacetylase-Inhibitor bei stark vorbehandelten Patienten
In der Phase-III-PANORAMA-1-
Studie hatte der Pan-Deacetylase-Inhibitor Panobinostat in Kombination mit Bortezomib und Dexamethason bei Patienten mit rezidiviertem und/oder refraktärem multiplem Myelom die mediane progressionsfreie Überlebenszeit gegenüber Bortezomib/Dexamethason alleine um rund vier Monate signifikant verlängert. Beim EHA-Kongress in Wien stellte Hermann Einsele, Würzburg, die Ergebnisse von Subgruppenanalysen vor, die belegen, dass diese Wirkung unabhängig von der Art der Vorbehandlung ist, dass aber die Tiefe des Ansprechens auch dessen Dauer bestimmt [1]:
So war beim medianen progressionsfreien Überleben ebenso wie beim Ansprechen inklusive Komplettremissionen die Kombination mit Panobinostat in jedem Fall überlegen, egal welche Therapien die Patienten vorher erhalten hatten. Die Verlängerung des progressionsfreien Überlebens lag bei denjenigen, die in der Vortherapie einen Immunmodulator mit oder ohne Bortezomib bekommen hatten, bei beinahe fünf Monaten, bei denen, die mindestens zwei Vortherapien und dabei Substanzen aus diesen beiden Klassen erhalten hatten, war sie mit fast acht Monaten (12,5 vs. 4,7 Monate) noch ausgeprägter (Hazard Ratio 0,47; 95%-Konfidenzintervall 0,32–0,72). Von dem Histondeacetylase-Inhibitor profitieren also insbesondere die Patienten, die gegen die bisher modernsten Myelom-Medikamente resistent geworden sind.
In einer weiteren Analyse der Daten der PANORAMA-1-Studie fand Philip Moreau, Nantes, dass mehr Patienten unter Panobinostat als im Placebo-Arm eine komplette (CR) oder eine beinahe komplette Remission (nCR) erreichten (27,6% vs. 15,7%; p = 0,00006; [2]). Bei diesen Patienten war die Dauer des Ansprechens im Panobinostat-Arm gegenüber dem Placebo-Arm verlängert (median 18,4 vs. 14,5 Monate), ebenso bei denen mit sehr guter partieller Remission (13,1 vs. 10,9 Monaten); bei Patienten mit einfacher partieller Remission war hingegen keine Überlegenheit zu erkennen (9,0 vs. 8,8 Monate). Das, so Moreau, spricht entschieden dafür, in der Therapie des multiplen Myeloms auf das Erreichen möglichst tiefer Remissionen zu setzen.
Carfilzomib/Dexamethason im Rezidiv mit langem PFS
Proteasominhibitoren und Immunmodulatoren haben in den letzten zehn Jahren über weite Strecken die Entwicklung der Therapie des multiplen Myeloms bestimmt. Unter den neuen Substanzen, die für diese Erkrankung entwickelt werden, sind neben monoklonalen Antikörpern auch Zweitgenerations-Präparate dieser Klassen – bei den Proteasominhibitoren vor allem das Carfilzomib, das in den USA bereits zugelassen wurde und zu dem in Chicago und in Wien Ergebnisse aus mehreren Studien vorgestellt wurden.
Beim rezidivierten Myelom gilt die Kombination aus Bortezomib und Dexamethason bisher als ein Standard. Daher wurde dieses Regime in der Phase-III-Studie ENDEAVOR randomisiert mit einer ähnlichen Kombination verglichen, in der Bortezomib gegen Carfilzomib ausgetauscht worden war, so Meletios Dimopoulos, Athen [3, 4]. Carfilzomib ist in den USA in einer Dosierung von 27 mg/m2 zugelassen; aufgrund der positiven Ergebnisse einer Phase-Ib/II-Studie wurde es aber in ENDEAVOR doppelt so hoch dosiert (56 mg/m2 i. v. an den Tagen 1, 2, 8, 9, 15 und 16 eines 28-Tage-Zyklus; an den Tagen 1 und 2 des ersten Zyklus nur 20 mg/m2) und mit Dexamethason (20 mg an zwei Tagen pro Woche) kombiniert. Im Kontrollarm wurde das Steroid in der gleichen Dosierung zusammen mit Bortezomib gegeben (1,3 mg/m2 i. v. oder s. c. an den Tagen 1, 4, 8 und 11 eines jeden dreiwöchigen Zyklus).
929 Patienten (median 65 Jahre alt) wurden im Verhältnis 1:1 auf beide Arme randomisiert, bei etwa einem Viertel von ihnen fand sich eine Hochrisiko-Zytogenetik, bei ungefähr jedem Fünften war die Nierenfunktion eingeschränkt, und die mediane Zahl der Vortherapien lag bei zwei – in etwas mehr als der Hälfte der Fälle waren Bortezomib bzw. ein Immunmodulator beteiligt.
Primärer Endpunkt war das progressionsfreie Überleben, das durch Carfilzomib gegenüber dem Kontrollarm von median 9,4 auf 18,7 Monate ungefähr verdoppelt wurde (HR 0,53; 95%-KI 0,44–0,65; p < 0,0001). Dieser Vorteil war bei allen untersuchten Subgruppen zu sehen, unabhängig insbesondere auch vom Alter und von der Art der Vorbehandlung. Auch beim Ansprechen war die Überlegenheit des Zweitgenerations-Inhibitors deutlich erkennbar mit 13% versus 6% Komplettremissionen und 54% versus 29% sehr guten partiellen Remissionen (beide Male p < 0,0001). Beim Gesamtüberleben ist ein numerischer Vorteil erkennbar, so Dimopoulos, der allerdings nach median knapp einem Jahr Nachbeobachtungszeit statistisch noch nicht signifikant ausfällt (Median unter Carfilzomib noch nicht erreicht vs. 24,3 Monate im Verum-Arm (HR 0,79; p = 0,066). Die Studie wird bis zur finalen Auswertung der Überlebensdaten fortgesetzt.
Bei den Nebenwirkungen vom Grad 3 oder höher waren Hypertonus (9% vs. 3%), Dyspnoe (5% vs. 2,2%) und Herzinsuffizienz (5% vs. 1,8%) unter Carfilzomib etwas häufiger, eine periphere Neuropathie vom Grad ≥ 2 hier aber viel seltener (6% vs. 32%), und das, trotzdem vier Fünftel der Patienten im Kontrollarm Bortezomib ausschließlich subkutan erhalten hatten und die Behandlung dort insgesamt viel kürzer gewesen war (median 27 vs. 40 Wochen). Die Kombination aus Carfilzomib und Dexamethason, so Dimopoulos, stellt damit – eine Zulassung vorausgesetzt – einen neuen Standard in der Therapie des rezidivierten multiplen Myeloms dar.
Auch zur Konsolidierung nach Stammzelltransplantation
In einer US-amerikanischen Phase-II-Studie, die Todd Zimmermann, Chicago, beim ASCO-Kongress vorstellte, erhielten rund 50 Patienten mit neu diagnostiziertem multiplem Myelom 18 Zyklen Carfilzomib, Lenalidomid und Dexamethason (KRd, [5]). Dabei wurde Carfilzomib niedriger dosiert als in der ENDEAVOR-Studie und in den Zyklen 8–18 nur einmal wöchentlich gegeben, vor allem aber bekamen die Patienten nach dem vierten Zyklus eine Hochdosistherapie mit autologer Stammzelltransplantation. Nach Ende der gesamten Therapie lag die Rate an stringenten Komplettremissionen (d. h. ohne minimale Resterkrankung) bei 88%; in einer ähnlichen Studie, in der allerdings KRd alleine ohne Transplantation gegeben worden war, hatte sie 30% betragen.
In einer Phase-I/II-Studie schließlich wurde Carfilzomib mit dem Histondeacetylase-Inhibitor Panobinostat kombiniert [6]. Das Kollektiv von 26 Patienten war stärker vorbehandelt als in der
ENDEAVOR-Studie (median drei Vortherapien), und das Ansprechen mit 34% sehr guten partiellen und 82% Gesamtremissionen belegt daher die sehr gute Wirksamkeit dieser innovativen Kombination, so Jesus Berdeja, Nashville.
CD38-Antikörper beim doppelt refraktären Myelom
Monoklonale Antikörper, die etwa bei Non-Hodgkin-Lymphomen schon seit fast zwei Jahrzehnten eingesetzt und auch bei soliden Tumoren immer häufiger zugelassen werden, sind endlich auch dabei, in der Myelom-Therapie anzukommen. Myelom-Zellen zeichnen sich durch die Expression einer Reihe relativ spezifischer Oberflächenantigene aus, darunter CD38; mehrere Antikörper dagegen befinden sich in der klinischen Entwicklung. Am weitesten fortgeschritten ist Daratumumab, dem die Food and Drug Administration eine „Breakthrough Therapy Designation“ erteilt hat. In der Phase-II-Studie SIRIUS wurde Daratumumab nach einer Dosisfindungs-Phase mit 16 mg/kg dosiert, zunächst acht Wochen lang wöchentlich, dann 16 Wochen lang alle zwei Wochen und schließlich alle vier Wochen [7].
Die 106 Patienten, die diese Dosierung erhielten, hatten mindestens drei vorhergegangene Therapielinien einschließlich eines Proteasominhibitors und eines Immunmodulators bekommen. Für dieses stark vorbehandelte Kollektiv war eine Gesamtansprechrate von 29,2% mit drei stringenten Komplettremissionen, zehn sehr guten partiellen und 18 partiellen Remissionen beachtlich; die Remissionen dauerten median 7,4 Monate, und nach einem Jahr waren noch 65% der Patienten am Leben. Fast die Hälfte der Responder (45%) ist nach median 9,4 Monaten noch in Behandlung mit Daratumumab. Das Ansprechen war weitgehend unabhängig von der Vorbehandlung; selbst Patienten, die bereits zwei Proteasominhibitoren und zwei Immunmodulatoren erhalten hatten, zeigten noch eine Remissionsrate von 21%. Infusionsreaktionen traten wie bei den meisten therapeutischen Antikörpern fast ausschließlich bei der ersten Infusion (bei etwa jedem dritten Patienten) auf.
Antikörper mit dualem Wirkmechanismus
Einen besonders interessanten Wirkmechanismus hat der humanisierte Antikörper Elotuzumab: Sein Ziel-Antigen ist das Protein Signaling Lymphocytic Activation Molecule F7 (SLAMF7), das sich sowohl auf Myelom- als auch auf natürlichen Killerzellen (NK-Zellen), nicht jedoch in normalem Gewebe findet. Die beiden Zielzellen reagieren unterschiedlich auf die Bindung von Elotuzumab: Während die Myelomzellen durch den Mechanismus der Antikörper-abhängigen zellulären Zytotoxizität (ADCC) abgetötet werden, schädigt die Bindung des Antikörpers an SLAMF7 auf den NK-Zellen diese nicht, sondern aktiviert sie und veranlasst sie, aggressiver gegen die Myelom-Zellen vorzugehen, ohne dass normale Zellen dabei geschädigt werden.
In einer Phase-Ib/II-Studie hatte Elotuzumab bei Myelom-Patienten hohe Ansprechraten und ein langes progressionsfreies Überleben bewirkt, sodass auch dieser Antikörper von der FDA die „Breakthrough Therapy Designation“ zuerkannt bekam und einem beschleunigten Zulassungsverfahren zugeführt wurde. In der internationalen Phase-III-Studie ELOQUENT-2 wurde er bei Patienten mit ein bis drei Vortherapien mit Lenalidomid und niedrig dosiertem Dexamethason (Ld) kombiniert und randomisiert gegen Ld alleine getestet. Wie Sagar Lonial, Atlanta, in Chicago und Meletios Dimopoulos, Athen, in Wien berichteten, wurden 646 Patienten eingeschlossen, die nicht refraktär gegen Lenalidomid sein durften [8, 9]. Ein Drittel war aber refraktär gegenüber der zuletzt gegebenen Therapie (meist Bortezomib), etwas mehr als die Hälfte hatte bereits eine Stammzelltransplantation erhalten. Ebenfalls etwa ein Drittel der Patienten hatte eine Deletion 17p und rund jeder zehnte eine Translokation (4;14).
Koprimäre Endpunkte waren progressionsfreies Überleben und Gesamtansprechrate, und bei ersterem war der Elotuzumab-Arm hochsignifikant überlegen mit median 19,4 gegenüber 14,9 Monaten im Kontrollarm. Nach einem Jahr waren im Verum-Arm noch 68% der Patienten progressionsfrei am Leben, im Kontrollarm 57%, nach zwei Jahren waren es 41% vs. 27% (HR für Progression oder Tod 0,70, d. h. das Risiko wurde durch die Zugabe des Antikörpers um 30% reduziert; p = 0,0004). Auch bei der Gesamtansprechrate war der Unterschied hochsignifikant mit 79% vs. 66% (p = 0,0002). Der Vorteil für Elotuzumab beim progressionsfreien Überleben war in allen untersuchten Subgruppen (unabhängig von Alter, ISS-Stadium, Ansprechen auf die vorausgegangenen Therapien, Zytogenetik oder Nierenfunktion) nachweisbar. Für eine Auswertung des Gesamtüberlebens ist es noch zu früh.
Infusionsreaktionen traten bei etwa 10% der Patienten im Verum-Arm auf, zu 70% im ersten Zyklus; sie waren maximal vom Grad 3, und bei lediglich 5% der Patienten musste die Infusion deshalb unterbrochen werden. Nur zwei Patienten beendeten ihre Teilnahme wegen Infusionsreaktionen.
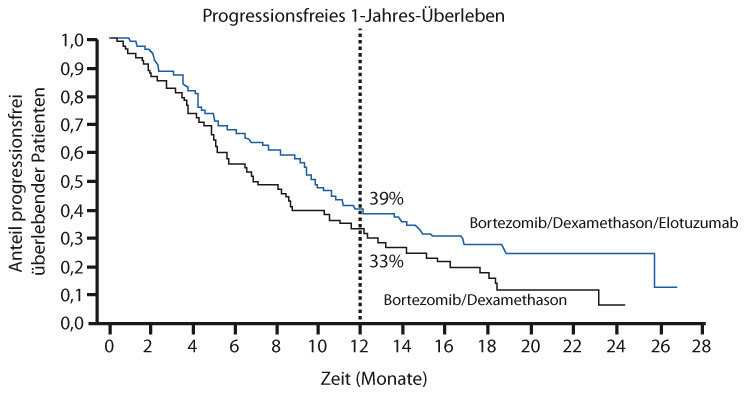
Auch in Kombination mit Bortezomib und Dexamethason (Bd) wird Elotuzumab untersucht – in einer randomisierten Phase-II-Studie, in der die 152 Patienten mit rezidiviertem oder refraktärem Myelom im Kontrollarm nur Bd erhielten, im Verum-Arm zusätzlich Elotuzumab, so Andrzej Jakubowiak, Chicago, beim EHA-Kongress [10]: Primärer Endpunkt war auch hier das progressionsfreie Überleben, und die Raten dafür lagen nach einem Jahr bei 39% vs. 33% für Verum- und Kontrollarm, nach zwei Jahren bei 24% vs. 6%, die Medianwerte bei 9,7 vs. 6,9 Monaten (HR 0,72; p = 0,09; Abb. 1). Nach Kontrolle für prognostische Faktoren war die Hazard Ratio mit 0,58 statistisch signifikant
(p = 0,01). Auch beim Gesamtüberleben war mit 1-Jahres-Raten von 85% vs. 74% ein Vorteil zu erkennen, der mit einer Hazard Ratio von 0,61 schon sehr früh ziemlich deutlich ausfiel, auch wenn er bisher noch nicht signifikant ist. Sofern sich diese Ergebnisse in künftigen Analysen und weiteren Studien bestätigen sollten, kann Elotuzumab offenbar in Kombination sowohl mit Immunmodulatoren als auch mit Proteasominhibitoren eingesetzt werden.
Literatur
1. Einsele H et al. Haematologica 2015; 100 (s1): 1 (EHA 2015, Abstract #S102).
2. Moreau P et al. Haematologica 2015; 100 (s1): 80-1 (EHA 2015, Abstract #P268).
3. Dimopoulos MA et al. J Clin Oncol 2015; 33 (15S): 452s (ASCO 2015, Abstract #8509).
4. Dimopoulos MA et al. Haematologica 2015; 100 (s1): (EHA 2015, Abstract #LB2071).
5. Zimmerman TM et al. J Clin Oncol 2015; 33 (15S): 452s (ASCO 2015, Abstract #8510).
6. Berdeja JG et al. J Clin Oncol 2015; 33 (15S): 453s (ASCO 2015, Abstract #8513).
7. Lonial S et al. J Clin Oncol 2015; 33 (15S): 453s (ASCO 2015, Abstract #LBA8512).
8. Lonial S et al. J Clin Oncol 2015; 33 (15S): 452s (ASCO 2015, Abstract #8508).
9. Dimopoulos MA et al. Haematologica 2015; 100 (s1): 173(EHA 2015, Abstract #S471).
10. Jakubowiak A et al. Haematologica 2015; 100 (s1): 2 (EHA 2015, Abstract #S103).