Neues zu gynäkologischen Tumoren
ASCO 2015
Fortschritte sind bei gynäkologischen Tumoren (vom Mammakarzinom abgesehen) in den letzten Jahrzehnten spärlich gewesen. Von den neuen zielgerichteten und biologischen Therapeutika sind im Grunde nur der Anti-VEGF-Antikörper Bevacizumab und der kürzlich zugelassene erste PARP-Inhibitor Olaparib beim Ovarialkarzinom erwähnenswert. Mit neuen Kombinationen und neuen Substanzen zeichnen sich derzeit aber hoffnungsvolle Entwicklungen ab, für die beim diesjährigen Kongress der American Society of Clinical Oncology (ASCO) in Chicago zahlreiche Beispiele vorgestellt wurden.
Endometriumkarzinom
Welches ist der richtige Kombinationspartner?
Die Kombination aus Paclitaxel und Carboplatin ist eine Standard-Erstlinientherapie beim fortgeschrittenen Endometriumkarzinom. In der Studie 209 der Gynecological Oncology Group (GOG) hatte sich die Zweierkombination aus Paclitaxel und Carboplatin mit 22,7 Monaten medianer Überlebenszeit der Dreierkombination aus Paclitaxel, Doxorubicin und Cisplatin als nicht unterlegen erwiesen. Die GOG versucht nun, diese Ergebnisse zu verbessern, indem sie zu der Zweierkombination einzelne Substanzen hinzugibt, die sich in Monotherapie beim rezidivierten Endometriumkarzinom als wirksam erwiesen hatten: Bevacizumab, Temsirolimus bzw. Ixabepilon. In einer randomisierten Phase-II-Studie erhielten daher 349 Frauen, die noch keine Chemotherapie für ihr Endometriumkarzinom im Stadium III-IVB oder im Rezidiv bekommen hatten, eine von drei Kombinationstherapien [1]: Paclitaxel/Carboplatin/Bevacizumab, Paclitaxel/Carboplatin/Temsirolimus oder Ixabepilon/Carboplatin/Bevacizumab. Als historische Kontrollen dienten die Patientinnen aus der GOG 209-Studie.
Keiner der drei Arme war den historischen Kontrollen beim primären Endpunkt progressionsfreies Überleben überlegen, so Carol Aghajanian, New York, aber beim Gesamtüberleben gelang dies dem Paclitaxel/Carboplatin/Bevacizumab-Arm mit 34 vs. 22,7 Monaten und einer Hazard Ratio von 0,71 (92%-Konfidenzintervall 0,55–0,91; p < 0,039).
Anti-Angiogenese zusätzlich zur Chemotherapie
Eine weitere Möglichkeit, die Wirkung des Paclitaxel/Carboplatin-Regimes beim fortgeschrittenen und/oder rezidivierten Endometriumkarzinom zu verbessern, könnte die Zugabe des anti-VEGF-Antikörpers Bevacizumab sein. Der vaskuläre endotheliale Wachstumsfaktor (VEGF) wird in diesen Tumoren nämlich exprimiert, und höhere Konzentrationen sind mit einer schlechten Prognose assoziiert. In einarmigen Phase-II-Studien hatte Bevacizumab sowohl in Monotherapie als auch in Kombination mit Paclitaxel/Carboplatin gute Wirksamkeit gezeigt, und das war für die italienische MITO-Studiengruppe (Multicenter Italian Trials in Ovarian Cancer and Gynecologic Malignancies) Anlass, dies in der randomisierten Phase-II-Studie MITO END-2 zu überprüfen [2]: 108 Patientinnen mit Endometriumkarzinom des Stadiums III-IV oder mit rezidivierten Tumoren, die höchstens eine vorhergehende Chemotherapie erhalten hatten, bekamen randomisiert sechs bis acht Zyklen Paclitaxel/Carboplatin mit oder ohne Bevacizumab, das auch nach Ende der Chemotherapie als Erhaltungstherapie bis zu Progression oder inakzeptabler Toxizität weitergegeben wurde.
Im experimentellen Arm mussten doppelt so viele Patientinnen wie im Kontrollarm wegen Toxizitäten Dosierungen verschieben (44,4% vs. 22,2%), und fünf Patientinnen im Bevacizumab-Arm (9,2%) beendeten die Therapie wegen Nebenwirkungen. Dafür war bei ihnen die Ansprechrate höher, auch wenn das nicht ganz signifikant ausfiel (71,7% vs. 54,3%; p = 0,065). Beim primären Endpunkt progressionsfreies Überleben hingegen war der Verum-Arm signifikant überlegen mit median 13 vs. 8,7 Monaten (HR 0,59; 95%-KI 0,35–0,98; p = 0,036). Dies galt für alle untersuchten Subgruppen, und auch bei Gesamtüberleben war die experimentelle Therapie numerisch besser (median 23,5 vs. 18 Monate; HR 0,65), wenngleich dieser Unterschied in diesem Stadium der Auswertung noch nicht signifikant ausfiel (p = 0,24). Bei der Toxizität zeigten sich keine neuen Signale, aber bei diesem Patientenkollektiv von älteren, meist komorbiden Patientinnen, die bereits eine Strahlentherapie bekommen haben, so Lorusso, sollte man besonders auf kardiovaskuläre Toxizitäten von Bevacizumab achten. Eine Phase-III-Studie sollte die Ergebnisse dieser ersten randomisierten Studie zu dem Thema bestätigen.
Adjuvanz: Chemotherapie bei Hochrisiko-Tumoren?
Theoretisch sollte eine Kombination aus Chemo- und Radiotherapie in der Adjuvanz stärker wirksam sein und etwa bei Hochrisiko-Patientinnen mit in kurativer Absicht operiertem Endometriumkarzinom die Überlebenschancen verbessern. Die Strahlentherapie ist bereits Standard in dieser Indikation, die Rolle einer zusätzlichen Chemotherapie während und nach der Bestrahlung wird in der von den Niederlanden aus geleiteten internationalen Phase-III-Studie PORTEC-3 überprüft. In Chicago stellte Carien Creutzberg, Leiden, die Daten zur Toxizität und zur Lebensqualität vor [3].
Die 686 Teilnehmerinnen mit Endometriumkarzinomen der FIGO-Stadien IA-IIIB, die Hochrisiko-Merkmale aufwiesen und in kurativer Absicht reseziert worden waren, erhielten eine fraktionierte Strahlentherapie mit einer Gesamtdosis von 48,6 Gy, und die eine Hälfte von ihnen wurde randomisiert, zusätzlich während der Bestrahlung zwei Zyklen Cisplatin (50 mg/m2) und danach vier Zyklen Carboplatin (AUC5) und Paclitaxel (175 mg/m2) zu bekommen. Nach median 30 Monaten Nachbeobachtungszeit lässt sich sagen, so Frau Creutzberg, dass die kombinierte Radiochemotherapie mit mehr Toxizität assoziiert ist: Während der Radiotherapie-Phase erlitten hier 79% der Patientinnen Nebenwirkungen vom Grad 2 oder höher, im Kontrollarm lediglich 44%, bei Toxizitäten vom Grad 3 oder höher waren es 36% vs. 13% (in beiden Fällen
p < 0,001). Während der Nachbeobachtungszeit klagten doppelt so viele Patientinnen im Kombinations-Arm über Nebenwirkungen vom Grad ≥ 3 (67% vs. 32%; p < 0,001), insbesondere solche von hämatologischer (32% vs. 8%), neurologischer (10% vs. 2%) und gastrointestinaler Art (14% vs. 5%; jeweils p < 0,001). Diese Symptome nahmen mit der Zeit ab: Nach einem Jahr war der Unterschied nur noch für neurologische und muskuloskelettale Nebenwirkungen vom Grad ≥ 2 signifikant, nach zwei Jahren persistierten lediglich neurologische Nebenwirkungen vom Grad ≥ 2 (10% vs. 2%;
p < 0,001), beim Schweregrad 3 oder höher war kein Unterschied zwischen den Armen mehr zu erkennen.
Auch die Lebensqualitätsparameter fielen nach der Strahlentherapie ebenso wie nach sechs Monaten im Radiochemotherapie-Arm schlechter aus, ein Unterschied, der sich nach einem und zwei Jahren bis auf kleine – wenngleich immer noch signifikante – Differenzen bei physischer, Rollen-, emotionaler und sozialer Funktion nivelliert hatte. Die stärksten Unterschiede nach zwei Jahren bestanden noch bei neurologischen Symptomen wie Kribbeln/Taubheit (24% vs. 7%; p < 0,001) und Schwäche in Armen und Beinen (14% vs. 9%; p < 0,001).
Die Zugabe einer adjuvanten Chemotherapie zur Bestrahlung bei Hochrisiko-Patientinnen mit Endometriumkarzinom ist also zumindest zeitweilig mit signifikant mehr Nebenwirkungen und verminderter Lebensqualität assoziiert. Diese unangenehmen Begleiterscheinungen bilden sich innerhalb von zwei Jahren weitgehend zurück, aber um die zusätzliche Chemotherapie zu rechtfertigen, müsste natürlich die Wirksamkeitsanalyse – die noch einige Zeit in Anspruch nehmen wird – deutlich zugunsten der Kombination ausfallen.
Ovarialkarzinom
PARP-Inhibition: Welche Patientinnen profitieren?
Beim Ovarialkarzinom – genauer: beim rezidivierten, Platin-sensitiven, serösen Ovarialkarzinom mit BRCA-Mutation – steht seit Kurzem als neue Therapieoption der PARP-Inhibitor Olaparib zur Verfügung, der in der Zulassungsstudie das progressionsfreie Überleben von 4,3 auf 11,2 Monate verlängern konnte [4]. Die Platin-Sensitivität gilt als prädiktiver Marker für das Ansprechen, aber es gibt auch Patientinnen mit Platin-Resistenz, die einen Nutzen von der Therapie zu haben scheinen. Eine internationale Arbeitsgruppe untersuchte deshalb retrospektiv die klinischen Daten von 108 Patientinnen mit BRCA-Mutationen, die in acht Krebszentren wegen eines rezidivierten Ovarialkarzinoms mit Olaparib behandelt worden waren [5].
Dabei stellte sich heraus, dass – nicht überraschend – bei Patientinnen mit Platin-sensitiver Erkrankung das Intervall zwischen Platin-basierter Chemotherapie und der Behandlung mit dem PARP-Inhibitor (das Platin-to-PARPi-interval = PTPI) mehr als doppelt so lang war wie bei Patientinnen mit Platinresistenz (68,7 vs. 25,9 Wochen; p < 0,0001). Patientinnen mit einem PTPI von mehr als 52 Wochen wiesen höhere Raten an kompletten und partiellen Remissionen unter Olaparib auf als diejenigen mit einem kürzeren PTPI (37% vs. 18%;
p = 0,053), und das war unabhängig von der Platin-Sensitivität. Weiter fand sich kein klinischer Parameter, der mit dem Ansprechen auf die PARP-Inhibition korreliert hätte. Möglicherweise, so die Autoren, lässt sich die prädiktive Aussagekraft der Platin-Sensitivität durch das PTPI verfeinern: So könnte es vielleicht Sinn machen, bei Patientinnen mit Platin-refraktärer Erkrankung eine weitere, nicht Platin-basierte Therapie zwischenzuschalten, bevor man den PARP-Inhibitor anwendet – einfach um das PTPI zu verlängern. Das muss aber natürlich prospektiv in einem größeren Kollektiv von Patientinnen getestet werden.
Olaparib-Toxizitäten: niedriggradig und von kurzer Dauer
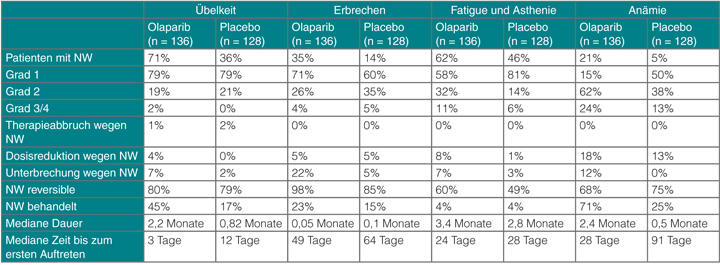
Der klinische Nutzen von Olaparib ging in den bisherigen Studien nicht mit einer Verschlechterung der Lebensqualität einher. Die häufigsten Toxizitäten des PARP-Inhibitors sind Übelkeit und Erbrechen sowie Fatigue und Anämie. In einer randomisierten, doppelblinden Phase-II-Studie, in der 136 Patientinnen Olaparib und 128 Placebo erhielten, wurde besonderes Augenmerk auf die Dokumentation und Graduierung von Nebenwirkungen gelegt [6]. Sie traten meist früh im Verlauf der Therapie auf, waren überwiegend vom Grad 1 oder 2 und bildeten sich unter entsprechender supportiver Behandlung zurück, ohne dass an der Olaparib-Therapie etwas geändert werden musste (Tab. 1). Toxizitäten höherer Grade waren selten und in der Regel mithilfe von Unterbrechungen oder Reduktionen der Olaparib-Dosis handhabbar. Lediglich bei neun Patientinnen im Olaparib- und bei zwei im Placebo-Arm musste die Behandlung wegen Nebenwirkungen abgebrochen werden.
Neue PARP-Inhibitoren in der frühen Entwicklung
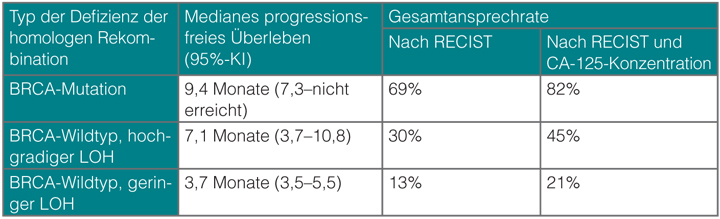
Olaparib ist der erste in die Praxis eingeführte PARP-Inhibitor, aber weitere Substanzen befinden sich bereits in unterschiedlichen Stadien der klinischen Prüfung. Rucaparib hat von der amerikanischen Food and Drug Administration im April eine „Breakthrough Designation“ erhalten. In der Phase-II-Studie ARIEL2 wurde versucht, neben den Ovarialkarzinom-Patientinnen mit BRCA-Mutationen weitere Subgruppen zu identifizieren, die auf Rucaparib ansprechen, so Iain McNeish, Glasgow [7]. Insbesondere wurde mit Next-Generation-Sequencing-Methoden nach Tumoren gesucht, die zwar die Wildtypen der BRCA-Gene trugen, bei denen aber der Mechanismus der homologen Rekombination andere Defekte hatte und die deshalb genomweit einen „Loss of Heterozygosity“ (LOH) aufwiesen. Im Vergleich zu den BRCA-Wildtyp-Patientinnen ohne LOH sprachen diejenigen mit LOH besser auf Rucaparib an, wenngleich nicht so gut wie die mit mutierten BRCA-Genen (Tab. 2).
Assays zum Nachweis einer Defizienz der homologen Rekombination können also helfen, Patientinnen zu identifizieren, deren Tumoren keine BRCA-Mutationen tragen, die aber dennoch von PARP-Inhibitoren profitieren können. Diese Methodik wird auch in der Phase-III-Studie ARIEL3 angewendet, in der Rucaparib als Erhaltungstherapie bei Patientinnen nach einer Platin-basierten Chemotherapie mit Placebo verglichen werden soll. An der Studie nehmen auch deutsche Zentren teil [8].
Ein weiterer neuer PARP-Inhibitor, Veliparib, wurde in einer Phase-I-Studie bei Patientinnen mit nicht vorbehandelten BRCA-mutierten Tumoren nicht nach, sondern gemeinsam mit drei verschiedenen Chemotherapie-Regimes getestet [9], nämlich mit jeweils sechs Zyklen mit dreiwöchentlich i. v. verabreichtem Paclitaxel und Carboplatin, i. v. Paclitaxel wöchentlich und Carboplatin alle drei Wochen sowie i. v. Paclitaxel gemeinsam mit intraperitonealem Paclitaxel und Carboplatin. Ab dem zweiten Zyklus wurde außerdem Bevacizumab gegeben, das auch nach Ende der Chemotherapie fortgeführt wurde. Von Beginn an wurde Veliparib zugegeben. Als empfohlene Dosis für die Phase-II-Studien wurden 150 mg zweimal täglich identifiziert. Insbesondere in Kombination mit dem dritten, i. v. und i. p. gegebenen Chemotherapie-Regime zeigte sich ein erstes vielversprechendes Wirksamkeitssignal mit einem progressionsfreien Überleben, das nach zwei Jahren noch nicht seinen Medianwert erreicht hat; 68% der Patienten waren zu diesem Zeitpunkt noch progressionsfrei am Leben, in den beiden anderen Gruppen 53% bzw. 54%.
Neues Anti-Angiogenese-Prinzip
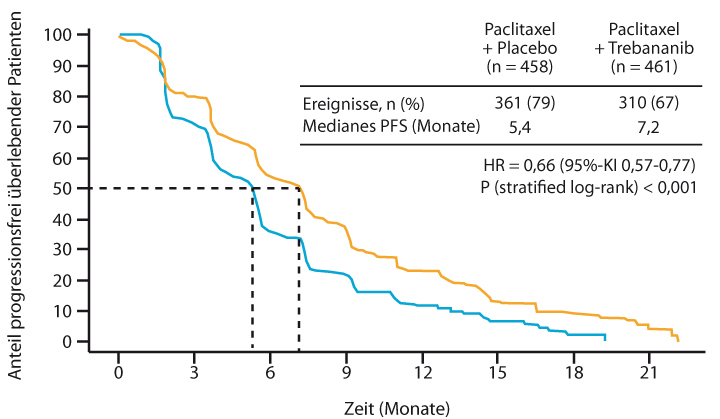
Ebenfalls in Kombination mit Chemotherapie wird ein neues anti-angiogenetisches Medikament entwickelt, der Peptibody Trebananib, der die Bindung von Angiopoietin 1 und 2 an den Tie2-Rezeptor blockiert. In der Phase-III-Studie TRINOVA-1 wurden Patientinnen mit rezidiviertem Ovarialkarzinom randomisiert mit Paclitaxel wöchentlich plus Trebananib oder Placebo kombiniert. In der Primäranalyse war der primäre Endpunkt progressionsfreies Überleben signifikant verlängert gewesen ([10]; Abb. 1). In der in Chicago vorgestellten Analyse zeigte Bradley Monk, Phoenix, dass diese Verlängerung für sämtliche untersuchten Subgruppen von Patientinnen gleichermaßen zu sehen war, dass aber beim sekundären Endpunkt Gesamtüberleben in der Intent-to-treat-Analyse der Gesamtkohorte kein Vorteil für Trebananib erkennbar war (median 19,3 vs. 18,3 Monate; HR 0,95; p = 0,52; [11]). Das kann nicht an der unterschiedlich intensiven Fortführung der Behandlung liegen, denn die Zahl der Folgetherapien war in beiden Armen identisch (im Mittel 2,2 Therapielinien).
Eine Subgruppe allerdings, für die bereits vorab eine separate Analyse des Überlebens geplant gewesen war, stach beim Gesamtüberleben heraus: Patientinnen, die zu Beginn schon einen Aszites aufgewiesen hatten, profitierten von der Zugabe von Trebananib zur Chemotherapie mit einer signifikanten Verlängerung der Überlebenszeit um median 2,2 Monate (14,5 vs. 12,3 Monate; HR 0,72; p = 0,011). Interessanterweise war der Vorteil beim progressionsfreien Überleben auch nach der nächsten Therapielinie im Gesamtkollektiv noch zu erkennen, mit median 12,5 vs. 10,9 Monaten ab Randomisierung (HR 0,85; p = 0,024). Trebananib plus Paclitaxel verursachte mehr Nebenwirkungen als Paclitaxel alleine, ohne dass sich das aber negativ auf die „Patient-Reported Outcomes“ ausgewirkt hätte.
Synthetische Letalität bei p53-mutierten Tumoren nutzen
Nahezu alle serösen „high-grade“-Ovarialkarzinome weisen ein mutiertes TP53-Gen auf, wodurch die Regulation des G1/S-Checkpoints des Zellzyklus verlorengeht, d. h. diese Zellen sind für die Reparatur von DNA-Schäden stärker auf den CDK-Cyclin-abhängigen G2/M-Checkpoint angewiesen, der durch die Kinase Wee1 reguliert wird. Eine Hemmung von Wee1 sollte die Zellen deshalb anfälliger gegen die Wirkung gleichzeitig gegebener genotoxischer Substanzen machen, ein Effekt, der auch unter dem Begriff synthetische Letalität bekannt ist. Ein niedermolekularer Inhibitor von Wee1, AZD1775, hat in einer Phase-I-Studie in Kombination mit Paclitaxel und Carboplatin bei neun von zwölf Patientinnen mit Platin-sensitivem, TP53-mutiertem Ovarialkarzinom zu einem Ansprechen nach den GCIG-Kriterien (RECIST und CA-125) geführt. In der Phase-II-Erweiterung dieser Studie wurden daher 121 solche Patientinnen randomisiert entweder mit AZD1775 oder Placebo behandelt [12]. Beim primären Endpunkt progressionsfreies Überleben kam mit dem Wee-Inhibitor eine signifikante Verlängerung zustande, egal ob die Progression anhand der alten RECIST-Kriterien (HR 0,63) oder der aktualisierten Version RECIST 1.1 ermittelt wurde (HR 0,55; p = 0,030). Die Verträglichkeit war akzeptabel, und angesichts der Tatsache, dass die Behandlungsdauer bis zur Erhebung dieser Daten erst etwas über hundert Tage betragen hatte, sind die Ergebnisse sehr ermutigend – zumal die Kurven für das progressionsfreie Überleben sich erst nach etwa einem halben Jahr zu trennen beginnen. Derzeit werden die archivierten Tumorblöcke untersucht, um eventuell prädiktive Marker zu identifizieren, mit deren Hilfe sich Patientinnen vorab definieren lassen, die am stärksten von dieser Kombination profitieren.
Literatur
1. Aghajanian C et al. J Clin Oncol 2015; 33 (15S): 290s (ASCO 2015, Abstract #5500).
2. Lorusso D et al. J Clin Oncol 2015; 33 (15S): 290s (ASCO 2015, Abstract #5502).
3. Creutzberg CL et al. J Clin Oncol 2015; 33 (15S): 290s (ASCO 2015, Abstract #5501).
4. Lederman J et al. Lancet Oncol 2014; 15: 852-61.
5. Rafii S et al. J Clin Oncol 2015; 33 (15S): 301s (ASCO 2015, Abstract #5546).
6. Matulonis U et al. J Clin Oncol 2015; 33 (15S): 302s (ASCO 2015, Abstract #5550).
7. McNeish IA et al. J Clin Oncol 2015; 33 (15S): 292s (ASCO 2015, Abstract #5508).
8. clinicaltrials.gov/ct2/show/study/NCT01968213.
9. Bell-McGuinn KM et al. J Clin Oncol 2015; 33 (15S): 292s (ASCO 2015, Abstract #5507).
10. Monk BJ et al. Lancet Oncol 2014; 15: 799-808-
11. Monk BJ et al. J Clin Oncol 2015; 33 (15S): 290s (ASCO 2015, Abstract #5503).
12. Oza AM et al. J Clin Oncol 2015; 33 (15S): 291s (ASCO 2015, Abstract #5506).

Prof. Dr. Marion Kiechle
Direktorin der Frauenklinik
Klinikum rechts der Isar der
Technischen Universität München (TUM)
Lehrstuhl für Gynäkologie und Geburtshilfe
Ismaninger Straße 22, 81675 München
Artikel als PDF downloaden.