Neues aus der Dermato-Onkologie
ASCO 2015
Die Dermato-Onkologie war auch bei der diesjährigen ASCO-Jahrestagung wieder eines der am stärksten beachteten Fachgebiete: Sie hat seit einigen Jahren Erfolge vorzuweisen, wie sie vor zehn Jahren noch unvorstellbar gewesen wären und ist das Gebiet, auf dem die neuen immunonkologischen Therapien zuerst entwickelt worden sind und immer noch – derzeit mit Kombinationstherapien – weiterentwickelt werden. Neben den Checkpoint-Inhibitoren war die Hemmung des BRAF-MEK-Signalwegs ein weiteres großes Thema in Chicago, und möglicherweise wird es sogar Kombinationen beider Therapierichtungen geben.
PD-1- und CTLA4-Antikörper: Wirkung steigt durch Kombination
Der CTLA4-Antikörper Ipilimumab war der erste Checkpoint-Inhibitor, der beim fortgeschrittenen malignen Melanom Aufsehen erregte – gar nicht so sehr durch eine Verlängerung der medianen Überlebenszeiten als vielmehr dadurch, dass sich in den Überlebenskurven der zuvor unheilbaren Patienten ein Plateau bildete. Das gestattete die aufregende Vermutung, dass die neuen immunonkologischen Medikamente bei einem Teil der Patienten – vorsichtig ausgedrückt – zu einem Langzeitüberleben führen könnten; bei Ipilimumab sind das rund 20% [1]. Während Ipilimumab die „Priming“-Phase der T-Zell-Aktivierung beeinflusst, greift die zweite Generation der Checkpoint-Inhibitoren an PD-1 und PD-L1 und damit in der Effektorphase direkt im Tumorgewebe an und scheint noch wirksamer, aber auch besser verträglich zu sein. Die PD-1-
Inhibitoren Nivolumab und Pembrolizumab sind mittlerweile in Monotherapie zugelassen, aber angesichts der doch unterschiedlichen Wirkmechanismen könnte eine Kombination mit dem CTLA4-Antikörper theoretisch noch effektiver sein. In einer randomisierten Phase-II-Studie hatte sich für die Kombination aus Nivolumab und Ipilimumab bereits eine deutliche Überlegenheit über eine Ipilimumab-Monotherapie angedeutet – für Patienten mit BRAF-Wildtyp ebenso wie mit mutiertem BRAF [2] –, und das wurde nun in der Phase-III-Studie CheckMate 067 in einem dreiarmigen Design überprüft [3]:
945 noch unbehandelte Patienten mit fortgeschrittenem Melanom wurden in drei Arme randomisiert: Im Kombinationsarm erhielten sie die üblichen vier Dosen Ipilimumab (3 mg/kg alle drei Wochen) und während dieser Zeit Nivolumab alle zwei Wochen in der Dosierung von 1 mg/kg; anschließend wurde Nivolumab in der normalen Dosis von 3 mg/kg alle zwei Wochen bis zu Progression oder inakzeptabler Toxizität weitergegeben. In den beiden anderen Armen erhielten die Patienten jeweils die Monotherapie in der für die beiden Antikörper üblichen Dosierung. Die Patienten wurden nach PD-L1-Expression im Tumor, BRAF-Mutationsstatus und M-Stadium stratifiziert. Ko-primäre Endpunkte der CheckMate-067-Studie sind das progressionsfreie Überleben, über das Jedd Wolchok, New York, in Chicago berichtete und das mittlerweile auch publiziert ist [4], sowie das Gesamtüberleben, für dessen zuverlässige Einschätzung noch eine längere Nachbeobachtungszeit erforderlich sein wird.
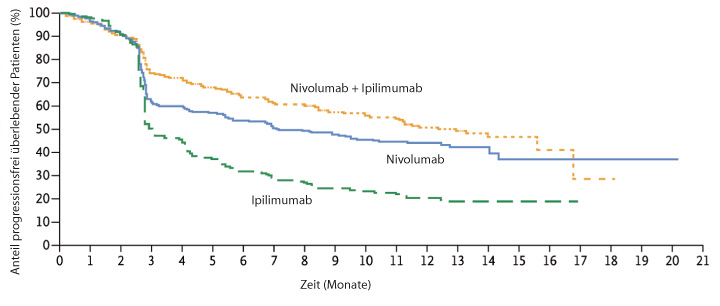
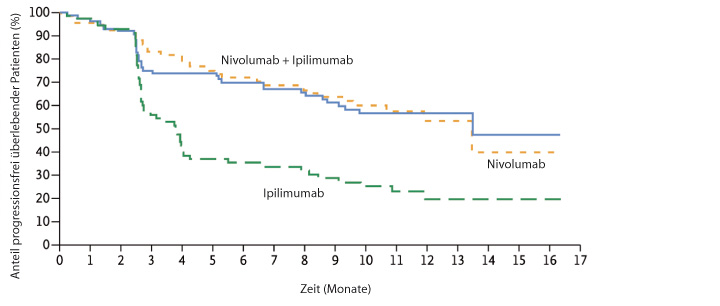
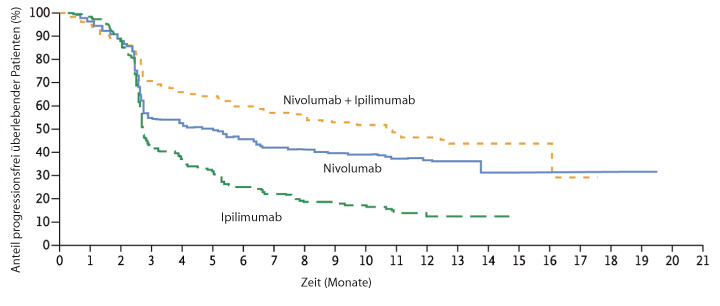
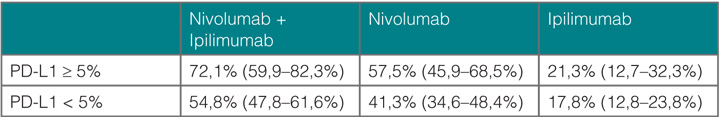
Nivolumab war Ipilimumab bereits beim Ansprechen deutlich überlegen (Ipilimumab 19,0%, Nivolumab 43,7%), und die Kombination war noch einmal besser (57,6%). Das Gleiche gilt für das progressionsfreie Überleben (Abb. 1a) mit Medianwerten von 2,9 (Ipilimumab), 6,9 (Nivolumab) und 11,5 Monaten (Kombination); die beiden Nivolumab-Arme waren dem Ipilimumab statistisch signifikant überlegen (Hazard Ratio 0,57 für Nivolumab und 0,42 für die Kombination, jeweils p < 0,00001). Für den Vergleich der Kombinationsgruppe gegenüber der Nivolumab-Monotherapie errechnete sich in einer exploratorischen Analyse eine Hazard Ratio von 0,74 (95%-Konfidenzintervall 0,60–0,92). Bei Patienten, in deren Tumoren mindestens 5% der Zellen den PD-1-Liganden PD-L1 exprimierten, waren die Kurven für progressionsfreies Überleben unter Nivolumab und der Kombination aus Nivolumab und Ipilimumab praktisch deckungsgleich und der Ipilimumab-Monotherapie weit überlegen (Abb. 1b), während bei den Patienten mit geringerer PD-L1-Expression die Nivolumab-Monotherapie der Kombination zumindest numerisch unterlegen zu sein schien (Abb. 1c). Bei den Ansprechraten ist in beiden Strata die Kombination der jeweiligen Monotherapie überlegen (Tab. 1).
Die Toxizität der Kombination war deutlich gegenüber den Monotherapien erhöht, die schweren unerwünschten Nebenwirkungen (AE Grad 3–4) lagen bei 55,0% unter Ipilimumab kombiniert mit Nivolumab im Vergleich zu 27,3% unter Ipilimumab und 16,3% unter Nivolumab. Die autoimmun-vermittelten Nebenwirkungen, vor allem den Gastrointestinaltrakt, die Leber, Haut und das endokrine System betreffend, unterschieden sich aber nicht von dem, was für die beiden Einzelsubstanzen bekannt ist, und konnten mit den üblichen Standardmaßnahmen gut kontrolliert werden.
Aus diesen ersten Ergebnissen von CheckMate 067 lässt sich folgern, dass die Kombination von Nivolumab und Ipilimumab in der Erstlinientherapie des Melanoms die Ergebnisse der Nivolumab-Monotherapie verbessert, insbesondere bei Patienten, deren Tumoren eine geringe PD-L1-Expression aufweisen.
Bei Immuntherapien atypische Ansprechmuster beachten!
Pembrolizumab ist bereits der zweite PD-1-Antikörper, der in einem umfangreichen Studienprogramm unter anderem beim Melanom getestet wird. Zumindest in den USA ist er bereits für mit Ipilimumab vorbehandelte Melanom-Patienten zugelassen. In der Studie KEYNOTE-001 hatten insgesamt 655 Patienten mit fortgeschrittenem Melanom eines von drei verschiedenen Pembrolizumab-Regimes erhalten (2 bzw. 10 mg/kg alle drei Wochen oder die höhere Dosis alle zwei Wochen). Dabei waren hohe Ansprech- und 2-Jahres-Überlebensraten gefunden worden – relativ unabhängig davon, ob BRAF in den Tumoren mutiert war oder nicht bzw. ob die Patienten mit Ipilimumab vorbehandelt waren oder nicht [5].
Einen sehr interessanten Aspekt stellte Jedd Wolchok in einer Subgruppenanalyse heraus [6]: Immer wieder werden Patienten beobachtet, die unter immunonkologischen Therapien radiologisch, d. h. nach den klassischen
RECIST-Kriterien zunächst progredient sind, später aber durchaus ein teilweise eindrucksvolles Ansprechen zeigen. Bereits früh wurden daher auf Basis der Ipilimumab-Daten spezifische Kriterien (immune-related Response Criteria, irRC) entwickelt, die der Tatsache Rechnung tragen, dass eine antitumorale Immunreaktion sich erst einmal in einem Wachstum bestehender oder sogar in der Bildung neuer Läsionen,
d. h. in einer Pseudoprogression manifestieren kann [7]. Von den 327 Patienten in der KEYNOTE-001-Studie, die sich mindestens 28 Wochen lang den Staging-Untersuchungen unterzogen hatten, wurde immerhin bei 6% ein solches atypisches Ansprechmuster beobachtet, so Wolchok. Dies zu erkennen, ist von großer praktischer Bedeutung: Patienten, die nach RECIST progredient waren, jedoch nach irRC, d. h. längerfristig eine komplette oder partielle Remission erzielt hatten (immerhin 3% aller Patienten), schnitten hinsichtlich des Gesamtüberlebens genauso gut ab wie jene, bei denen eine Remission auch bereits nach RECIST diagnostiziert werden konnte.
Die Konsequenz, so Wolchok: Die konventionellen Kriterien können die Wirksamkeit immunonkologischer Therapie zumindest beim Melanom unterschätzen, und man tut gut daran, bei einer radiologisch erkennbaren Progression die Therapie nicht zu rasch zu beenden.
Immunologische Genexpressions-Signaturen korrelieren mit Ansprechen
Die neuen immunonkologischen Therapien sind zwar nicht sehr toxisch, aber meist sehr kostspielig – deshalb wäre es von großem Nutzen, vorab bestimmen zu können, welche Patienten darauf ansprechen und welche nicht. Die Expression von PD-L1 korreliert zwar mit dem Outcome bei Behandlung mit
PD-1-Antikörpern, aber auch Patienten mit geringer oder nicht messbarer PD-L1-Expression haben offenbar einen Nutzen von diesen Therapien, wie sich beispielsweise in der CheckMate-067-Studie zeigte (s. oben). In einer weiteren Subgruppenanalyse der Studie KEYNOTE-001 wurden deshalb Genexpressionsanalysen an vor Beginn der Therapie entnommenen Tumorbiopsien durchgeführt, um möglicherweise Signaturen zu identifizieren, die mit dem Ansprechen auf Pembrolizumab korrelieren könnten [8]. Tatsächlich, so Antoni Ribas, Los Angeles, fanden sich mehrere immunologisch relevante Signaturen, die mit der Aktivierung von Signalwegen von Interferon γ und des T-Zell-Rezeptors sowie mit der Antigen-Präsentation durch MHC-Moleküle der Klasse I und II einhergehen. Diese Signaturen korrelierten mit den Ansprechraten und mit dem progressionsfreien Überleben und könnten, sofern sich diese Ergebnisse in weiteren Studien bestätigen sollten, gute Kandidaten für die Etablierung prädiktiver Marker für diese Therapien sein.
Updates zu Kombinationen von BRAF- und MEK-Inhibition
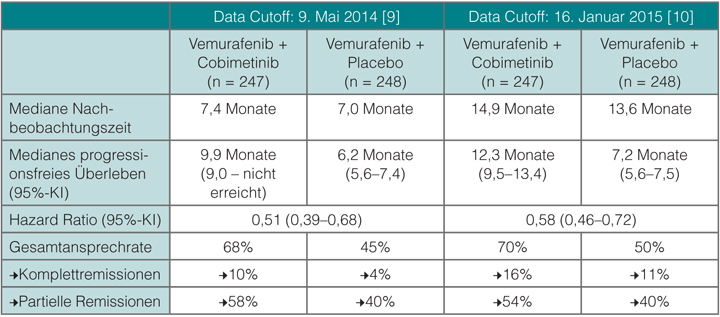
Patienten mit einem Melanom, in dem das BRAF-Gen an Position 600 eine Mutation aufweist, haben neben den Immuntherapien eine weitere therapeutische Option mit dem Einsatz von BRAF-Inhibitoren. Deren Wirkung und Verträglichkeit wird durch die Zugabe eines MEK-Inhibitors verbessert, wie sich zum Beispiel in der auch in Deutschland rekrutierenden Studie coBRIM gezeigt hat: Dort konnte die Kombination von Vemurafenib mit Cobimetinib die Ansprechraten von 45% auf 68% erhöhen und das Risiko für Progression oder Tod halbieren [9]. In Chicago stellte James Larkin, London, eine aktualisierte Analyse mit doppelt so langer Nachbeobachtungszeit (median 14,2 Monate) vor (Tab. 2; [10]): Das mediane progressionsfreie Überleben von median 7,2 unter Vemurafenib plus Placebo konnte demnach durch die Zugabe von Cobimetinib auf 12,3 Monate verlängert werden (HR 0,58; 95%-KI 0,46–0,72). Auch bei der Gesamtansprechrate war die Kombination mit 69,6% versus 50,0% deutlich überlegen. Diese Überlegenheit wurde durchgängig in allen untersuchten Subgruppen gesehen. 11% der untersuchten Tumoren wiesen zusätzlich zur BRAF-V600-Mutation genetische Veränderungen im RAS/RAF/RTK-Signalweg auf, die aber das Ansprechen auf die Therapie nicht zu beeinflussen schienen. Die Patienten werden weiter beobachtet, und gegen Ende 2015 ist mit der endgültigen Analyse des Gesamtüberlebens zu rechnen.
Eine ganz ähnliche Fragestellung hatte, ebenfalls mit deutscher Beteiligung, die Phase-III-Studie COMBI-d mit dem BRAF-Inhibitor Dabrafenib und dem MEK-Inhibitor Trametinib bearbeitet. Auch hier hatte sich bereits in der primären Analyse ein Vorteil der Kombination beim progressionsfreien Überleben gezeigt [11], und in Chicago konnte Georgina Long, Sydney, nun die Überlebensdaten nach median 20 Monaten Follow-up präsentieren [12]: Die Kombination war dabei mit median 25,1 versus 18,7 Monaten signifikant überlegen (HR 0,71; p = 0,011); die 2-Jahres-Überlebensrate lag mit der Kombination bei 51%, unter Dabrafenib alleine bei 42%. Diese Ergebnisse waren in allen untersuchten Subgruppen konsistent, und der Überlebensvorteil im Kombinationsarm ist auch unter dem Aspekt interessant, dass diese Patienten bislang seltener Folgetherapien, insbesondere auch seltener Ipilimumab oder PD-1-Inhibitoren erhalten haben. Auch beim progressionsfreien Überleben ist die Kombination mit median 11,0 vs. 8,8 Monaten deutlich überlegen (HR 0,67; p < 0,001), ebenso bei den Ansprechraten (69% vs. 53%; p = 0,001). Die Toxizitäten beschränkten sich auch nach 17 weiteren Monaten Nachbeobachtung auf das bekannte Spektrum und waren gut handhabbar. Mit der Kombination aus Dabrafenib und Trametinib steht damit ein neuer Standard für das maligne Melanom mit BRAF-V600-Mutationen zur Verfügung.
Mit Encorafenib (LGX818) und Binimetinib (MEK162) befindet sich derzeit die dritte Kombination aus einem BRAF- und einem MEK-Inhibitor in der klinischen Erprobung. In einer Phase-Ib/II-Studie wurden Anzeichen für eine vielversprechende Aktivität beim nicht mit BRAF-Inhibitoren vorbehandelten Melanom gefunden [13]. In der Phase-III-Studie COLUMBUS wird die Kombination zurzeit randomisiert gegen Encorafenib alleine sowie gegen Vemurafenib getestet [14].
Checkpoint-Inhibitoren und BRAF-/MEK-Inhibitoren: Kombinieren?
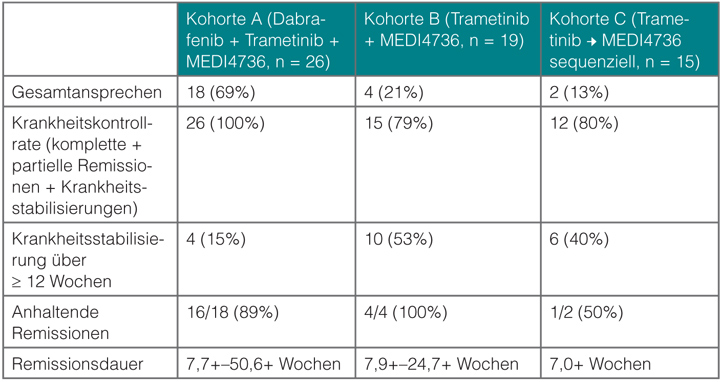
Die Inhibition sowohl von Checkpoint-Molekülen als auch der BRAF- und der MEK-Kinasen zeigt eine bis vor wenigen Jahren nicht für möglich gehaltene Wirksamkeit beim fortgeschrittenen Melanom (BRAF-Inhibitoren nur bei mutierten Tumoren). So stellt sich die Frage, ob man diese beiden Ansätze nicht kombinieren könnte. In einer multizentrischen Phase-I-Studie, die Toni Ribas vorstellte, wurde genau das versucht [15]: In zwei Kohorten (A1 und A2) wurden Patienten mit BRAF-mutiertem Melanom mit zwei verschiedenen Dosierungen des PD-L1-Antikörpers MEDI4736 (3 bzw. 10 mg/kg alle zwei Wochen) und zusätzlich mit Dabrafenib und Trametinib behandelt, in zwei weiteren Kohorten erhielten Patienten mit BRAF-Wildtyp-Tumoren 10 mg/kg MEDI4736 plus Trametinib (Kohorte B) bzw. den MEK-Inhibitor gefolgt von dem PD-L1-Antikörper (Kohorte C). MEK-Inhibitoren sind auch bei BRAF-Wildtyp-Tumoren wirksam, vor allem dann, wenn diese NRAS-Mutationen tragen.
Die Kombinationen waren gut verträglich, es konnte keine maximal tolerierte Dosis identifiziert werden. Die bisher 65 behandelten Patienten sprachen ausgezeichnet auf diese Kombinationstherapien an (Tab. 3), am stärksten diejenigen mit BRAF-mutierten Tumoren, die alle drei Substanzen erhielten. Offenbar, so zeigen translationale Studien, führt die Behandlung mit BRAF- und MEK-Inhibitor zu einer verstärkten Expression von Antigenen in den Melanomen.
Literatur
1. Schadendorf D et al. J Clin Oncol 2015; 33: 1889-94.
2. Postow MA et al. N Engl J Med 2015; 372: 2006-17.
3. Wolchok JD et al. J Clin Oncol 2015; 33 (15S): (ASCO 2015, Abstract #LBA1).
4. Larkin J et al. N Engl J Med 2015; 373: 23-34.
5. Daud A et al. J Clin Oncol 2015; 33 (15S): 480s (ASCO 2015, Abstract #9005).
6. Wolchok JD et al. J Clin Oncol 2015; 33 (15S): 148s (ASCO 2015, Abstract #3000).
7. Wolchok JD et al. Cancer Res 2009; 15: 7412-20.
8. Ribas A et al. J Clin Oncol 2015; 33 (15S): 148s (ASCO 2015, Abstract #3001).
9. Larkin J et al. N Engl J Med 2014; 371: 1867-76.
10. Larkin JMG et al. J Clin Oncol 2015; 33 (15S): 480s (ASCO 2015, Abstract #9006).
11. Long GV et al. N Engl J Med 2014; 371: 1877-88.
12. Long GV et al. J Clin Oncol 2015; 33 (15S): 5s (ASCO 2015, Abstract #102).
13. Sullivan RJ et al. J Clin Oncol 2015; 33 (15S): 480s (ASCO 2015, Abstract #9007).
14. clinicaltrials.gov/ct2/show/NCT01909453.
15. Ribas A et al. J Clin Oncol 2015; 33 (15S): 148s (ASCO 2015, Abstract #3003).

Prof. Dr. med. Carola Berking
Klinik und Poliklinik für
Dermatologie und Allergologie
Klinikum der Universität München (LMU)
Frauenlobstr. 9-11/
Thalkirchner Str. 48
80337 München
Artikel als PDF downloaden.

