Therapie der aggressiven B-Zell-Lymphome
Lorenz Thurner und Michael Pfreundschuh
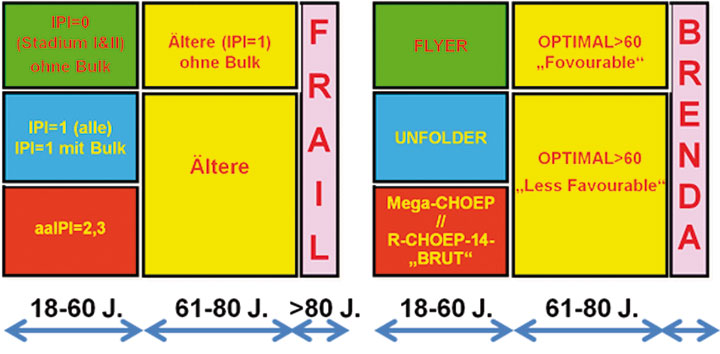
Die Intergroup-Studie [1], die das alte CHOP-Schema (Cyclophosphamid, Doxorubicin, Vincristin, Prednison) mit den wesentlich aggressiveren Chemotherapie-Kombinationen der sogenannten 2. und 3. Generation verglichen und gezeigt hatte, dass CHOP ebenso wirksam, aber weniger toxisch als diese Schemata war, machte 1993 deutlich, dass die Prognose eines Patienten mit einem aggressiven Non-Hodgkin-Lymphom mehr von seinem prätherapeutischen Risikoprofil als von der Art seiner Chemotherapie abhängt, solange letztere ausreichend dosiert ist und Anthrazykline enthält. Auf dieser Erkenntnis aufbauend wurden in einer Metaanalyse von 4.500 innerhalb prospektiver Studien behandelten Patienten fünf unabhängige prätherapeutische Parameter identifiziert, die mit einer schlechteren Prognose assoziiert sind: Erhöhte Laktatdehydrogenase (LDH) vor Therapiebeginn, Alter > 60 Jahre, fortgeschrittenes Stadium (III und IV nach Ann Arbor), > 1 extralymphatischer Manifestationsort und schlechter Allgemeinzustand (ECOG > 1). Entsprechend dem International Prognostic Index (IPI; [2]) werden vier Risikogruppen unterschieden: Niedriges Risiko (0 oder 1 IPI-Risikofaktoren), niedrig-intermediäres Risiko (2), hoch-intermediäres Risiko (3) und hohes Risiko (4 oder 5 Risikofaktoren). Die meisten Studiengruppen haben spezifische Protokolle für die verschiedenen Risikogruppen entwickelt, wobei im Hinblick auf die einzuschlagende Therapiestrategie häufig noch folgende Untergruppen unterschieden werden (Abb. 1):
1. Junge Patienten mit guter Prognose und
- sehr günstiger Risiko-Konstellation („favourable“),
- ungünstiger Risiko-Konstellation („unfavourable“),
2. junge Patienten mit schlechter Prognose,
3. ältere Patienten (61–80 Jahre) und
- günstiger Prognose („favourable“),
- weniger günstiger Prognose („less favourable“),
4. sehr alte (> 80 Jahre) und gebrechliche Patienten.
Die Deutsche Studiengruppe Hochmaligne Non-Hodgkin-Lymphome (DSHNHL) hat für jede dieser Subgruppen eine risikoadaptierte Studie. Die prognostischen Subgruppen und die entsprechenden Studien sind in Abb. 1 dargestellt.
1. Ältere Patienten
Der Schnittpunkt, ab dem Patienten nach Protokollen für ältere Patienten behandelt werden, wird meistens auf ein Alter zwischen 61 und 65 Jahren gelegt. Da genetische Voraussetzungen und der Lebensstil bei über 60-jährigen Patienten zu sehr deutlichen Unterschieden im biologischen Alter führen, sollten Therapieprotokolle sowohl für junge als auch für ältere Patienten anstatt einer starren Trennung eine “Gleitzone” von ca. fünf Jahren (61–65) erlauben, die dem behandelnden Arzt die Entscheidung überlässt, ob er den jeweiligen Patienten therapeutisch der Gruppe der jungen oder älteren Patienten zuordnet.
Über 60-jährige Patienten haben eine schlechtere Prognose als jüngere Patienten [2–5]. Dabei sind die schlechteren Therapieergebnisse im Vergleich zu den jüngeren Patienten durch das Zusammenkommen mehrerer ungünstiger Faktoren bedingt: Zum Teil werden ältere Patienten häufig anders, z. T. auch gar nicht behandelt (Vorbehalte der Therapeuten, therapeutischer Nihilismus); daneben sind Organkomplikationen und therapieassoziierte Todesfälle häufiger, und außerdem gibt es relevante biologische Unterschiede zwischen den Lymphomen jüngerer und älterer Patienten [6]. Bei aggressiven Lymphomen haben ältere Patienten zum Zeitpunkt der Diagnosestellung neben dem Alter häufiger zusätzliche mit schlechter Prognose assoziierte IPI-Faktoren als jüngere Patienten. So ändert sich mit zunehmendem Alter auch die Biologie der aggressiven Lymphome (mehr BCL2-Protein-positive Fälle, mehr Lymphome vom aktivierten B-Zell-Typ).
Die obere Altersgrenze für konventionelle Chemotherapien mit kurativer Intention wird weniger durch das chronologische Alter als vielmehr durch die mit höherem Alter wahrscheinlichere Komorbidität bestimmt. Patienten über 70, und insbesondere solche über 75 Jahre bedürfen einer sorgfältigen Evaluation von vorbestehenden oder unter Therapie aufgetretenen Begleiterkrankungen. Nur ein Teil der über 80-jährigen Patienten ist fit genug für eine Anthrazyklin-haltige Therapie. Da die Zahl solcher Patienten mit zunehmender Überalterung der Bevölkerung zunimmt, stellen sie ein immer größer werdendes Patientenkollektiv der aggressiven B-Zell-Lymphome mit „unmet medical needs“ dar.
Der Standard für die Behandlung älterer DLBCL-Patienten in Deutschland wurde durch die RICOVER-60-Studie definiert, mit 1.222 auswertbaren Patienten die bisher größte Studie zu aggressiven B-Zell-Lymphomen überhaupt [7]. RICOVER-60 verglich in einem faktoriellen Design 6 x CHOP-14 mit 8 x CHOP-14, jeweils mit und ohne acht Applikationen von Rituximab im zweiwöchigen Abstand. Ereignisfreies (EFS) und progressionsfreies Überleben (PFS) konnten sowohl mit 6 x R-CHOP-14 + 2R als auch mit 8 x R-CHOP-14 gegenüber 6 x CHOP-14 und 8 x CHOP-14, deren Überlebenskurven praktisch identisch waren, signifikant verbessert werden, aber nur 6 x R-CHOP-21 + 2R, nicht aber 8 x R-CHOP-21 verbesserte das Gesamtüberleben (OS) gegenüber dem alten Standard 6 x CHOP-14 signifikant (Abb. 2).
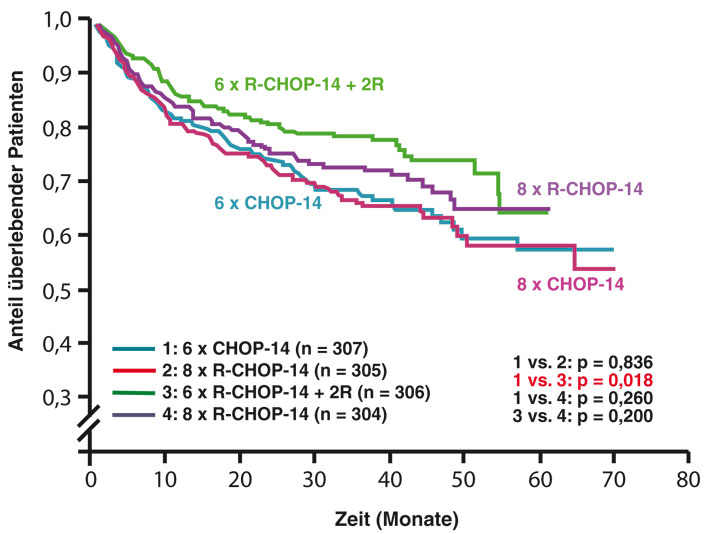
Parallel zur RICOVER-60-Studie führte die französische Groupe d'Etude des Lymphomes de l'Adulte (GELA) die zu RICOVER-60 komplementäre LNH03-6B-Studie durch [8]. Sie ging der Frage nach, ob die Ergebnisse mit
8 x R-CHOP-21 bei älteren Patienten durch eine Intervallverkürzung (8 x R-CHOP-14 anstelle von 8 x R-CHOP-21) weiter verbessert werden können. Leider litt diese Studie daran, dass vor allem zu Beginn die für eine reibungslose Durchführung von CHOP-14 notwendigen supportiven Maßnahmen nicht beachtet wurden, insbesondere gab es keine Vorphasen-Therapie, und die Gabe von G-CSF war nicht obligat. Dies führte zu einer inakzeptablen Rate therapieassoziierter Todesfälle von 9% bei den ersten 100 mit R-CHOP-14 behandelten Patienten. Auch lag die mit R-CHOP-14 erreichte relative Dosisintensität in der französischen Studie (nach Berechnungen der GELA) nur bei 87% (nach Berechnungen der DSHNL < 80%) – im Gegensatz zu RICOVER-60, wo sie bei sechs bzw. acht Zyklen (R)-CHOP-14 bei 99% bzw. 96% lag.
Auch eine britische Studie beobachtete hinsichtlich Wirksamkeit und Nebenwirkungen von R-CHOP-14 und R-CHOP-21 bei jeweils 540 Patienten im Alter von 18 bis 80 Jahren mit DLBCL aller Stadien und IPI-Gruppen keinen Unterschied [9]. Wegen gleicher Wirksamkeit und vergleichbarer Nebenwirkung empfehlen daher die ESMO-Guidelines von 2012 [10] für ältere Patienten entweder 6 x R-CHOP-14 + 2R oder 8 x R-CHOP-21. Obwohl außerhalb von Studien oft gegeben, kann 6 x R-CHOP-21 für ältere Patienten nicht empfohlen werden, weil es für diese Strategie bei älteren Patienten keine prospektiven Daten gibt.
Die DSHNHL hat sich für 6 x R-CHOP-14 + 2R als Standard für ältere Patienten mit aggressivem B-Zell-Lymphom entschieden, weil die Zeit unter Chemotherapie mit 6 x R-CHOP-14 + 2R mit etwas mehr als zehn Wochen weniger als halb so lange ist wie mit 8 x R-CHOP-21 (21 Wochen), was gerade bei älteren Patienten einen großen psychologischen Vorteil ausmacht. Außerdem erwarten wir weniger Langzeit-Nebenwirkungen in Form von Anthrazyklin-bedingten Herzinsuffizienzen und Sekundär-Neoplasien, da 6 x R-CHOP-14 eben nur 75% der gesamten Chemotherapie-Dosis von 8 x R-CHOP-21 enthält. Für die kardiale Toxizität konnte das bereits gezeigt werden, für die Sekundär-Neoplasien ist noch eine längere Beobachtungszeit nötig.
Therapiestrategisch unterscheidet die DSHNHL vier Gruppen älterer Patienten mit aggressivem B-Zell-Lymphom:
1. Ältere Patienten (61–80 Jahre) ohne weiteren Risikofaktor und ohne Bulk,
2. alle übrigen Patienten dieser Altersgruppe,
3. sehr alte Patienten (> 80 Jahre) und jüngere Patienten mit Komorbiditäten,
4. gebrechliche Patienten
1.1. Ältere Patienten ohne weiteren Risikofaktor und ohne Bulk
Für ältere Patienten ohne weiteren IPI-Risikofaktor und ohne Bulk gibt es nur wenige prospektive Daten für eine Rituximab enthaltende Therapie. In der RICOVER-60-Studie betrugen die 3-Jahres-Raten dieser Patienten für das EFS 81%, für das PFS 88% und für das OS 89% gegenüber 60%, 66% und 71% bei den übrigen Patienten („less favourable“) dieser Altersklasse.
In der OPTIMAL>60 Studie wird daher versucht, durch eine größere Individualisierung der Therapie die Gesamtprognose der Gruppe der „favourable“ älteren Patienten zu verbessern. Davon ausgehend, dass einerseits Patienten mit einem negativen PET (Positronenemissions-Tomografie) nach 4 x R-CHOP-14 eine ausgezeichnete Prognose haben, andererseits Patienten mit einem positiven PET mit der in RICOVER-60 verfolgten Strategie (6 x R-CHOP-14 + 2R ohne Bestrahlung) nur unzureichend therapiert sein dürften, erhalten diese Patienten bei einem positiven PET-CT nach 4 x R-CHOP-14 insgesamt 6 x R-CHOP-14 + 2R mit einer zusätzlichen Bestrahlung mit 36 Gy aller ursprünglich befallenen Lymphknoten („involved-node“) und damit eine im Vergleich zur RICOVER-60-Studie (6 x R-COP-14 ohne Bestrahlung) für diese Patientengruppe intensivere Therapie.
1.2. Alle übrigen älteren Patienten
(61–80 Jahre, IPI = 1 mit Bulk, IPI = 2–5)
Während die mediane relative Dosisintensität in RICOVER-60 für Cyclophosphamid und Doxorubicin 99% (sechs Zyklen [R]-CHOP-14) bzw. 96% (acht Zyklen) betrug, erhielten wegen Polyneuropathie 22% der Patienten im sechsten und 35% im achten Zyklus kein Vincristin mehr. Gerade bei älteren Patienten stellt die Vincristin-Polyneuropathie ein „unmet medical need“ dar. In der OPTIMAL>60-Studie erhalten alle Patienten dieser Gruppe sechs Zyklen R-CHOP-14 und werden auf
1,4 mg/m2 (maximal 2 mg absolut) konventionelles oder 2,0 mg/m2 (nicht „gedeckeltes“) liposomales Vincristin randomisiert. In einem faktoriellen Design erfolgt eine zweite Randomisierung in acht Applikationen Rituximab (375 mg/m2) oder in zwölf Applikationen eines zeitlich „optimierten“ Schemas, das sowohl Komponenten des DENSER-CHOP14 als auch des SMARTE-R-CHOP-14 enthält. Eine Bestrahlung ursprünglicher Bulk-Befälle erfolgt nur, wenn diese im PET nach Abschluss der Immunchemotherapie noch positiv sind. Eine erste Zwischenauswertung ergab, dass bei vergleichbarer Toxizität ungefähr die doppelte Gesamtdosis liposomales Vincristin gegeben werden kann. Ob diese Verdoppelung der Vincristin-Dosis tatsächlich zu einer Verbesserung der Ergebnisse führt, werden die Ergebnisse der OPTIMAL>60-Studie zeigen.
Andere Therapiestrategien, die bei dieser Gruppe von älteren Patienten derzeit geprüft werden, sind u. a. eine randomisierte Erhaltungstherapie mit Lenalidomid vs. Beobachtung nach sechs bis acht Zyklen R-CHOP-21
(REMARC-Studie der GELA/LYSA), eine randomisierte Konsolidierung mit Ibritumomab-Tiuxetan vs. Beobachtung (ZEST-Studie der HOVON-Gruppe), ein randomisierter Vergleich von R-CHOP-21 vs. R-CHOP-21 + Revlimid bei DLBCL vom ABC-Typ (Studie der italienischen FIL und der Mayo-Klinik) sowie ein Vergleich von Rituximab 375 mg/m2 mit Obinutuzumab 1.000 mg (GOYA-Studie von Roche).
1.3. Sehr alte Patienten
Es gibt nur wenige Studien mit Patienten im Alter von > 80 Jahren [11] und bisher nur eine prospektive Therapiestudie für diese Patienten [12], wo 150 Patienten > 80 Jahre (median
83 Jahre) ein Dosis-reduziertes CHOP-Schema mit Rituximab („R-miniCHOP“) erhielten. Die mediane Überlebenszeit betrug 29 Monate und die Gesamtüberlebensrate nach zwei Jahren 59%. Trotz der ca. 50%igen Dosisreduktion gab es 8% Therapie-assoziierte Todesfälle, die meisten nach dem ersten Zyklus, und die Autoren glauben, dass diese Rate durch Einführung einer Vorphasen-Therapie noch deutlich gesenkt werden könnte. Die Interpretation dieser Studie ist schwierig, denn die eingeschlossenen Patienten stellen eine Selektion dar und repräsentieren nicht den typischen „Octogenarier“ mit
DLBCL, wie wir ihn aus unserer täglichen Praxis kennen. Dennoch überraschen die vergleichsweise hohe Hämatotoxizität und Therapie-assoziierte Mortalität trotz ausgeprägter Dosisreduktion, und ausgehend von den Erfahrungen der SMARTE-R- [13] und SEXIE-R-CHOP-14-Studien [14] der DSHNHL kann man davon ausgehen, dass es möglich sein sollte, nicht nur durch eine Vorphasen-Therapie, sondern auch durch eine Rituximab-Applikation über einen längeren Zeitraum bzw. durch eine höhere Rituximab-Dosierung die Ergebnisse von „R-miniCHOP“ deutlich zu verbessern, ohne die Nebenwirkungen zu erhöhen. Da aber die „R-miniCHOP“-Studie die einzige prospektive Therapiestudie für diese Altersgruppe ist, muss es bis auf Weiteres als Standardtherapie für diese Altersgruppe gelten.
1.4. Gebrechliche („fragile“) Patienten
In einer der wenigen prospektiven Studien mit gebrechlichen Patienten behandelte die italienische Studiengruppe FIL 100 Patienten mit über
70 Jahren, die die Definition von „fragil“ oder gebrechlich nach Gallucci [15, 16] erfüllten, entsprechend dem Ergebnis eines modifizierten kompletten geriatrischen Assessments (CGA) und abhängig von ihren Komorbiditäten und Fähigkeiten entsprechend der ADL (Activities of Daily Living) und IADL (Instrumental Activities of Daily Living) mit reduzierten Dosen eines oder mehrerer Zytostatika des CHOP-Schemas in Kombination mit Rituximab. Die Nebenwirkungen waren gering und die komplette Remissionsrate lag bei 81%, mit nur 14% Neutropenien vom Grad 4. Die Überlebensrate nach fünf Jahren betrug 60%. Die Autoren kommen zu dem Schluss, dass CGA-basierte Dosisanpassungen zu akzeptablen Nebenwirkungsraten und sehr guten Therapieerfolgen und letztlich höheren Heilungsraten bei Patienten mit DLBCL führen [17]. Nachdenklich stimmt, dass diese Ergebnisse deutlich besser erscheinen als die mit „R-miniCHOP“ berichteten bei einer prognostisch sicher wesentlich besseren DLBCL-Population in der französischen Studie [12].
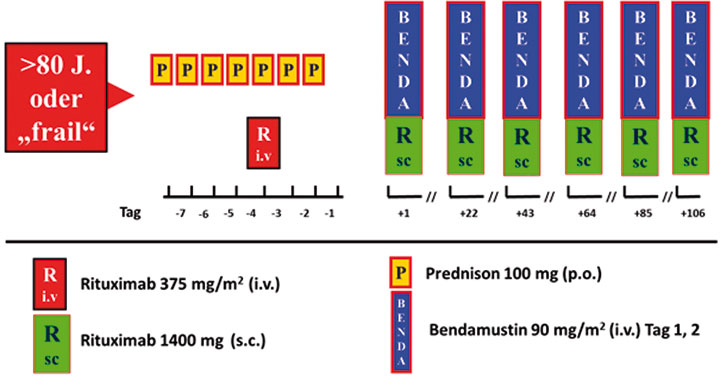
Die DSHNHL bietet für Patienten
> 80 Jahre und gebrechliche Patienten (CIRS > 6) die „BRENDA“-Studie an, in der Bendamustin mit Rituximab alle drei Wochen gegeben wird (Abb. 3).
2. Junge Patienten
Die DSHNHL unterscheidet drei Subpopulationen von jungen Patienten hinsichtlich Prognose und Prognose-adaptierter Therapiestrategie:
1. Junge Patienten mit guter Prognose („favourable“, d. h. aaIPI = 0 ohne Bulk),
2. junge Patienten mit guter Prognose („unfavourable“, d. h. aaIPI = 0 mit Bulk, aaIPI = 1),
3. junge Patienten mit ungünstiger Prognose (aaIPI = 2, 3).
Für die Patienten der ersten beiden Gruppen hat die MInT-Studie [18, 19] mit 6 x R-CHOP-21 plus Bestrahlung des ursprünglichen Bulk den gegenwärtigen Standard definiert. Bulk war ein signifikanter Risikofaktor in der MInT-Studie, der es erlaubte, die jungen Patienten mit guter Prognose weiter in zwei Untergruppen zu unterteilen: Einmal in Patienten ohne Risikofaktor entsprechend aaIPI und ohne Bulk („favourable“ Untergruppe: Stadium I + II ohne Bulk und ohne aaIPI-Risikofaktor) und eine „unfavourable“ Untergruppe (alle aaIPI = 1 und aaIPI = 0 mit Bulk).
2.1. Junge Patienten mit guter Prognose („favourable“)
Die „favourable“ Subgruppe hat ein EFS von > 90% und ein Gesamtüberleben von nahezu 100%. Diese Zahlen legen nahe, dass zumindest ein Teil der jungen “favourable“ Patienten mit 6 x R-CHOP-21 übertherapiert ist. Daher werden diese „favourable“ Patienten in der FLYER-Studie randomisiert in den MInT-Standard von 6 x R-CHOP-21 oder 4 x R-CHOP-21 + 2R. Eine geplante Sicherheitsanalyse nach 400 Patienten zeigte, dass die Studie sicher ist auch für Patienten im CHOP-reduzierten experimentellen Arm. Da es sich bei der FLYER-Studie um eine „Non-inferiority“-Studie handelt, wird man erst nach 600 Patienten statistisch solide zeigen können, dass 4 x R-CHOP-21 + 2R dem 6 x R-CHOP-21 bei dieser Patientengruppe therapeutisch ebenbürtig ist.
2.2. Junge Patienten mit guter Prognose („unfavourable“)
Die „unfavourable“ Subgruppe hat zwar ein Gesamtüberleben von ca. 90%, allerdings liegt das ereignisfreie Überleben nach fünf Jahren bei nur ca. 75% [19]; das bedeutet, dass ungefähr ein Viertel dieser Patienten eine Salvagetherapie benötigt, was in dieser Altersgruppe im Allgemeinen eine Hochdosistherapie mit autologer Stammzelltransplantation mit all ihren akuten und langfristigen Nebenwirkungen, insbesondere einem erhöhten Risiko für Sekundär-Neoplasien beinhaltet. Es muss daher das Ziel sein, das EFS bzw. PFS dieser Patienten zu verbessern.
Die LNH03-2B der französischen GELA verglich 8 x R-CHOP-21 mit dem ACVBP-14-Protokoll, einer Modifikation von CHOP-14 mit Dosiseskalation plus zusätzlichem Zytostatikum (Bleomycin), gefolgt von einer Konsolidierung mit Hochdosis-Methotrexat, Ifosfamid und Hochdosis-Cytosinarabinosid. Dieses aggressive und nebenwirkungsreiche Programm erwies sich als signifikant besser als 8 x R-CHOP-21 im Hinblick auf alle Therapie-Erfolgsparameter einschließlich Gesamtüberleben. Allerdings waren die Nebenwirkungen von R-ACVBP signifikant und klinisch relevant höher als mit 8 x R-CHOP-21 [20]: So gab es viermal häufiger Fieber in der Neutropenie mit R-ACVBP im Vergleich zu 8 x R-CHOP-21. Ein Vergleich der Ergebnisse der LNH03-2B-Studie mit den Ergebnissen der Patienten mit aaIPI = 1 in der MInT-Studie zeigt, dass 8 x R-CHOP-21 in der französischen Studie erheblich schlechter war als 6 x R-CHOP-21 in der MInT-Studie; in der Tat erscheint
6 x R-CHOP-21 in der MInT-Studie ebenso gut zu sein wie R-ACVBP in der französischen Studie. Dies lässt sich nur durch die Tatsache erklären, dass in der GELA-Studie ebenso wie in allen anderen GELA-Studien mit Rituximab auf die Strahlentherapie verzichtet wurde, in der MInT-Studie Bulk und extralymphatische Manifestationen jedoch konsequent bestrahlt wurden.
Die UNFOLDER-Studie randomisiert junge Patienten mit aaIPI = 1 und aaIPI = 0 mit Bulk in den MInT-Standard von 6 x R-CHOP-21 oder 6 x R-CHOP-14. Patienten mit Bulk oder Extranodal-Befall erhielten eine zweite Randomisierung in Strahlentherapie (39,6 Gy) der entsprechenden Manifestationen oder Beobachtung. Eine geplante Zwischenanalyse zeigte einen hochsignifikanten Vorteil für die Patienten, die in die Arme mit Bestrahlung randomisiert worden waren. Das Signifikanzniveau (p = 0,004) lag noch über dem Abbruchkriterium (p = 0,008), sodass beide Arme ohne Strahlentherapie geschlossen werden mussten. Die Studie wird mit den beiden Armen 6 x R-CHOP-21 vs. 6 x R-CHOP-14 fortgesetzt, wobei jetzt alle Patienten mit Bulk und/oder extralymphatischem Befall eine Bestrahlung dieser Regionen erhalten.
2.3. Junge Patienten mit ungünstiger Prognose (aaIPI = 2, 3)
Der erste formale Nachweis, dass junge Patienten mit ungünstiger Prognose ebenso wie ältere und jüngere Patienten mit guter Prognose von Rituximab profitieren, gelang in der Mega-CHOEP-Studie [21] der DSHNHL. Patienten waren ursprünglich nicht nur für CHOEP-14 vs. Mega-CHOEP, sondern in einem 2x2-faktoriellen Design auch für alleinige Chemotherapie vs. zusätzliches Rituximab randomisiert worden. Als die Ergebnisse der MInT-Studie bei jungen Patienten mit aaIPI = 0 oder 1 einen hochsignifikanten Vorteil für die Hinzunahme von Rituximab zeigten, wurden die beiden Arme der Mega-CHOEP-Studie ohne Rituximab geschlossen. Bis dato hatten nur 31 Patienten kein Rituximab erhalten; dennoch zeigte der Vergleich dieser 31 Patienten ohne Rituximab mit den 262 Patienten, die in der gesamten Mega-CHOEP-Studie Rituximab erhalten hatten, einen hochsignifikanten Vorteil für die Immunchemotherapie, d. h. ein um fast 30% verbessertes EFS nach drei Jahren.
Die Mega-CHOEP-Studie war die erste Studie im Rituximab-Zeitalter, die eine Hochdosistherapie mit einer konventionellen „dosisdichten“ Therapie
(8 x R-CHOEP-14) verglich, wobei in beiden Armen dieselben Zytostatika eingesetzt wurden. Damit ist die Mega-CHOEP-Studie die bisher wissenschaftlich „reinste“ Studie, die eine konventionell dosierte dosisdichte Zytostatika-Kombination mit derselben Kombination in maximal eskalierter Dosis verglich. Eine geplante Interimsanalyse der Mega-CHOEP-Studie zeigte, dass der aggressive R-Mega-CHOEP-Ansatz mit dreimaliger Hochdosistherapie und autologer Stammzelltransplantation deutlich toxischer, aber keinesfalls wirksamer war als acht Zyklen R-CHOEP-14; Patienten mit aaIPI = 2 hatten sogar ein signifikant besseres 3-Jahres-Überleben mit 8 x R-CHOEP-14 verglichen mit R-Mega-CHOEP. Die Studie wurde daher vorzeitig beendet [22].
Eine bisher nur in Abstract-Form publizierte italienische Studie verglich in einem 2x2-faktoriellen Design Dosis-eskaliertes R-Mega-CHOP-14 mit R-CHOP-14 und in einer zweiten Randomisierung in einem 2x2-faktoriellen Design bei Patienten mit einem Ansprechen auf R-CHOP14/R-Mega-CHOP-14 die Fortsetzung der konventionellen Therapie über vier weitere Zyklen oder eine Konsolidierung der Patienten, die auf vier Zyklen R-CHOP-14 oder R-Mega-CHOP-14 angesprochen hatten, mit MAD (Mitoxantron, hochdosiertes Cytosinarabinosid, Dexamethason), gefolgt von Hochdosis-BEAM und autologer Stammzelltransplantation. Im Gegensatz zur Mega-CHOEP-Studie beobachteten die italienischen Kollegen einen signifikanten Vorteil für das Hochdosis-Konzept im Hinblick auf das progressionsfreie Überleben; allerdings zeigte sich kein Unterschied im Gesamtüberleben, sodass auch die italienischen Autoren zu dem Schluss kommen, dass eine primäre Hochdosistherapie für junge Patienten mit schlechter Prognose nicht gerechtfertigt ist: Bei einer Überlebensrate von fast 80% hieße dies, dass 80% aller Patienten unbegründet eine Hochdosistherapie mit Stammzell-Support erhalten würden.
Zu ähnlichen Ergebnissen wie die italienische kommt die nach der Mega-CHOEP-Studie zweite Studie zur primären Hochdosistherapie in der Rituximab-Ära, die vollständig publiziert wurde [23]: In dieser amerikanischen Intergroup-Studie wurden Patienten, die nach 5 x R-CHOP-21 eine partielle oder komplette Remission erzielt hatten, randomisiert für drei weitere Zyklen R-CHOP-21 oder Hochdosis-BEAM und autologe Stammzelltransplantation. Es fand sich ein signifikanter Vorteil für den Hochdosis-Ansatz im progressionsfreien, jedoch nicht im Gesamtüberleben. Problematisch ist, dass in der Veröffentlichung der amerikanischen Studie im New England Journal of Medicine nur die Patienten gezeigt werden, die nach 5 x R-CHOP-21 eine partielle oder komplette Remission erreicht hatten; mit den wahrscheinlich rund 25% der Patienten, die keine Remission erreicht haben, sähen alle Kurven wesentlich schlechter aus. Das einzige Verdienst dieser Studie ist, dass sie die erste im Rituximab-Zeitalter ist, die R-CHOP-21 bei jungen Patienten mit schlechter Prognose geprüft und gezeigt hat, dass 8 x R-CHOP-21 bei diesen Patienten eigentlich nicht mehr gegeben werden dürfte.
Insgesamt wurden die besten Ergebnisse bei jungen Hochrisikopatienten mit 8 x R-CHOEP-14 erzielt. Dabei waren die Ergebnisse der Patienten mit aaIPI = 2 (mit intermediär-hohem Risiko) mit einem Überleben von 90% nach drei Jahren so ausgezeichnet, dass man dieser Gruppe schwerlich noch eine schlechte Prognose attestieren kann; vielmehr dürfte es schwer sein, ihre Ergebnisse in randomisierten Studien noch einmal signifikant zu verbessern.
Nach dem gegenwärtigen Stand der Dinge erscheint die Beantwortung folgender Fragen hinsichtlich der Therapie junger Hochrisiko-Patienten vordringlich: 1. Ist R-CHOEP-14 besser als
R-CHOP-14? 2. Sind acht Zyklen R-CHOEP-14 besser als sechs? Hinsichtlich der ersten Frage ergab eine
Matched-pair-Analyse der in der deutschen Mega-CHOEP mit 8 x R-CHOEP-14 behandelten Patienten, dass die Ergebnisse der Patienten mit R-CHOEP-14 besser waren als die nach R-CHOP-14 [24]. Für eine Überlegenheit von R-CHOEP-14 über R-CHOP-14 bei dieser Patientengruppe spricht auch eine dänische Registerstudie, die ebenfalls bessere Ergebnisse mit R-CHOEP-14 gezeigt hatte [25].
Angesichts einer wahren Flut von neuen und vielversprechenden Medikamenten sollten junge Patienten mit aaIPI = 3, ggfs. auch mit aaIPI = 2 nur innerhalb prospektiver (und möglichst) randomisierter Studien behandelt werden. Zu den vielversprechenden Medikamenten zählen unter anderen der Inhibitor der Bruton-Tyrosinkinase Ibrutinib, der bevorzugt beim ABC-Subtyp der DLBCL [26] sowie der BCL2-Inhibitor ABT199, der bei den DLBCL vom GC-Typ besser wirksam sein soll.
3. Extranodale NHL
Obwohl Lymphome, die sich in extralymphatischen Organen manifestieren, mit spezifischen klinischen Charakteristika und besonderen natürlichen Verläufen assoziiert sind, werden diese Besonderheiten weder in der WHO-Klassifikation noch im International Prognostic Index berücksichtigt. Dennoch haben sich für bestimmte extranodale Primärmanifestationen besondere therapeutische Strategien entwickelt, die mehr oder weniger von den Therapieempfehlungen für nodale aggressive Lymphome abweichen. Für Lymphome des Hodens und des Skeletts beschränken sich die therapeutischen Besonderheiten wegen des hohen Risikos eines meningealen oder ZNS-Befalls bei diesen Manifestationen auf die Empfehlung einer grundsätzlich durchzuführenden ZNS-Prophylaxe.
Die primären Lymphome des ZNS und die primären gastrointestinalen Lymphome zeigen ein für die jeweilige Primärlokalisation recht Typ-spezifisches Verhalten, das sich deutlich von dem der primär nodalen und von anderen extranodalen Lokalisationen ausgehenden Lymphome unterscheidet. Die primären Lymphome des ZNS und des Gastrointestinaltrakts sind daher nicht Gegenstand dieses Überblicks.
4. Spezielle Therapieansätze für histologisch definierte Subgruppen aggressiver Lymphome
Die Therapieergebnisse bei aggressiven Lymphomen stützen sich weitgehend auf die Behandlungsergebnisse bei diffusen großzelligen B-Zell-Lymphomen, die mehr als zwei Drittel der aggressiven NHL ausmachen. Es gibt Hinweise darauf, dass sich die Prognosen bestimmter Subentitäten der aggressiven Lymphome deutlich voneinander unterscheiden: So ist es z. B. weitgehend akzeptiert, dass ein T-Zell-Phänotyp (mit der Ausnahme des ALK-positiven großzelligen anaplastischen T-Zell-Lymphoms) ein unabhängiger ungünstiger Prognosefaktor ist.
Ähnlich konnte für die immunoblastische Variante des diffusen großzelligen B-Zell-Lymphoms in retrospektiven Analysen sowohl vor [27] als auch nach Einführung von Rituximab [28] eine schlechtere Prognose gezeigt werden.
Hinsichtlich des primären mediastinalen B-Zell-Lymphoms (PMBCL; [29–31]) zeigte die MInT-Studie, dass die PMBCLs ohne Rituximab eine schlechtere Prognose haben als die übrigen DLBCL, dieser Unterschied wird aber aufgehoben, wenn zur Chemotherapie Rituximab hinzugegeben wird [32]. Eine kleine amerikanische Studie mit nur 48 Patienten zeigt hervorragende Ergebnisse mit DA-EPOCH-R (einer dosisadaptierten Variante des CHOEP-Schemas mit Dauerinfusion von Doxorubicin, Vincristin und Etoposid ohne Strahlentherapie; [33]). Eine daraufhin erfolgte Überprüfung der innerhalb der UNFOLDER-Studie behandelten 69 Patienten mit PMBCL ergab nach einer medianen Beobachtungszeit von mehr als drei Jahren eine Gesamtüberlebensrate von 100%, sodass sich keine Notwendigkeit ergibt, diese Patienten mit DA-EPOCH-R oder außerhalb der UNFOLDER-Studie zu behandeln.
Auch für „B-Zell-Lymphome, unklassifizierbar mit Eigenschaften zwischen DLBCL und Burkitt-Lymphom“ („B-cell lymphoma, unclassifiable, with features intermediate between DLBCL and Burkitt lymphoma“: BCLUWFIBDLBCLABL), die häufig einen Bruch im MYC-Gen alleine oder kombiniert mit einem BCL2- und/oder BCL6-Bruch („double hit“ bzw. „triple hit“) aufweisen, gibt es keine allgemein akzeptierte Differenzialtherapien, wenn auch in einer kleinen monozentrischen Studie ermutigende Ergebnisse mit (einmal mehr!) DA-EPOCH-R berichtet wurden [34].
Auch wenn man akzeptiert, dass bestimmte Subgruppen der aggressiven Lymphome eine schlechtere Prognose haben, sollten diese Subgruppen innerhalb prospektiver Studien zusammen und ebenso wie die übrigen DLBCL behandelt werden. Denn spezifische Therapiemaßnahmen (z. B. Hochdosis-Chemotherapie, Strahlentherapie, zeitintensivierte Therapien) können nur dann als vorteilhaft identifiziert werden, wenn möglichst viele Subgruppen von aggressiven Lymphomen in große randomisierte Studien eingeschlossen werden, da nur solche Studien eine prospektive kontrastierende Analyse der entsprechenden Subgruppen und die Identifikation von Interaktionen zwischen unterschiedlichen Therapiearmen und histologischen Subtypen erlauben. Andernfalls würde man sich der Chance begeben, entsprechende Interaktionen zu identifizieren und darauf aufbauend differenzialtherapeutische Ansätze entwickeln zu können.
5. Prophylaxe und Therapie eines ZNS-Befalls
Beim DLBCL und anderen aggressiven B-Zell-Lymphomen ist eine prophylaktische ZNS-Bestrahlung als alleinige Maßnahme oder in Kombination mit einer intrathekalen oder systemischen Chemotherapie-Prophylaxe obsolet. Ein ZNS-Rezidiv eines aggressiven Lymphoms wird bei 5–30% aller Patienten beobachtet. Es ist fast immer tödlich und begründet eine prophylaktische Therapie des ZNS [35].
Nur wenige Studien haben das Risiko eines ZNS-Befalls unter kombinierter Therapie mit Rituximab analysiert. Die Analyse der RICOVER-60-Studie zeigte, dass eine intrathekale Prophylaxe mit Methotrexat (MTX) bei Patienten, die kein Rituximab erhielten, das Risiko eines ZNS-Rezidivs verringerte; dies war jedoch nicht der Fall bei Patienten, die CHOP-14 mit Rituximab erhalten hatten. Rituximab hat die Rate an ZNS-Rezidiven signifikant reduziert [36], und zwar von 6,9% auf 4,1%. Da die intrathekale MTX-Prophylaxe noch nicht einmal das Risiko eines ausschließlich meningealen Befalls reduzierte, muss man diese Art der ZNS-Prophylaxe im Zeitalter von Rituximab deshalb als obsolet bezeichnen.
Die oben genannte Analyse der
RICOVER-Studie identifizierte bei älteren Patienten drei Risikofaktoren, bei deren gemeinsamem Auftreten unter R-CHOP-14 ein 35%iges (!) Risiko eines ZNS-Befalls besteht: erhöhte LDH, > 1 extralymphatischer Befall sowie ein ECOG-Performancestatus > 1. Ob und welche prophylaktische Maßnahme dieses hohe Risiko vermindern kann, ist unklar. Da ZNS-Befall früh auftritt, erhalten Patienten mit drei ZNS-Risikofaktoren (sowie ältere Patienten mit Hodenbefall) in der OPTIMAL>60-Studie zwei Zyklen hochdosiertes Methotrexat (1,5 g/m2), und zwar jeweils vor dem ersten und nach dem letzten (sechsten) R-CHOP-14-Zyklus. Bei Patienten mit zwei ZNS-Risikofaktoren empfiehlt die DSHNHL eine Liquorpunktion mit durchflusszytometrischer Analyse der Zellen im Liquor. Bei Nachweis von Lymphomzellen empfiehlt sie ebenso wie bei einem ZNS-Rezidiv eine Therapiestrategie, die wegen der Häufigkeit eines gleichzeitigen nodalen Rezidivs nicht nur die Erkrankung im ZNS, sondern auch die der peripheren Lymphom-Manifestationen angeht [37].
6. Nebenwirkungen
Die Nebenwirkungen von CHOP und CHOEP nehmen durch Rituximab kaum zu. Allerdings ist die Rate viraler Erkrankungen (insbesondere Herpes zoster) bei Patienten unter Rituximab erhöht. Als Prophylaxe gegen Pneumocystis-jerovici-Pneumonien sowie CMV-Reaktivierungen empfiehlt die DSHNHL Aciclovir (4 x 400 mg/d) sowie Cotrimoxazol (2 x eine Doppeldosis an zwei Tagen der Woche) zusätzlich zur Gabe von Ciprofloxacin während einer Leukozytopenie von weniger als 1.000/mm3 bzw. Neutropenie von weniger als 500/mm3. Tatsächlich fiel nach Einführung dieser Prophylaxe in der OPTIMAL>60-Studie die Rate therapieassoziierter Todesfälle, bei den ersten 300 Patienten sogar unter 1%.
Sechs bis acht Zyklen CHOP haben meist nur temporäre Auswirkungen auf die männliche und weibliche Fertilität: Die Oligospermie dauert meist sechs bis 18 Monate, wonach es in der Regel zur Erholung kommt. Dauernde Infertilität nach den im CHOP-Schema verabreichten Cyclophosphamid-Gesamtdosen (4,5–6 g/m2) ist die Ausnahme, wenn nicht zusätzlich das Becken bestrahlt wird [38]. Angesichts der schwachen Datenlage ist allerdings nicht auszuschließen, dass es bei einigen Männern doch zu dauernder Infertilität kommt, und bei Frauen mit erholter Ovarialfunktion das Risiko einer verfrühten Menopause besteht [39]. Für CHOEP gibt es nur wenige Daten, die allerdings auf kein erhöhtes Fertilitätsrisiko nach CHOEP im Vergleich zu CHOP hindeuten [40]. Kommt es zu Schwangerschaften, so verlaufen diese meist erfolgreich, allerdings besteht ein erhöhtes Risiko für Frühgeburten und Untergewichtigkeit der Säuglinge [41–43].
Literatur
1. Fisher RI et al. Comparison of a standard regimen (CHOP) with three intensive chemotherapy regimens for advanced non-Hodgkin's lymphoma. N Engl J Med 1993; 328: 1002-6.
2. The International Non-Hodgkin's Lymphoma Prognostic Factors Project. A predictive model for aggressive non-Hodgkin's lymphoma. N Engl J Med 1993; 329: 987-94.
3. Armitage JO. Treatment of non-Hodgkin's lymphoma. N Engl J Med 1993; 328: 1023-30.
4. Tirelli U et al. CHOP is the standard regimen in patients > or = 70 years of age with intermediate-grade and high-grade non-Hodgkin's lymphoma: Results of a randomized study of the European Organization for Research and Treatment of Cancer Lymphoma Cooperative Study Group. J Clin Oncol 1998; 16: 27-34.
5. Zhou Z et al. An enhanced International Prognostic Index (NCCN-IPI) for patients with diffuse large B-cell lymphoma treated in the rituximab era. Blood 2014; 123: 837-42.
6. Connors JM, O'Reilly SE. Treatment considerations in the elderly patient with lymphoma. Hematol Oncol Clin North Am 1997; 11: 949-61.
7. Pfreundschuh M et al. Six versus eight cycles of bi-weekly CHOP-14 with or without rituximab in elderly patients with aggressive CD20+ B-cell lymphomas: a randomised controlled trial (RICOVER-60). Lancet Oncol 2008; 9: 105-16.
8. Delarue R et al. Dose-dense rituximab-CHOP compared with standard rituximab-CHOP in elderly patients with diffuse large B-cell lymphoma (the LNH03-6B study): a randomised phase 3 trial. Lancet Oncol 2013; 14: 525-33.
9. Cunningham D et al. Rituximab plus cyclophosphamide, doxorubicin, vincristine, and prednisolone in patients with newly diagnosed diffuse large B-cell non-Hodgkin lymphoma: A phase 3 comparison of dose intensification with 14-day versus 21-day cycles. Lancet 2013; 381: 1817-26.
10. Ghielmini M et al. ESMO Guidelines consensus conference on malignant lymphoma 2011 part 1: Diffuse large B-cell lymphoma (DLBCL), follicular lymphoma (FL) and chronic lymphocytic leukemia (CLL). Ann Oncol 2013; 24: 561-76.
11. Thieblemont C et al. Non-Hodgkin's lymphoma in very elderly patients over 80 years. A descriptive analysis of clinical presentation and outcome. Ann Oncol 2008; 19: 774-9.
12. Peyrade F et al. Attenuated immunochemotherapy regimen (R-miniCHOP) in elderly patients older than 80 years with diffuse large B-cell lymphoma: A multicentre, single-arm, phase 2 trial. Lancet Oncol 2011; 12: 460-8.
13. Pfreundschuh M et al. Improved outcome of elderly poor-prognosis DLBCL patients with 6xCHOP-14 and 8 applcations of rituximab given over an extended period: Results of the SMARTE-R-CHOP-14 trial of the German High-Grad Non-Hodgkin Lymphoma Study Group (DSHNHL). Blood 2011; 118(21): 272a-273a (ASH 2011, Abstract #592).
14. Pfreundschuh M et al. Increased rituximab doses eliminate increased risk of elderly male patients with aggressive CD20+ B-cell lymphomas: Results from the SEXIE-R-CHOP-14 trial of the DSHNHL. J Clin Oncol 2014; 32(15S): 539s (ASCO 2014, Abstract #8501).
15. Balducci L, Beghe C. The application of the principles of geriatrics to the management of the older person with cancer. Crit Rev Oncol Hematol 2000; 35: 147-54.
16. Balducci L. Aging, frailty, and chemotherapy. Cancer Control 2007; 14: 7-12.
17. Spina M et al. Modulated chemotherapy according to modified comprehensive geriatric assessment in 100 consecutive elderly patients with diffuse large B-cell lymphoma. Oncologist 2012; 17: 838-46.
18. Pfreundschuh M et al. CHOP-like chemotherapy plus rituximab compared with CHOP-like chemotherapy alone in young patients with good-prognosis diffuse large B-cell lymphoma: A randomized controlled trial by the Mabthera International Trial (MInT) Group. Lancet Oncol 2006; 7: 379-91.
19. Pfreundschuh M et al. CHOP-like chemotherapy with or without rituximab in young patients with good-prognosis diffuse large-B-cell lymphoma: 6-year results of an open-label randomised study of the MabThera International Trial (MInT) Group. Lancet Oncol 2011; 12: 1013-22.
20. Recher C et al. Intensified chemotherapy with ACVBP plus rituximab versus standard CHOP plus rituximab for the treatment of diffuse large B-cell lymphoma (LNH03-2B): An open-label randomised phase 3 trial. Lancet 2011; 378: 1858-67.
21. Milpied NJ et al. Frontline high-dose chemotherapy with autologous stem cell transplantation vs. standard CHOP regimen for patients <60 years with non IPI high-risk intermediate or high-gread lymphomas. Final results of a randomized trial by the GOELAMS. Blood 2002; 100(11); 180a-181a (ASH 2002, Abstract #675).
22. Schmitz N et al. Conventional chemotherapy (CHOEP-14) with rituximab or high-dose chemotherapy (MegaCHOEP) with rituximab for young, high-risk patients with aggressive B-cell lymphoma: An open-label, randomised, phase 3 trial (DSHNHL 2002-1). Lancet Oncol 2012; 13: 1250-9.
23. Stiff PJ et al. Autologous transplantation as consolidation for aggressive non-Hodgkin's lymphoma. N Engl J Med 2013; 369: 1681-90.
24. Vitolo U et al. Comparison of R-CHOP-14 and R-CHOEP-14 as first line treatment in young patients with high risk (aaIPI 2-3) diffuse large B-cell lymphoma (DLBCL). A joint analysis of two prospective phase III randomized trials conducted by the Fondazione Italiana Linfomi (FIL) and the German High-Grade Non-Hodgkin Lymphome Study Group (DSHNHL). Blood 2013; 122(21): 185s (ASH 2013, Abstract #4341).
25. Gang AO et al. R-CHOEP-14 improves overall survival in young high-risk patients with diffuse large B-cell lymphoma compared with R-CHOP-14. A population-based investigation from the Danish Lymphoma Group. Ann Oncol 2012; 23: 147-53.
26. Wilson WH et al. The Bruton´s tyrosine kinase inhibitor ibrutinib (PCI-32765) has preferential activity in the ABC subtype of relapsed/refractory de novo diffuse large B-cell lymphoma: Interim results of a multicenter, open-label phase 2 study. Blood 2012; 120(21); 686 (ASH 2012, Abstract #686).
27. Engelhard M et al. Subclassification of diffuse large B-cell lymphomas according to the Kiel classification: Distinction of centroblastic and immunoblastic lymphomas is a significant prognostic risk factor. Blood 1997; 89: 2291-7.
28. Ott G et al. Immunoblastic morphology but not the immunohistochemical GCB/nonGCB classifier predicts outcome in diffuse large B-cell lymphoma in the RICOVER-60 trial of the DSHNHL. Blood 2010; 116: 4916-25.
29. Cazals-Hatem D et al. Primary mediastinal large B-cell lymphoma. A clinicopathologic study of 141 cases compared with 916 nonmediastinal large B-cell lymphomas, a GELA ("Groupe d'Etude des Lymphomes de l'Adulte") study. Am J Surg Pathol 1996; 20: 877-88.
30. Martelli MP et al. MACOP-B and involved field radiation therapy is an effective therapy for primary mediastinal large B-cell lymphoma with sclerosis. Ann Oncol 1998; 9: 1027-9.
31. Sehn LH et al. Primary diffuse large B-cell lymphoma of the mediastinum: Outcome following high-dose chemotherapy and autologous hematopoietic cell transplantation. Blood 1998; 91: 717-23.
32. Rieger M et al. Primary mediastinal B-cell lymphoma treated with CHOP-like chemotherapy with or without rituximab: Results of the Mabthera International Trial Group study. Ann Oncol 2011; 22: 664-70.
33. Dunleavy K et al. Dose-adjusted EPOCH-rituximab therapy in primary mediastinal B-cell lymphoma. N Engl J Med 2013; 368: 1408-16.
34. Dunleavy K et al. MYC+ aggressive B-cell lymphomas: Novel therapy for untreated Burkitt lymphoma and MYC+ diffuse large B-cell lymphoma with DA-EPOCH-R. Ann Oncol 2011; 22: iv106.
35. van Besien K et al. Risk factors, treatment, and outcome of central nervous system recurrence in adults with intermediate-grade and immunoblastic lymphoma. Blood 1998; 91: 1178-84.
36. Boehme V et al. CNS events in elderly patients with aggressive lymphoma treated with modern chemotherapy (CHOP-14) with or without rituximab: An analysis of patients treated in the RICOVER-60 trial of the German High-Grade Non-Hodgkin Lymphoma Study Group (DSHNHL). Blood 2009; 113: 3896-902.
37. Korfel A et al. Phase II study of central nervous system (CNS)-directed chemotherapy including high-dose chemotherapy with autologous stem cell transplantation for CNS relapse of aggressive lymphomas. Haematologica 2013; 98: 364-70.
38. Pryzant RM et al. Long-term reduction in sperm count after chemotherapy with and without radiation therapy for non-Hodgkin's lymphomas. J Clin Oncol 1993; 11: 239-47.
39. Meirow D. Ovarian injury and modern options to preserve fertility in female cancer patients treated with high dose radio-chemotherapy for hemato-oncological neoplasias and other cancers. Leuk Lymphoma 1999; 33: 65-76.
40. Meissner J et al. Parenthood in long-term survivors after CHOP with or without etoposide treatment for aggressive lymphoma. Br J Haematol 2014; 166: 612-5.
41. Sanders JE et al. Pregnancies following high-dose cyclophosphamide with or without high-dose busulfan or total-body irradiation and bone marrow transplantation. Blood 1996; 87: 3045-52.
42. Grigg AP et al. Reproductive status in long-term bone marrow transplant survivors receiving busulfan-cyclophosphamide (120 mg/kg). Bone Marrow Transplant 2000; 26: 1089-95.
43. Salooja N et al. Pregnancy outcomes after peripheral blood or bone marrow transplantation: A retrospective survey. Lancet 2001; 358: 271-6.

Dr. med. Lorenz Thurner
Prof. Dr. med. Michael Pfreundschuh
Klinik für Innere Medizin I
Universität des Saarlandes
Korrespondierender Autor:
Prof. Dr. med. Michael Pfreundschuh
Sprecher der Deutschen Studiengruppe
Hochmaligne Non-Hodgkin-Lymphome
Klinik für Innere Medizin I
Universität des Saarlandes
Kirrberger Str. 100, 66421 Homburg (Saar)
+49 6841 162-3002
+49 6841 162-3101
michael.pfreundschuh[at]uks[dot]eu

