Moderne Therapiekonzepte bei chronischer lymphatischer Leukämie
Till Seiler, Clemens-Martin Wendtner
Klinischer Verlauf
Die chronische lymphatische Leukämie (CLL) ist die häufigste Leukämie im Erwachsenenalter und ist charakterisiert durch eine stetige Akkumulation und Proliferation von monoklonalen CD5-positiven B-Lymphozyten im peripheren Blut, im Knochenmark und in lymphatischen Geweben, wie Lymphknoten, Milz und Leber. Das mediane Alter bei Erstdiagnose liegt bei ca.
70 Jahren, somit ist die CLL eine Erkrankung des höheren Lebensalters. Der klinische Verlauf der Erkrankung ist heterogen und die Überlebenszeiten variieren zwischen zwei und mehr als zehn Jahren. Aufgrund des schleichenden Krankheitsverlaufes sind viele Patienten asymptomatisch, und die Diagnose ist ein Zufallsbefund. Mit Progress der Erkrankung kann es zu B-Symptomen, Zeichen der hämatopoetischen Insuffizienz, Infekt-Neigung und ausgeprägter Lymphadenopathie kommen. Typische Komplikationen der CLL sind Autoimmun-Zytopenien. In 5–10% der Fälle beobachtet man eine Transformation in ein hochmalignes Non-Hodgkin-Lymphom (Richter-Syndrom). Darüber hinaus haben CLL-Patienten unabhängig von der Therapie ein erhöhtes Risiko, an einer nicht-hämatologischen Neoplasie zu erkranken.
Diagnostik und Prognose
Nach den Kriterien des Internationalen Workshops CLL (iwCLL [1]) ist zur Sicherung der Diagnose einer CLL der Nachweis von mindestens 5.000 klonalen B-Lymphozyten/μl im peripheren Blut nötig. Unterhalb dieses Wertes kann eine monoklonale B-Lymphozytose (MBL) festgestellt werden, wenn keine Krankheitszeichen (B-Symptome, Lymphadenopathie, Hepatomegalie, Splenomegalie, Zytopenie etc.) vorliegen. Eine Knochenmarksdiagnostik ist zur Diagnosefindung im Allgemeinen nicht nötig. Die CLL-Zellen sind immunologisch durch die Koexpression von CD19, CD20, und CD23 sowie CD5 gekennzeichnet. Zusätzlich charakteristisch ist die relativ schwache Expression von Oberflächenimmunglobulin, CD20 und CD79b. Durch die Leichtketten-Restriktion kann die Monoklonalität der Zellen nachgewiesen werden.
Die Stadieneinteilung erfolgt in Europa nach Binet [2]. Diese Einteilung stützt sich auf das Ausmaß einer klinisch palpablen Lymphadenopathie, Splenomegalie und Hepatomegalie sowie auf ein einfaches Blutbild und ist somit ohne weiterführende technische Untersuchungen in der klinischen Routine zu erheben. Die Ermittlung des zugrunde liegenden Krankheitsstadiums ermöglicht eine grobe Abschätzung der Prognose und ist bis heute Grundlage der Therapieplanung. Vor Einführung der Immunchemotherapie betrug die mediane Überlebenszeit im Stadium Binet A über zehn Jahre, im Stadium Binet B fünf bis sieben Jahre und in der Hochrisikogruppe der Binet-C-Patienten zwei bis dreieinhalb Jahre.
Aufgrund der Beobachtung, dass heute zunehmend Patienten in frühen Stadien diagnostiziert werden, deren Prognose relativ inhomogen ist, sind zusätzliche Prognosefaktoren notwendig, um indolente Frühformen von solchen mit rascherer Progression zu unterscheiden. Dabei gibt es einfach zu erhebende Faktoren wie die Lymphozyten-Verdopplungszeit, die Anzahl der Prolymphozyten im peripheren Blut sowie die Konzentration von Beta-2-Mikroglobulin und Thymidinkinase im Serum.
Daneben wurde eine Vielzahl an biologischen Prognosefaktoren definiert, die helfen, Patienten zum Zeitpunkt der Diagnosestellung in Risikogruppen hinsichtlich des progressionsfreien Überlebens und des Gesamtüberlebens einzuteilen. So können bei über 90% der CLL-Patienten zytogenetische Aberrationen mittels FISH (Fluoreszenz-in-situ-Hybridisierung) detektiert werden. Dabei ist der isolierte Nachweis einer del(13q) mit einer günstigen Prognose assoziiert. Der Nachweis einer del(17p) ist bei neu diagnostizierten Patienten selten, kommt jedoch bei vorbehandelten oder therapierefraktären Patienten häufiger vor und ist mit einer schlechten Prognose assoziiert [3]. Auch eine del(11q) geht mit einer schlechteren Prognose einher. Zytogenetische Aberrationen sind als Prognosefaktoren unabhängig vom klinischen Stadium zu werten [4].
Bei etwa 50% der Patienten lassen sich somatische Hypermutationen in den rearrangierten variablen Regionen der Gene für die schweren Ketten der Immunglobuline (IgHV) nachweisen. Patienten mit unmutierten IgHV-Genen (unmutierte CLL) haben eine schlechtere Prognose im Vergleich zu Patienten mit mutierten IgHV-Genen (mutierte CLL, [5]). Die einfachere immunphänotypische Messung der ZAP-70-Expression korreliert in der großen Mehrzahl der Fälle mit dem IgHV-Mutationsstatus [6].
Die Deutsche CLL-Studiengruppe (DCLLSG) entwickelte auf dem Boden einer multivariaten Analyse an über 1.900 Patienten aus prospektiven Studien einen Risikoscore, der folgende Einzelparameter umfasst: Geschlecht, Alter, ECOG Status, Nachweis der zytogenetischen Aberrationen del(11q) und del(17p), IgHV-Mutationsstatus sowie Serumtiter von Beta-2-Mikroglobulin und Thymidinkinase [7]. Es bleibt jedoch zu betonen, dass das Vorliegen eines ungünstigen Prognoseparameters nicht gleichbedeutend mit einer Indikation zur Therapie ist.
Therapeutische Grundsätze und Therapieindikation
Auch im Zeitalter zielgerichteter Therapien ist der Therapieansatz bei der CLL mit Ausnahme der wenigen Patienten, die sich für eine allogene Stammzelltransplantation qualifizieren, palliativ. Allerdings konnte im historischen Verlauf durch die sukzessive Einführung neuer Substanzen zunächst das Therapieansprechen und durch den Einsatz von Rituximab erstmalig eine Überlebensverlängerung erreicht werden [8]. Vor allem bei Patienten mit dem Nachweis der genetischen Hochrisiko-Alteration del(17p) sind die Remissionsdauern unter dieser Therapie weiterhin kurz. Der Einsatz von Substanzen, die in den B-Zell-Rezeptor-Signalweg eingreifen (BTK-Inhibitor Ibrutinib bzw. PI3Kδ-Inhibitor Idelalisib), bzw. das Bcl-2 Protein gezielt inhibieren (Venetoclax), zeigte unabhängig von dieser Aberration sehr gute Erfolge.
Dennoch bleibt nach derzeitigem Kenntnisstand offen, ob mit den modernen Therapeutika eine langfristige Krankheitskontrolle oder sogar Heilungen erzielt werden können. Daher muss vor Einleitung einer Therapie genau überlegt werden, welches Ziel damit erreicht werden soll. Für ältere, komorbide CLL-Patienten stehen Palliation und Verbesserung der Lebensqualität als primäre Therapieziele im Vordergrund, wobei auch bei diesen Patienten eine Immunchemotherapie möglich ist und das Gesamtüberleben verlängern kann [9]. Für jüngere Patienten werden neben der Verbesserung und Erhaltung der Lebensqualität das Erreichen einer möglichst lang anhaltenden Remission und das Erreichen einer molekularen kompletten Remission sowie eine Lebensverlängerung angestrebt.
Bei den meisten Patienten verläuft die Krankheit langsam, sodass sie ohne Behandlung zunächst beobachtet werden kann. Unter Umständen können vom Zeitpunkt der Erstdiagnose bis zur Therapieeinleitung mehrere Jahre, in einigen Fällen auch Jahrzehnte, vergehen. Während dieser Zeit kann die individuelle Krankheitsaktivität anhand der Symptome des Patienten (B-Symptome), des Lymphknotenstatus, der Lymphozyten-Verdopplungszeit sowie der Entwicklung einer Anämie oder Thrombozytopenie verfolgt werden. Apparative Untersuchungen sind demnach nur bei besonderen Fragestellungen nötig.
Patienten im Stadium Binet A werden nach der sogenannten „Watch-and-Wait“-Strategie bis zur Krankheitsprogression beobachtet. Auch bei Hochrisikopatienten erscheint eine Therapie nicht gerechtfertigt, da eine frühzeitige Therapie weder den natürlichen Verlauf der Erkrankung zu beeinflussen noch das Gesamtüberleben zu verlängern scheint [10].
Patienten im Stadium Binet B sollten therapiert werden, wenn sie innerhalb eines kurzen Zeitintervalls progredient oder symptomatisch werden. Einen Überblick über mögliche Therapieindikationen gibt Tabelle 1.

Vorgehen bei Patienten in frühen Stadien (Stadium Binet A)
Patienten mit CLL im Stadium Binet A sind in der Regel asymptomatisch und müssen deshalb nicht therapiert werden. Dennoch gibt es ca. 25–30% der Binet-A-Patienten, die eindeutige Zeichen einer Krankheitsprogression oder eine ungünstige molekulare Risikokonstellation aufweisen. Die Lebenserwartung dieser Patienten ist eingeschränkt.
In einer Phase-III-Studie (CLL7-Protokoll) der DCLLSG wurde der frühe Einsatz der FCR-Immunchemotherapie (Rituximab, Fludarabin und Cyclophosphamid) für Risikopatienten im Stadium A geprüft. Erste Auswertungen zeigten eine signifikante Verlängerung des ereignisfreien Überlebens, allerdings zeigte sich kein signifikanter Unterschied im Gesamtüberleben [10]. Somit ist eine frühzeitige Therapie von Hochrisiko-Patienten im Stadium Bi-net A außerhalb von Studien nicht zu empfehlen.
Therapie bei Patienten in fortgeschrittenen Stadien (Binet B mit Symptomen und Binet C)
Die Therapiewahl orientiert sich bei der CLL an der Komorbidität, am genetischen Status und an der Nierenfunktion, weniger am kalendarischen Alter. Einen Überblick gibt Tabelle 2.
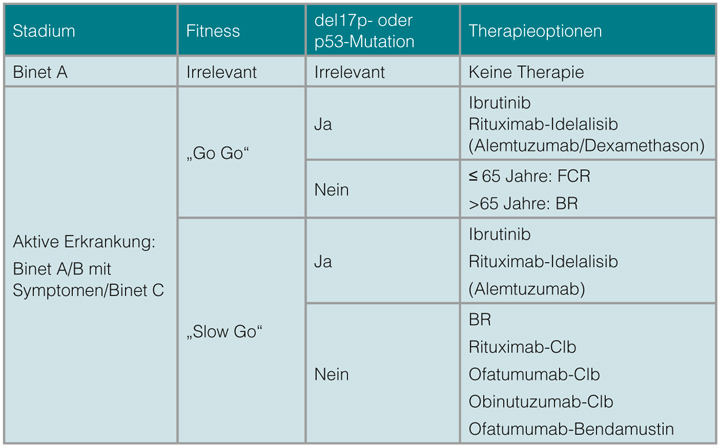
Therapieoptionen bei jüngeren Patienten und Patienten ohne signifikante Komorbidität
Durch die Hinzunahme des CD20-Antikörpers Rituximab zu Fludarabin und Cyclophosphamid (FCR-Schema) konnten in einer Studie des MD Anderson Cancer Centers (MDACC) exzellente Gesamtansprechraten (ORR, 95%) und hohe Raten an kompletten Remissionen (CR, 70%) erreicht werden [11]. Zwar konnten diese Ergebnisse in der Phase-III-Studie CLL8 der DCLLSG (ORR: 90%, CR: 44%) nicht komplett bestätigt werden, doch konnte hier erstmalig eine Therapie eine Verbesserung im Gesamtüberleben (OS) demonstrieren (nach drei Jahren 87% vs. 83% für FCR versus FC; p = 0,012, [8]). In Subgruppenanalysen dieser Studie zeigte sich, dass vor allem Patienten mit der als prognostisch ungünstig angesehenen del(11q) von der Hinzunahme von Rituximab profitieren. Eine Immunchemotherapie nach dem FCR-Schema stellt daher den Standard in der Erstlinientherapie von CLL-Patienten ohne relevante Komorbiditäten dar.
Eine Alternative zu FCR kann die Kombination von Bendamustin mit Rituximab (BR) sein, insbesondere bei unkontrollierter Autoimmun-Hämolyse oder eingeschränkter Nierenfunktion. Die CLL2M-Studie der DCLLSG kombinierte Rituximab mit Bendamustin in einer Dosierung von 90mg/m2 über zwei Tage. Die Ansprechrate betrug 91% mit einer Rate an kompletten Remissionen von 32,7% bei günstigem Toxizitätsprofil [12]. In einem direkten Vergleich von FCR mit BR im Kontext einer Phase-III-Studie (CLL10) zeigte sich die FCR-Kombination bezüglich Ansprechrate, MRD-Negativität und progressionsfreiem Überleben (PFS) überlegen [13]. Dieser Vorteil bestand jedoch in einer Subgruppenanalyse nur bei den Patienten, die jünger als
65 Jahre waren. Zusätzlich verdoppelte sich die Rate an schweren Infektionen bei Patienten jenseits des 65. Lebensjahrs, sodass bei älteren Patienten ohne relevante Komorbidität die Therapie mit BR empfohlen wird. Bei fitten Patienten bis zu einem Alter von 65 Jahren bleibt FCR die erste Wahl in der Erstlinientherapie.
Therapieoptionen bei älteren Patienten und Patienten mit signifikanter Komorbidität
Die CLL ist eine Erkrankung des höheren Lebensalters, und viele Patienten weisen ein nicht unerhebliches Maß an Komorbiditäten auf. Dieses Patientenkollektiv ist in vielen klinischen Studien unterrepräsentiert. Daher können viele moderne Therapien aufgrund der Gefahren einer prolongierten Zytopenie, der T-Zell-Depletion und der daraus folgenden Infektionsgefahr nicht gegeben werden.
Neben Bendamustin ist Chlorambucil daher in Kombination mit einem CD20-Antikörper weiterhin fester Bestandteil der Erstlinientherapie der CLL bei älteren Patienten und Patienten mit ausgeprägter Komorbidität. Eine Phase-III-Studie der DCLLSG (CLL11-Protokoll) zeigte eine signifikante Verbesserung von Ansprechrate und PFS durch die Hinzunahme von Rituximab bzw. von Obinutuzumab zu Chlorambucil: Die Gesamtansprechraten in den Armen Chlorambucil-Monotherapie, R-Chlorambucil und Obinutuzumab-Chlorambucil betrugen 31,4%, 65,7% bzw. 77,3%, die CR-Raten 0%, 7,3% bzw. 22,3% [9]. In einer Folgeauswertung mit verlängerter Nachbeobachtungszeit [14] zeigte sich ein PFS von 29,2 Monaten im Obinutuzumab-Chlorambucil-Arm verglichen mit 15,4 Monaten im R-Chlorambucil-Arm (p < 0,001; HR 0,40). Dabei verbesserten beide Antikörper-Kombinationen im Vergleich zu Chlorambucil als Monotherapie auch das OS; bisher zeigte sich allerdings kein signifikanter Unterschied im OS zwischen den beiden Antikörper-haltigen Therapieregimes. Hier ist zur abschließenden Beurteilung eine längere Nachbeobachtungszeit nötig.
Auch eine Studie, die die Kombination von Ofatumumab und Chlorambucil gegenüber einer Chlorambucil-Monotherapie verglich, zeigte einen signifikanten Unterschied im PFS, nicht jedoch im Gesamtüberleben [15]. Somit stellt eine CD20-basierte Immunchemotherapie auch bei älteren Patienten mit Komorbiditäten den derzeitigen Therapiestandard dar.
Therapiekonzepte bei Hochrisiko-Patienten
Patienten mit Nachweis einer del(17p) bzw. einer p53-Mutation haben eine niedrigere Ansprechrate und ein kürzeres PFS und OS nach einer Immunchemotherapie und stellen daher eine therapeutische Herausforderung dar. Für Patienten mit dieser Risikokonstellation sollte daher frühzeitig nach anderen Therapieoptionen gesucht werden. Anstelle des nicht mehr zugelassenen und mit hoher therapieassoziierter Morbidität assoziierten CD52-Antkörpers Alemtuzumab stehen mit den Tyrosinkinaseinhibitoren Ibrutinib und Idelalisib, die in den Signalweg des B-Zell-Rezeptors eingreifen, alternative Therapieoptionen auch für die Erstlinientherapie zur Verfügung. Beide Substanzen sind orale Therapien und in der Regel im Vergleich zu Chemo(immun)therapien gut verträglich.
Idelalisib zeigte sowohl in der Mono- als auch in der Kombinationstherapie bei rezidivierten und refraktären Patienten hohe Ansprechraten bei tolerabler Toxizität. Hauptnebenwirkungen sind Diarrhöen und meist transiente Transaminasen-Erhöhungen [16, 17]. Auf der Grundlage dieser Daten wurde eine Phase-III-Studie initiiert, bei der komorbide Patienten im Rezidiv, die ungeeignet für eine zytostatische Therapie waren, zwischen einer Rituximab-Monotherapie und einer Kombinationstherapie aus Rituximab und Idelalisib randomisiert wurden [18]. Die Studie wurde aufgrund der Überlegenheit des Idelalisib-Armes frühzeitig geschlossen. Die Ansprechraten betrugen bei Patienten unter Rituximab-Monotherapie 13% gegenüber 81% in der Idelalisib-Rituximab-Kohorte. Nach
24 Wochen betrug die PFS-Rate unter Rituximab 46%, in der Idelalisib/Rituximab-Gruppe 93%. Auch bezüglich des OS zeigte sich ein signifikanter Unterschied mit deutlich verbessertem Überleben der Patienten unter Kombinationstherapie. Dabei war der Vorteil unabhängig von Patienten-spezifischen Risikofaktoren wie einem unmutierten IgHV-Status oder dem Vorliegen einer del(17p) oder p53-Mutation. Komplette Remissionen wurden in beiden Armen nicht beobachtet.
Unter Idelalisib kommt es regelhaft zu einer Therapie-assoziierten Lymphozytose durch einen Kompartment-Shift der malignen Zellen. Diese soll nach den modifizierten iwCLL-Kriterien von 2008 nicht als Progress der CLL gewertet werden und konnte, verglichen mit den Daten aus Studien mit Idelalisib-Monotherapie, durch die Hinzunahme eines Anti-CD20 Antikörpers attenuiert werden.
Ibrutinib ist ein Inhibitor der Bruton-Tyrosinkinase (BTK). Daten zum Einsatz bei Patienten mit CLL liegen
u. a. aus einer Phase-II-Studie [19] bei Patienten mit refraktärer oder rezidivierter CLL vor, die im Median vier Vortherapien erhalten hatten. 33% der Patienten wiesen eine del(17p) auf und 81% der Patienten hatten einen unmutierten IgHV-Status. Unter einer oralen Dosis von 420 mg/d betrug die Ansprechrate 71%.
Wie unter Idelalisib kommt es auch unter einer Therapie mit Ibrutinib regelhaft zu einer Lymphozytose nach etwa einer Therapiewoche mit einem Maximum nach ca. vier Wochen. Unter der Dauertherapie zeigte sich mit Fortschreiten der Therapie ein verzögertes Ansprechen. Auch unter Ibrutinib war das Ansprechen unabhängig von den bekannten Risikofaktoren und unabhängig von der Höhe der therapieassoziierten Lymphozytose. Die PFS-Rate nach zwei Jahren betrug 75%.
Die Verträglichkeit der Therapie war gut. Die meisten Nebenwirkungen waren mild, nur zwei Patienten mussten aufgrund von Toxizität die Therapie abbrechen. Hauptnebenwirkung waren Diarrhöen, die meist keiner Intervention bedurften, in ca. 4% der Fälle jedoch schwerwiegend waren. Zytopenien traten sehr selten auf.
Eine Phase-III-Studie verglich eine Ibrutinib-Monotherapie mit Ofatumumab [20]. Bei wie in der Vorgängerstudie guter Verträglichkeit zeigte sich unter Ofatumumab ein medianes PFS von 8,1 Monaten, während unter Ibrutinib das mediane PFS nach einer medianen Nachbeobachtungszeit von 9,4 Monaten noch nicht erreicht war
(Hazard Ratio 0,25). Auch im OS zeigte sich ein signifikanter Vorteil für die Ibrutinib-Kohorte (90% versus 81% nach zwölf Monaten; p = 0,005). Bei 35 therapiebedürftigen, bisher unbehandelten Patienten mit Nachweis einer del(17p) oder p53-Mutation zeigte eine Phase-II-Studie nach 24 Wochen bei annähernd allen Patienten ein Ansprechen (PR: 55%, PR mit Lymphozytose: 42%; [21]).
Diese Daten sind im historischen Vergleich zu einer Immunchemotherapie (CLL8-Studie: ORR unter FCR 68%) beeindruckend. Auf dem Boden dieser Studie wurde Ibrutinib im Herbst 2014 für die Rezidivtherapie und in der ersten Therapielinie bei Patienten mit Nachweis einer del(17p) bzw. TP53-Mutation auch durch die EMA zugelassen [22].
Im Licht dieser Daten sollte die Indikationsstellung für die früher als Standard in der Erstlinientherapie von Hochrisikopatienten empfohlene allogene Blutstammzell-Transplantation nach Abwägung der individuellen Risiken unter Berücksichtigung von Alter, Begleiterkrankungen und der Verfügbarkeit eines optimal passenden Spenders in der Regel nicht mehr gestellt werden. Konzeptionell sollte die allogene Stammzelltransplantation im Sinne einer Konsolidierung nach initialem Ansprechen bzw. bei initial refraktärer Erkrankung als Rescue-Verfahren diskutiert werden. Wann immer möglich sollen diese Patienten im Rahmen von klinischen Studien behandelt werden [23].
Rezidivtherapie und Therapie der refraktären CLL
Auch nach einer Immunchemotherapie kommt es bei den allermeisten Patienten zum Rezidiv. Die Art und der Beginn der Rezidivtherapie richten sich nach vielen Faktoren wie Alter, Allgemeinzustand, vorangegangener Therapie und Qualität und Dauer der Remission. Außerdem muss entschieden werden, ob eine Palliation angestrebt wird oder ob ein eher aggressives Vorgehen geplant ist. Wie vor Initiierung der Erstlinientherapie sollte eine Therapiebedürftigkeit, definiert durch die oben angegebenen Faktoren, gegeben sein. Einen Überblick gibt Tabelle 3.
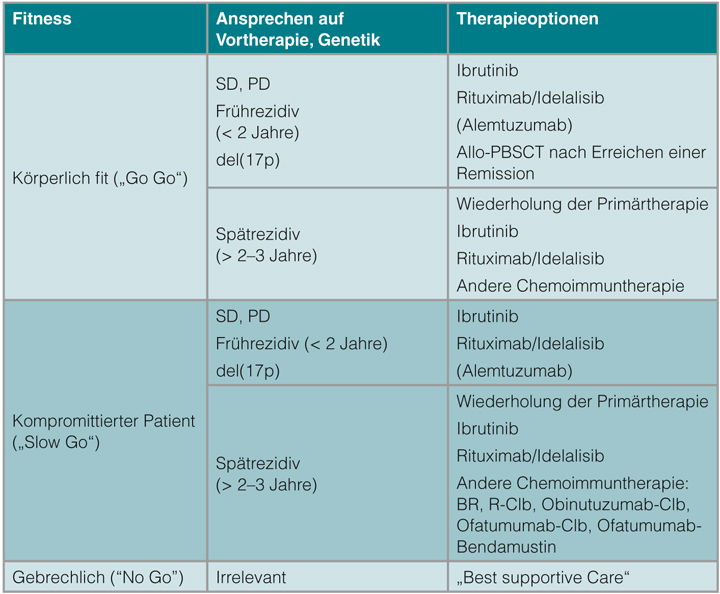
Refraktäre Patienten, Frührezidiv (< 2 Jahre), Hochrisikopatienten
Patienten, die gegen die derzeitigen Standard-Immunchemotherapien refraktär sind oder nur eine kurze Remission (< 2 Jahre) erzielen, oder rezidivierte Patienten mit Nachweis einer del(17p13) bzw. einer p53-Mutation haben eine schlechte Prognose. Eine Wiederholung der Vortherapie sollte bei diesen Patienten nicht erfolgen. Wie in der ersten Therapielinie bei Patienten mit Nachweis einer del(17p) oder p53-Mutation ist der CD52-Antikörper Alemtuzumab wirksam, allerdings handelt es sich hier um einen Off-Label-Einsatz. Verglichen mit einem Einsatz von Alemtuzumab in der Primärtherapie kommt es im Rezidiv zum gehäuften Auftreten insbesondere viraler Infektionen und CMV-Reaktivierungen [24].
Besser verträglich und wahrscheinlich wirksamer ist eine Therapie mit Idelalisib/Rituximab oder Ibrutinib [18, 20]. Verglichen mit Ofatumumab bzw. Rituximab alleine konnte ein Überlebensvorteil (PFS und OS) gezeigt werden. Der monoklonale CD20-Antikörper Ofatumumab ist zwar zugelassen für Patienten, die gegen ein Fludarabin-haltiges Schema refraktär waren, ist allerdings in der Monotherapie einer Ibrutinib-Therapie unterlegen [20].
Bei ausgewählten jungen bzw. körperlich fitten Patienten sollte frühzeitig die Option einer allogenen Stammzelltransplantation im Rahmen klinischer Studien erwogen werden. Hierfür muss jedoch zunächst eine Remission erreicht werden [23].
Patienten mit Spätrezidiv (> 2 Jahre)
Für den Fall eines späten Rezidivs (> 2 Jahre) nach Immunchemotherapie ist kein durch Studien gestützter Konsens etabliert. Üblicherweise sprechen die meisten Patienten jedoch auf eine erneute Therapie mit dem gleichen Schema oder auf ein anderes Regime auf Basis von Rituximab und Purinanaloga an. Auch im Rezidiv ist durch die Hinzunahme von Rituximab mit einer besseren Wirksamkeit zu rechnen [25]. Neben FCR steht mit der Kombination von Rituximab mit Bendamustin (Dosierung: 70 mg/m2 d1 und 2) eine weitere effektive Therapieoption zur Verfügung.
In einer Phase-II-Studie (CLL2M) der DCLLSG wurden 81 vorbehandelte Patienten (median 64 Jahre alt) mit maximal sechs Zyklen Rituximab/Bendamustin therapiert. Dabei konnte eine Gesamtansprechrate von 59% bei einer CR-Rate von 9% erreicht werden [26]. Eine weitere Option besteht in der Therapie mit dem humanen Anti-CD20-Antikörper Ofatumumab.
In einer Phase-II-Studie mit 138 Patienten, die entweder auf Fludarabin und Alemtuzumab refraktär (n = 59) waren oder auf Fludarabin refraktär waren und sich klinisch mit ausgeprägter Lymphadenopathie präsentierten (n = 79), konnten Ansprechraten von 58% bzw. 47% erreicht werden. Das Gesamtüberleben betrug 13,7 bzw. 15,4 Monate. Interessanterweise sprachen auch Rituximab-refraktäre Patienten auf eine Therapie mit Ofatumumab an [27]. Auch in Kombination mit Bendamustin konnten im Rezidiv Ansprechraten von 72% und eine CR-Rate von 17% erreicht werden [28]. Wie in der Hochrisiko-Situation stehen auch Ibrutinib oder die Kombination aus Rituximab und Idealisib zur Verfügung.
Fazit
Eine CD20-basierte Immunchemotherapie ist sowohl bei jüngeren, körperlich fitten Patienten als auch bei älteren Patienten oder Patienten mit Komorbidität möglich und stellt den derzeitigen Therapiestandard bei der CLL dar. Dabei ist zu beachten, dass nach derzeitigem Kenntnisstand eine Therapie nur bei symptomatischer Erkrankung indiziert ist. Eine schwierig zu therapierende Ausnahme sind Patienten mit genetischen Hochrisiko-Aberrationen. Hier stehen mit Ibrutinib und der Rituximab-Idelalisib-Kombination gut verträgliche und hoch wirkungsvolle Therapieoptionen bereits in der Primärtherapie zur Verfügung. Die Rezidivtherapie richtet sich u. a. nach der Verträglichkeit und Remissionsdauer nach der vorangegangenen Therapie. Der BTK-Inhibitor Ibrutinib und der PI3Kδ-Inhibitor Idelalisib sind auch hier Therapieoptionen. Daneben ist mit Venetoclax ein Bcl-2-Inhibitor in klinischer Prüfung. Aufgabe der kommenden Studiengenerationen wird bleiben, durch eine möglichst intelligente Kombination der neuen Therapieoptionen eine Chemotherapie-freie bzw. –reduzierte und damit gut verträgliche Therapie für die Mehrheit der CLL-Patienten zu entwickeln.
Literatur
1. Hallek M et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: A report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood 2008; 111: 5446-56.
2. Binet JL et al. A new prognostic classification of chronic lymphocytic leukemia derived from a multivariate survival analysis. Cancer 1981; 48: 198-206.
3. Döhner H et al. Genomic aberrations and survival in chronic lymphocytic leukemia. N Engl J Med 2000; 343: 1910-6.
4. Krober A et al. V(H) mutation status, CD38 expression level, genomic aberrations, and survival in chronic lymphocytic leukemia. Blood 2002; 100: 1410-6.
5. Chiorazzi N et al. Chronic lymphocytic leukemia. N Engl J Med 2005; 352: 804-15.
6. Crespo M et al. ZAP-70 expression as a surrogate for immunoglobulin-variable-region mutations in chronic lymphocytic leukemia. N Engl J Med 2003; 348: 1764-75.
7. Pflug N et al. Development of a comprehensive prognostic index for patients with chronic lymphocytic leukemia. Blood 2014; 124: 49-62.
8. Hallek M et al. Addition of rituximab to fludarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: A randomised, open-label, phase 3 trial. Lancet 2010; 376: 1164-74.
9. Goede V et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014; 370: 1101-10.
10. Schweighofer C et al. Early versus deferred treatment with combined fludarabine, cyclophosphamide and rituximab (FCR) improves event-free survival in patients with high-risk Binet stage A chronic lymphocytic leukemia – first results of a randomized German-French cooperative Phase III trial. Blood 2013 (ASH 2013, Abstract #524).
11. Keating MJ et al. Early results of a chemoimmunotherapy regimen of fludarabine, cyclophosphamide, and rituximab as initial therapy for chronic lymphocytic leukemia. J Clin Oncol 2005; 23: 4079-88.
12. Fischer K et al. Bendamustine in combination with rituximab for previously untreated patients with chronic lymphocytic leukemia: A multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2012; 30: 3209-16.
13. Eichhorst B et al. Frontline chemoimmunotherapy with fludarabine (F), cyclophosphamide (C), and rituximab (R) (FCR) shows superior efficacy in comparison to bendamustine (B) and rituximab (BR) in previously untreated and physically fit patients (pts) with advanced chronic lymphocytic leukemia (CLL): Final analysis of an international, randomized study of the German CLL Study Group (GCLLSG) (CLL10 study). Blood 2014 (ASH 2014, Abstract #19).
14. Goede V et al. Obinutuzumab as frontline treatment of chronic lymphocytic leukemia: Updated results of the CLL11 study. Leukemia 2015, Jan 30 [Prepubahead of print, DOI: 10.1038/leu.2015.14].
15. Hillmen P et al. Ofatumumab + chlorambucil versus chlorambucil alone in patients with untreated chronic lymphocytic leukemia (CLL): Results of the phase III study COMPLEMENT 1 (OMB110911). Blood 2013 (ASH 2013, Abstract #528).
16. Brown JR et al. Idelalisib, an inhibitor of phosphatidylinositol 3-kinase p110delta, for relapsed/refractory chronic lymphocytic leukemia. Blood 2014; 123: 3390-7.
17. Barrientos JC et al. Update on a phase I study of the selective PI3Kδ inhibitor idelalisib (GS-1101) in combination with rituximab and/or bendamustine in patients with relapsed or refractory CLL. J Clin Oncol 2013; 31 (15S): 429s (ASCO 2013, Abstract #7017).
18. Furman RR et al. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014; 370: 997-1007.
19. Byrd JC et al. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med 2013; 369: 32-42.
20. Byrd JC et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014; 371: 213-23.
21. Farooqui MZ et al. Ibrutinib for previously untreated and relapsed or refractory chronic lymphocytic leukemia with TP53 aberrations: A phase 2, single-arm trial. Lancet Oncol 2015; 16: 169-76.
22. Burger JA et al. Safety and activity of ibrutinib plus rituximab for patients with high-risk chronic lymphocytic leukaemia: A single-arm, phase 2 study. Lancet Oncol 2014; 15: 1090-9.
23. Dreger P et al. Managing high-risk CLL during transition to a new treatment era: Stem cell transplantation or novel agents? Blood 2014; 124: 3841-9.
24. Stilgenbauer S et al. Alemtuzumab combined with dexamethasone, followed by alemtuzumab maintenance or allo-SCT in “ultra high-risk” CLL: Final results from the CLL2O phase II study. Blood 2014 (ASH 2014, Abstract #1991).
25. Robak T et al. Rituximab plus fludarabine and cyclophosphamide prolongs progression-free survival compared with fludarabine and cyclophosphamide alone in previously treated chronic lymphocytic leukemia. J Clin Oncol 2010; 28: 1756-65.
26. Fischer K et al. Bendamustine combined with rituximab in patients with relapsed and/or refractory chronic lymphocytic leukemia: A multicenter phase II trial of the German Chronic Lymphocytic Leukemia Study Group. J Clin Oncol 2011; 29: 3559-66.
27. Wierda WG et al. Ofatumumab is active in patients with fludarabine-refractory CLL irrespective of prior rituximab: Results from the phase 2 international study. Blood 2011; 118: 5126-9.
28. Cortelezzi A et al. Bendamustine in combination with ofatumumab in relapsed or refractory chronic lymphocytic leukemia: A GIMEMA multicenter phase II trial. Leukemia 2014; 28: 642-8.

Dr. med. Till Seiler
Medizinische Klinik und Poliklinik III
Klinikum der Universität München
Marchioninistr. 15, 81377 München
+49 89 4400-72255
+49 89 4400-75252
till.seiler[at]med.uni-muenchen[dot]de
Prof. Dr. med. Clemens-Martin Wendtner
Wissenschaftlicher Sekretär der DCLLSG
Klinik für Hämatologie, Onkologie,
Immunologie, Palliativmedizin, Infektiologie und Tropenmedizin, Klinikum Schwabing Akademisches Lehrkrankenhaus
der Universität München
Kölner Platz 1, 80804 München
+49 89 3068 2228
+49 89 3068 3912
clemens.wendtner[at]klinikum-muenchen[dot]de

