Fortschritte in der Therapie des follikulären Lymphoms
Till Seiler, Wolfgang Hiddemann
Klinische Präsentation und Diagnostik
Das follikuläre Lymphom (FL) ist mit ca. 20–35% aller neu diagnostizierten malignen Lymphome das häufigste indolente Non-Hodgkin-Lymphom (NHL) in der westlichen Welt. Das mittlere Erkrankungsalter liegt zwischen 60 und 65 Jahren mit einer breiten Altersspanne. Klinisch steht eine Lymphadenopathie im Vordergrund. Des Weiteren kann es zu extranodalen Manifestationen kommen, die letztlich alle Organsysteme betreffen und je nach Lokalisation zu entsprechenden klinischen Beschwerden führen können. Typisch ist ein protrahierter, meist langsam progredienter, z. T. jahrelanger Verlauf der Erkrankung mit gutem Ansprechen auf die Therapie, aber regelmäßigen Rezidiven und im Verlauf kürzer werdenden Remissionen.
Die histologische Diagnose des follikulären Lymphoms ist aufgrund seines charakteristischen Keimzentrums-ähnlichen Wachstumsmusters relativ eindeutig und erfordert obligat eine histologische Sicherung, in der Regel anhand einer Lymphknoten-Biopsie. Eine alleinige zytologische Diagnose z. B. anhand des Materials aus einer Feinnadelbiopsie ist nicht ausreichend. Auch im Rezidiv sollte eine erneute histologische Sicherung erfolgen, um eine Transformation in ein hochmalignes Lymphom auszuschließen.
Das follikuläre Lymphom besteht typischerweise aus kleinen Keimzentrums-Zellen mit gekerbten Zellkernen (Zentrozyten) und aus großen Keimzentrums-Zellen mit ungekerbten Zellkernen (Zentroblasten), wobei die Zentrozyten dominieren. Das Verteilungsmuster der Zellen ist follikulär, teilweise aber auch diffus. Anhand der Anzahl der vorhandenen Zentroblasten wird das follikuläre Lymphom zytologisch in die Grade I–III unterteilt, der Grad III weiter in die Untergruppen A und B. Während die Unterscheidung von Grad I, II und IIIA klinisch ohne Bedeutung ist, verhält sich das follikuläre Lymphom IIIB wie ein hochmalignes Lymphom und bedarf einer entsprechenden Therapie [1].
Typisch für das follikuläre Lymphom ist die chromosomale Translokation t(14;18)(q32;q21), die in 80–90% aller Fälle nachgewiesen werden kann. Dabei führt die Anlagerung des Bcl-2-Onkogens auf Chromosom 18 an den Immunglobulin-Promotor auf Chromosom 14 zu einer konstitutionellen Überexpression des „Anti-Apoptose"-Gens Bcl-2 und somit zur Hemmung der Apoptose und Akkumulation langlebiger Zentrozyten.
Zur klinischen Manifestation des follikulären Lymphoms sind allerdings weitere „sekundäre” genetische Alterationen notwendig. Mit dem Nachweis rekurrenter Mutationen in den Genen MLL2, EZH2, CREBBP und MEF2B gelang in den letzten Jahren eine weitere genetische Charakterisierung [2, 3]. Diese Gene sind direkt oder indirekt an Chromatin-Modifikationsprozessen beteiligt, was auf eine wichtige Rolle epigenetischer Veränderungen in der Pathogenese hindeutet. 89% der Patienten mit follikulärem Lymphom haben Mutationen im MLL2-Gen, in 13% der Fälle konnten Mutationen im Gen MEF2B detektiert werden. EZH2-Mutationen, die in ca. 27% aller Patienten mit FL detektiert werden können, scheinen ein pathogenetisch frühes Ereignis zu sein [4].
Nach der Sicherung der Diagnose ist die Bestimmung des Krankheitsstadiums von entscheidender Bedeutung für Therapie und Prognose. Die Stadien-Einteilung erfolgt nach Ann Arbor in die Stadien I bis IV sowie dem Zusatz A bei Fehlen bzw. B bei Vorliegen von sogenannten B Symptomen (Fieber, Nachtschweiß, Gewichtsverlust).
Neben Computertomografien von Hals, Thorax und Abdomen ist die Knochenmarkbiopsie obligatorischer Bestandteil der initialen Stadien-Diagnostik. Dabei ist eine Untersuchung mittels Positronenemissionstomografie (PET) dem CT potenziell überlegen. Insbesondere in frühen Stadien führt der Einsatz des PET bei bis zu 62% der Patienten im frühen Stadium zu einem Upstaging [5]. Zudem hat das PET am Ende einer Induktionstherapie prognostische Bedeutung für das Gesamtüberleben. Trotzdem empfiehlt die ICML Imaging Group den Einsatz des PET/CT zum initialen und zum Abschluss-Staging nur bei den PET-aviden hochmalignen Lymphomen [6]. Die Rolle beim FL und Mantelzell-Lymphom (MCL) ist nicht abschließend geklärt, sodass diese Untersuchung aktuell nur im Rahmen klinischer Studien erfolgen sollte.
Prognoseparameter
Der bei den hochmalignen Lymphomen angewandte Internationale Prognostische Index (IPI) ist beim follikulären Lymphom nur eingeschränkt verwertbar. Ein gut etablierter klinischer Prognosefaktor für das Follikuläre Lymphom ist hingegen der FLIPI (Follicular Lymphoma International Prognostic Index), in den die Anzahl der befallenen Lymphknoten, die Konzentration der Laktatdehydrogenase (LDH), das Stadium, das Alter und der Hb-Wert eingehen. Er ermöglicht die Abschätzung des individuellen Krankheitsverlaufs. Dieser Index behält auch beim Einsatz einer Immunchemotherapie seine Gültigkeit [7].
Therapie früher Stadien (Stadium I und II)
Das follikuläre Lymphom wird meist im fortgeschrittenen Stadium III oder IV diagnostiziert. Davon abzugrenzen sind die ca. 10–15% der Patienten, bei denen ein frühes Krankheitsstadium (I oder II) vorliegt. Diese Unterscheidung ist wichtig, da in diesem begrenzten Stadium eine lokale Strahlentherapie mit kurativer Intention durchgeführt werden kann [8]. Dabei scheinen insbesondere Patienten im Stadium I und mit Lymphknoten einer Größe von < 2–3 cm von einer alleinigen Radiatio zu profitieren. Rezidive treten am häufigsten außerhalb des ursprünglichen Strahlenfeldes auf.
Auf dem Boden dieser Ergebnisse wurde in einer Phase-II-Studie der Deutschen Studiengruppe für niedrig maligne Lymphome (GLSG) die Bestrahlung in Kombination mit einer Rituximab-Monotherapie geprüft [9]. Präliminäre Ergebnisse zeigen eine hohe Wirksamkeit mit einer progressionsfreien 2-Jahres-Überlebensrate (PFS) von 90% und einer Gesamtüberlebensrate (OS) von 96%. Gerade bei Patienten im Stadium II bzw. solchen mit größeren Lymphknoten (> 3 cm) ist ein solcher Ansatz zu diskutieren.
Eine niedrig dosierte Radiotherapie (2 x 2 Gy) erzielt im palliativen Setting hohe Ansprechraten, die jedoch im Mittel nur ein Jahr anhalten. Daher ist diese Therapieoption streng vom potenziell kurativen Ansatz mit adäquater Dosis (24–36 Gy) in frühen Stadien zu unterscheiden.
Therapie fortgeschrittener Stadien (Stadium III und IV)
Auch im fortgeschrittenen Stadium weist das follikuläre Lymphom einen indolenten, häufig nur langsam voranschreitenden Krankheitsverlauf auf. Mit einer systemischen Immunchemotherapie lassen sich grundsätzlich lang anhaltende Remissionen erzielen. Auf der anderen Seite stellt bei Patienten mit niedriger Tumorlast eine „Watch-and-Wait“-Strategie weiterhin den therapeutischen Standard dar. Inwiefern gut verträgliche „Soft-Treatment“-Strategien bei Niedrigrisiko-Patienten in Zukunft eine Rolle spielen können, wird in aktuellen Studien geprüft.
International gesehen sind die Therapiestrategien uneinheitlich. In Deutschland erfolgt eine systemische Therapie üblicherweise nur bei klinischer Symptomatik, da bisher kein Überlebensvorteil bei frühzeitiger Immunchemotherapie gezeigt werden konnte. Einen Überblick über mögliche Therapieoptionen in der Primärtherapie gibt Tabelle 1.
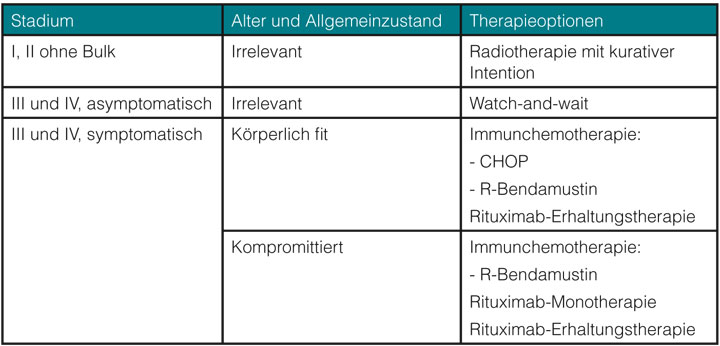
Patienten im fortgeschrittenen Stadium mit niedriger Tumorlast
In den USA erhält die Mehrzahl der Patienten bereits bei Erstdiagnose auch beim Fehlen von klinischen Symptomen eine systemische Therapie [10]. Ein Überlebensvorteil konnte in dieser speziellen klinischen Situation jedoch bisher nicht nachgewiesen werden.
Eine französische Studie verglich Patienten, die initial mit Rituximab behandelt wurden, mit solchen, die abwartend betreut wurden [11]: Es zeigte sich kein signifikanter Unterschied zwischen der Zeit bis zur Initiierung der Erstlinientherapie bei den unbehandelten Patienten und der Zeit bis zum Therapieversagen bei den Patienten, die initial mit Rituximab therapiert worden waren.
Eine weitere Studie verglich bei einem ähnlichen Patientenkollektiv einen „Watch-and-Wait“-Ansatz mit einer Rituximab-Induktionstherapie und einer Rituximab-Induktionstherapie gefolgt von einer Rituximab-Erhaltung [12]. Auch hier konnte kein Vorteil im Gesamtüberleben (OS) nachgewiesen werden. Allerdings zeigte sich bei den sofort therapierten Patienten ein signifikanter Vorteil im progressionsfreien Überleben (PFS) und in der Zeit bis zur Initiierung einer zytostatischen Therapie. Hier ist zur abschließenden Beurteilung ein längeres Follow-up nötig.
Die RESORT-Studie überprüfte den Stellenwert einer zeitlich unbegrenzten Erhaltungstherapie nach einer Rituximab-Induktionstherapie gegenüber einer erneuten Rituximab-Therapie bei Progress [13]. Nach einem medianen Follow-up von ca. vier Jahren war die Zeit bis zum Therapieversagen vergleichbar, sodass in dieser speziellen Situation eine intermittierende Rituximab-Gabe diskutiert werden kann.
Zusammenfassend besteht jedoch nach der derzeitigen Datenlage keine klare Indikation zur Initiierung einer Rituximab-Therapie bei Patienten im fortgeschrittenen Stadium mit niedriger Tumorlast.
Patienten im fortgeschrittenen Stadium mit hoher Tumorlast
Bei symptomatischen Patienten ist eine Therapie indiziert. Hier ist je nach Allgemeinzustand, Alter, Komorbidität und persönlicher Präferenz des Patienten der Goldstandard in der ersten Therapielinie [14–17] und in den weiteren Therapiephasen [18] eine Immunchemotherapie (Abb. 1), gefolgt von einer zweijährigen Rituximab-Erhaltungstherapie. Eine Metaanalyse bestätigte eine Verbesserung des Gesamtüberlebens unabhängig vom eingesetzten Chemotherapie-Regime [19].
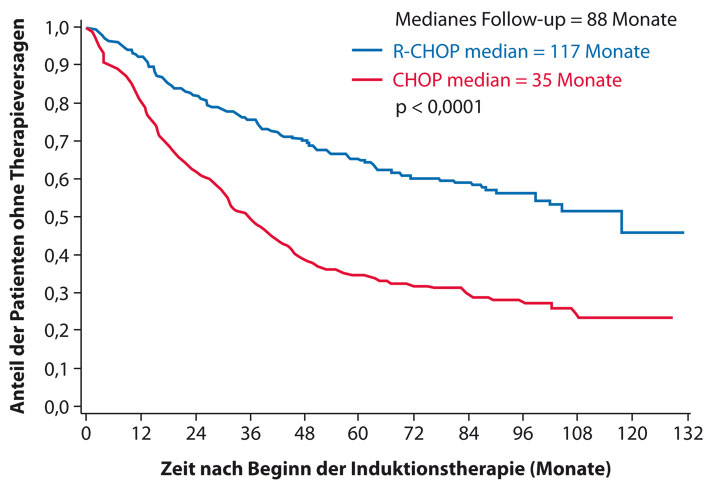
Eine Phase-III-Studie der Studiengruppe indolente Lymphome (StiL) demonstrierte eine signifikant höhere Ansprechrate und ein deutlich verlängertes PFS unter R-Bendamustin als unter R-CHOP (Rituximab, Cyclophosphamid, Doxorubicin, Vincristin, Prednison) bei deutlich niedrigerer Toxizität, ohne jedoch einen Vorteil im OS nachweisen zu können [20]. In einer offenen Phase-III-Studie konnten diese Ergebnisse in Bezug auf Ansprechen und PFS jedoch nicht bestätigt werden, sodass es derzeit einer individuellen Entscheidung bedarf ob Bendamustin oder CHOP als Chemotherapie-Basis gegeben wird [21]. Daten aus der sogenannten PRIMA-Studie konnten demgegenüber zeigen, dass ein R-CVP-Regime (Rituximab, Cyclophosphamid, Vincristin, Prednison) einer Therapie mit R-Bendamustin oder R-CHOP unterlegen ist [22].
Zusammenfassend ist die Frage, welches Chemotherapie-Regime eingesetzt werden sollte, nicht abschließend geklärt und sollte Patienten-individuell entschieden werden. Ältere, komorbide Patienten profitieren möglicherweise von einem Einsatz der Bendamustin-Kombination aufgrund des günstigeren Nebenwirkungsprofils. Dagegen sollte bei aggressivem Verlauf oder klinischem Verdacht auf eine Transformation weiterhin das R-CHOP-Regime bevorzugt werden.
Nach Erreichen einer Remission ist die Wirksamkeit einer Rituximab-Erhaltungstherapie in der Erstlinientherapie und beim rezidivierten follikulären Lymphom belegt [22, 23]. Bei therapienaiven Patienten führt eine alle zwei Monate über die Dauer von zwei Jahren durchgeführte Rituximab-Erhaltung zu einer signifikanten Verlängerung des PFS. Dabei scheinen Patienten unabhängig von Alter, Risikogruppe und Ergebnis der Induktionstherapie (partielle [PR] versus komplette Remission [CR]) zu profitieren. Allerdings fand sich bislang kein Unterschied im Gesamtüberleben, der Verlauf nach einer längeren Nachbeobachtungszeit bleibt abzuwarten [22].
Neue Therapieansätze
Trotz der Fortschritte durch die Rituximab-basierte Immunchemotherapie stellt das fortgeschrittene follikuläre Lymphom eine palliative Therapiesituation dar. Mehrere vielversprechende Substanzen mit teils innovativen Wirkmechanismen werden derzeit in klinischen Studien getestet oder sind bereits zugelassen.
Neue Antikörper
Eine große Anzahl unterschiedlicher Antikörper ist bereits in klinischen Studien getestet worden. Als vielversprechendste Option hat sich dabei der anti-CD20-Antikörper Obinutuzumab erwiesen. Obinutuzumab ist ein anti-CD20-Antikörper der zweiten Generation. Durch das Erkennen eines anderen Epitops und Glykosylierung des Fc-Teils zeichnet sich Obinutuzumab im Vergleich zu Rituximab durch eine gesteigerte direkte und Antikörper-vermittelte zelluläre Zytotoxizität aus, verfügt jedoch über eine geringere Komplement-vermittelte Zytotoxizität. In einer Phase-I/II-Studie mit einem hohen Anteil an „Rituximab-refraktären“ Patienten zeigten sich bei stark vorbehandelten Patienten mit follikulärem Lymphom Ansprechraten von 55% [24].
Trotz der günstigen Ergebnisse dieser und anderer Phase-II-Studien muss das Ergebnis einer großen internationalen Studie (GALLIUM) abgewartet werden, in der Obinutuzumab prospektiv randomisiert mit Rituximab im Rahmen einer Immunchemotherapie verglichen wird.
Immunmodulatoren
Zu den derzeit am besten untersuchten Substanzen mit überwiegend immunmodulatorischer Wirkung gehört Lenalidomid. In der Kombination mit Rituximab konnten in einer Phase-I/II-Studie an 110 Patienten mit rezidiviertem niedrigmalignem NHL hohe Ansprechraten erzielt werden [25]. Von den 46 Patienten mit follikulärem Lymphom sprachen 98% an, 87% erreichten eine CR oder CRu (unbestätigte CR). Nach 22 Monaten Nachbeobachtungszeit lag die geschätzte 2-Jahres-PFS-Rate bei 89%. Fast alle Patienten erreichten auch molekulare Remissionen und 93% eine metabolische Remission im PET. Die Ergebnisse dieser Studie sind umso überzeugender, als 78% der Patienten einen FLIPI Index von ≥ 2 aufgewiesen hatten.
Eine randomisierte Phase-II-Studie konnte diese Ergebnisse jedoch nicht vollständig bestätigen [26]. Aus diesem Grund muss auch für die Lenalidomid/Rituximab-Kombination das Ergebnis der großen, multizentrischen, prospektiv randomisierten RELEVANCE-Studie abgewartet werden, in der die neue Kombination mit der konventionellen Immunchemotherapie verglichen wird.
Inhibitoren des B-Zell-Rezeptor-Signalwegs
Auf der Grundlage zunehmend besserer Einblicke in die Biologie maligner Lymphome wurden mehrere Substanzen entwickelt, die spezifisch in den Signalweg des B-Zell-Rezeptors eingreifen. Dazu zählen vor allem Ibrutinib, das die Bruton-Tyrosinkinase (BTK) inhibiert, und Idelalisib, ein selektiver Inhibitor der Delta-Isoform der Phosphatidylinositol-3-Kinase (PI3Kδ). Zu beiden Substanzen liegen vielversprechende Ergebnisse von Phase-II-Studien vor [27, 28].
Um diese positiven Daten zu überprüfen und eine mögliche Chemotherapie-freie Alternative zur konventionellen Immunchemotherapie zu entwickeln, wird die GLSG in Kürze zwei prospektive Phase-II-Studien in der Primärtherapie initiieren, in denen Ibrutinib bzw. Idelalisib mit Obinutuzumab kombiniert werden sollen. Mit Duvelisib (IPI-145) befindet sich ein weiterer, weniger selektiver PI3K-Inhibitor der Isoformen Gamma und Delta in der klinischen Testung.
BCL-2-Inhibitoren
Aufgrund der pathogenetischen Bedeutung der Überexpression von Bcl-2 stellen Inhibitoren des Bcl-2-Signalwegs eine vielversprechende Option dar. Zu den interessanten Substanzen zählt Venetoclax (ABT-199, GDC-0199), das Bcl-2, aber im Gegensatz zu der Vorgängersubstanz Navitoclax nicht Bcl-xL inhibiert. Durch die höhere Spezifität konnte die On-target-Nebenwirkung einer über die Hemmung von Bcl-xL vermittelten Thrombopenie deutlich reduziert werden. In einer Phase-I-Studie induzierte die Substanz als Monotherapie bei acht von 15 Patienten (53%) mit rezidiviertem NHL anhaltende Remissionen [29].
Zusammenfassung und Ausblick
Die anti-CD20-basierte Immunchemotherapie konnte die Prognose des follikulären Lymphoms erstmals entscheidend verbessern und ist aktuell Standard in der Primärtherapie und im Rezidiv. Durch das bessere Verständnis der Tumorbiologie gelang mittlerweile die Entwicklung von Medikamenten aus neuen Substanzklassen, die eine noch zielgerichtetere Therapie ermöglichen können.
Mit neuen Antikörpern wie Obinutuzumab, Immunmodulatoren wie Lenalidomid und Substanzen, die in Apoptose- und B-Zell-Rezeptor-Signalwege eingreifen, befinden sich vielversprechende Therapieoptionen in fortgeschrittener klinischer Prüfung. Es ist daher zu erwarten, dass in naher Zukunft neue, möglicherweise Chemotherapie-freie Behandlungsmöglichkeiten etabliert werden können, die die Prognose von Patienten mit follikulärem Lymphom weiter verbessern werden.
Literatur
1. Ott G et al. Cytomorphologic, immunohistochemical, and cytogenetic profiles of follicular lymphoma: 2 types of follicular lymphoma grade 3. Blood 2002; 99: 3806-12.
2. Morin RD et al. Frequent mutation of histone-modifying genes in non-Hodgkin lymphoma. Nature 2011; 476: 298-303.
3. Pasqualucci L et al. Inactivating mutations of acetyltransferase genes in B-cell lymphoma. Nature 2011; 471: 189-95.
4. Bodor C et al. EZH2 mutations are frequent and represent an early event in follicular lymphoma. Blood 2013; 122: 3165-8.
5. Luminari S et al. The use of FDG-PET in the initial staging of 142 patients with follicular lymphoma: A retrospective study from the FOLL05 randomized trial of the Fondazione Italiana Linfomi. Ann Oncol 2013; 24: 2108-12.
6. Barrington SF et al. Role of imaging in the staging and response assessment of lymphoma: Consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol 2014; 32: 3048-58.
7. Buske C et al. The Follicular Lymphoma International Prognostic Index (FLIPI) separates high-risk from intermediate- or low-risk patients with advanced-stage follicular lymphoma treated front-line with rituximab and the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (R-CHOP) with respect to treatment outcome. Blood 2006; 108: 1504-8.
8. Ahmed N et al. Early stage W.H.O. grade I and II follicular lymphoma treated with radiation therapy alone. PLoS One 2013; 8: e65156.
9. Herfarth K. Treatment of early stage nodal follicular lymphoma using involved field radiotherapy and rituximab: Preliminary results of the Mir trial (phase II study of the German Low Grade Lymphoma Study Group (GLSG)). Blood 2012; 120(21): ASH 2012, Abstract #1634.
10. Friedberg JW et al. Follicular lymphoma in the United States: First report of the national LymphoCare study. J Clin Oncol 2009; 27: 1202-8.
11. Solal-Celigny P et al. Watchful waiting in low-tumor burden follicular lymphoma in the rituximab era: Results of an F2-study database. J Clin Oncol 2012; 30: 3848-53.
12. Ardeshna KM et al. Rituximab versus a watch-and-wait approach in patients with advanced-stage, asymptomatic, non-bulky follicular lymphoma: An open-label randomised phase 3 trial. Lancet Oncol 2014; 15: 424-35.
13. Kahl BS et al. Rituximab extended schedule or re-treatment trial for low-tumor burden follicular lymphoma: Eastern Cooperative Oncology Group protocol E4402. J Clin Oncol 2014; 32: 3096-102.
14. Herold M et al. Rituximab added to first-line mitoxantrone, chlorambucil, and prednisolone chemotherapy followed by interferon maintenance prolongs survival in patients with advanced follicular lymphoma: An East German Study Group Hematology and Oncology study. J Clin Oncol 2007; 25: 1986-92.
15. Hiddemann W et al. Frontline therapy with rituximab added to the combination of cyclophosphamide, doxorubicin, vincristine, and prednisone (CHOP) significantly improves the outcome for patients with advanced-stage follicular lymphoma compared with therapy with CHOP alone: Results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood 2005; 106: 3725-32.
16. Marcus R et al. Phase III study of R-CVP compared with cyclophosphamide, vincristine, and prednisone alone in patients with previously untreated advanced follicular lymphoma. J Clin Oncol 2008; 26: 4579-86.
17. Salles G et al. Rituximab combined with chemotherapy and interferon in follicular lymphoma patients: Results of the GELA-GOELAMS FL2000 study. Blood 2008; 112: 4824-31.
18. Forstpointner R et al. The addition of rituximab to a combination of fludarabine, cyclophosphamide, mitoxantrone (FCM) significantly increases the response rate and prolongs survival as compared with FCM alone in patients with relapsed and refractory follicular and mantle cell lymphomas: Results of a prospective randomized study of the German Low-Grade Lymphoma Study Group. Blood 2004; 104: 3064-71.
19. Schulz H et al. Immunochemotherapy with rituximab and overall survival in patients with indolent or mantle cell lymphoma: A systematic review and meta-analysis. J Natl Cancer Inst 2007; 99: 706-14.
20. Rummel MJ et al. Bendamustine plus rituximab versus CHOP plus rituximab as first-line treatment for patients with indolent and mantle-cell lymphomas: An open-label, multicentre, randomised, phase 3 non-inferiority trial. Lancet 2013; 381: 1203-10.
21. Flinn IW et al. Randomized trial of bendamustine-rituximab or R-CHOP/R-CVP in first-line treatment of indolent NHL or MCL: The BRIGHT study. Blood 2014; 123: 2944-52.
22. Salles G et al. Rituximab maintenance for 2 years in patients with high tumour burden follicular lymphoma responding to rituximab plus chemotherapy (PRIMA): A phase 3, randomised controlled trial. Lancet 2011; 377: 42-51.
23. Forstpointner R et al. Maintenance therapy with rituximab leads to a significant prolongation of response duration after salvage therapy with a combination of rituximab, fludarabine, cyclophosphamide, and mitoxantrone (R-FCM) in patients with recurring and refractory follicular and mantle cell lymphomas: Results of a prospective randomized study of the German Low Grade Lymphoma Study Group (GLSG). Blood 2006; 108: 4003-8.
24. Salles GA et al. Obinutuzumab (GA101) in patients with relapsed/refractory indolent non-Hodgkin lymphoma: Results from the phase II GAUGUIN study. J Clin Oncol 2013; 31: 2920-6.
25. Fowler NH et al. Safety and activity of lenalidomide and rituximab in untreated indolent lymphoma: An open-label, phase 2 trial. Lancet Oncol 2014; 15: 1311-8.
26. Kimby E et al. Rituximab plus lenalidomide improves the complete remission rate in comparison with rituximab monotherapy in untreated follicular lymphoma patients in need of therapy. Primary endpoint analysis of the randomized phase-2 trial SAKK 35/10. Blood 2014; 124(21): ASH 2014, Abstract #799.
27. Gopal AK et al. PI3Kdelta inhibition by idelalisib in patients with relapsed indolent lymphoma. N Engl J Med 2014; 370: 1008-18.
28. Advani RH et al. Bruton tyrosine kinase inhibitor ibrutinib (PCI-32765) has significant activity in patients with relapsed/refractory B-cell malignancies. J Clin Oncol 2013; 31: 88-94.
29. Davids MS et al. Updated results of a phase I first-in-human study of the BCL-2 inhibitor ABT-199 (GDC-0199) in patients with relapsed/refractory non-Hodgkin lymphoma (NHL). J Clin Oncol 2013; 31 (15S): 523s (ASCO 2013, Abstract #8520).

Dr. med. Till Seiler
Prof. Dr. med. Wolfgang Hiddemann
(Leiter der Deutschen Studiengruppe
Niedrigmaligne Lymphome (GLSG))
Medizinische Klinik und Poliklinik III
Klinikum der Universität München
Marchioninistr. 15, 81377 München
+49 89 4400-72255
+49 89 4400-75252
till.seiler[at]med.uni-muenchen[dot]de
wolfgang.hiddemann[at]med.uni-muenchen[dot]de

