Multizentrischer Morbus Castleman (MCD) – ein seltenes, oft verkanntes Krankheitsbild
Diagnostik in der Onkologie
Im Vergleich zur vom US-Pathologen Benjamin Castleman 1954 erstmals beschriebenen benignen, lokalisierten („unizentrischen“) Hyperplasie des lymphatischen Gewebes [3] ist der Multizentrische Morbus Castleman (Multicentric Castleman Disease, MCD) eine ernste Systemerkrankung. Schon angesichts seiner unspezifischen, sehr variablen Symptomatik bleibt er problematisch für die Betroffenen – nicht nur wegen der (vor allem bei begleitender HIV-Infektion) eher ungünstigen Prognose, sondern auch, weil das Krankheitsbild oft weder Klinikern noch Pathologen bekannt ist. Die bisweilen schwer kranken Patienten haben mitunter lange diagnostische und therapeutische Irrwege hinter sich. Wahrscheinlich ist der MCD keine homogene Entität, sondern vielmehr als Syndrom bzw. klinisch-pathologische „Endstrecke“ sehr heterogener Pathomechanismen anzusehen. Wesentliche Gemeinsamkeit dieser Syndrome ist eine Überproduktion verschiedener Zytokine, vor allem von Interleukin-6 (IL-6). Aus diagnostischer wie aus therapeutischer Sicht ist es wichtig, zwischen Fällen mit (HHV-8-MCD) und ohne nachweisbare Infektion durch das Humane Herpes-Virus 8 (idiopathischer MCD) zu unterscheiden. Es besteht eine weitgehende, allerdings nicht vollständige Kongruenz von HHV-8 und HIV-Infektion. So sind über 90% der HIV-infizierten Patienten auch HHV-8-positiv, bei HIV-negativen Patienten jedoch nur 10–15% – hier überwiegt der idiopathische MCD.
Epidemiologie
Der MCD ist sehr selten. US-Schätzungen gehen von einer 10-Jahres-Prävalenz von 2,4 Fällen pro Million in der Allgemeinbevölkerung aus [13]. Bei HIV-infizierten Patienten liegt die Inzidenz einer britischen Studie zufolge [12] bei 4,3 Fällen auf 10.000 Patientenjahre (95%-Konfidenzintervall 2,7–6,4), bei in den letzten Jahren leicht steigender Tendenz. Auf Deutschland hochgerechnet ergeben sich jeweils einige Dutzend inzidente Fälle pro Jahr. Angesichts der diagnostischen Schwierigkeiten ist zu vermuten, dass ein beträchtlicher Teil davon nie korrekt diagnostiziert wird.
Pathogenese
In den HHV-8-positiven Fällen scheint der wesentliche Pathomechanismus weitgehend aufgeklärt zu sein. HHV-8 kann die Produktion eines viralen Interleukins induzieren, das dem humanen IL-6 ähnlich ist bzw. ähnliche Effekte induziert. IL-6 und IL-10 sind in enger Assoziation zur HHV-8-Viruslast erhöht [9]. Virales unterscheidet sich von humanem IL-6 auch dadurch, dass es nur an eine der beiden IL-6-Rezeptor-Untereinheiten binden muss, um seine Wirkung zu entfalten [7, 8]. Es hat deshalb ein deutlich breiteres Spektrum an Zielzellen und kann so wahrscheinlich die für den HHV-8-MCD typischen, klinisch sehr eindrucksvollen „Zytokin-Stürme“ verursachen. Infiziert werden vor allem Plasmazellen bzw. Plasmablasten, die in der Mantelzone der Lymphfollikel lokalisiert sind. Warum nur ein kleiner Teil der Patienten mit HHV-8-Infektion an einem MCD erkrankt, ist allerdings weiterhin unklar; ein schwerer Immundefekt ist nicht Voraussetzung.
Die Pathogenese des idiopathischen MCD ist komplexer. Mindestens drei diverse Ursachen für die Überproduktion der Zytokine werden diskutiert, darunter autoimmune Mechanismen bei entzündlichen Erkrankungen, die ektope Sekretion von Zytokinen durch maligne Zellen und virale Infektionen durch andere Viren als HHV-8, die möglicherweise noch gar nicht identifiziert sind [4]. Für sämtliche Ursachen gibt es gute Argumente und Hinweise. Möglicherweise spielt auch eine genetische Prädisposition (bestimmte Polymorphismen des Interleukin-6-Rezeptors) eine Rolle.
Klinik und Verlauf
Die sehr variable Klinik des MCD erklärt sich durch die vielfältigen Wirkungen von IL-6 auf Zellen. IL-6 und andere proinflammatorische Zytokine wie IL-10 induzieren u. a. Proliferation von B-Zellen und Plasmazellen, Sekretion vaskulärer endothelialer Wachstumsfaktoren und Angiogenese.
Beim HHV-8-MCD stehen die oft eindrucksvollen, schubweise auftretenden Lymphknotenschwellungen im Vordergrund, dazu besteht fast immer eine deutliche B-Symptomatik mit Fieber, Nachtschweiß und Gewichtsabnahme. Fast alle Patienten berichten über Schwäche und erhebliches Krankheitsgefühl, die Milz ist obligat vergrößert. Hepatomegalie, respiratorische Symptome und Ödem-Neigung bei Hypoalbuminämie sind ebenfalls in der Mehrzahl der Fälle zu finden [6, 9]. Hämatologisch führend ist oft eine schwere Anämie, nicht selten von massiven Thrombozytopenien begleitet. Die Ausprägung der Symptome fluktuiert mitunter erstaunlich. Typischerweise verläuft die Erkrankung in Schüben, die einige Tage bis Wochen anhalten und in denen die Patienten oft hoch fiebern und schwer krank sind. Das C-reaktive Protein (CRP) liegt meist über 100 mg/l und verleitet oft zu (wirkungsloser) Breitband-Antibiose. Die Schübe werden von längeren, mitunter mehrwöchigen Perioden unterbrochen, in denen es den Patienten wieder relativ gut geht. Ohne jede Maßnahme können sich dabei die Lymphknoten vorübergehend zurückbilden, das CRP normalisieren (fälschlich vermuteter Antibiotika-Effekt!). Mit zunehmender Dauer der Erkrankung nimmt die Frequenz der Schübe zu, allerdings sind auch selbstlimitierende Verläufe möglich. Es besteht insgesamt ein deutlich erhöhtes Risiko für maligne Lymphome, typischerweise eher seltene Subtypen wie plasmablastische Lymphome oder sogenannte Primary Effusion-Lymphome.
Beim idiopathischen MCD sind die klinischen Symptome mit Fieber, Lymphknotenschwellungen und Anämie meist nicht so ausgeprägt, der schubweise Verlauf ist weniger abrupt, und auch das CRP liegt meist niedriger. Führendes Symptom scheint eine mehr oder weniger ausgeprägte Fatigue zu sein. In schweren Fällen können jedoch auch hier Ödeme bis zu Anasarka, Dyspnoe und Multiorganversagen auftreten. Häufiger als beim HHV-8-MCD finden sich beim idiopathischen MCD Assoziationen mit dem POEMS-Syndrom, einem aus peripherer Neuropathie, Organomegalie, Endokrinopathie, monoklonaler Gammopathie und Hautveränderungen bestehenden Krankheitsbild, das sich klinisch und pathogenetisch wahrscheinlich in enger Nähe zu den Castleman-Syndromen befindet. Die POEMS-typischen Hautveränderungen finden sich beim HHV-8-MCD so gut wie nicht, stattdessen liegt hier in der Mehrheit der Fälle gleichzeitig ein Kaposi-Sarkom vor.
Die Prognose des MCD ist eher ungünstig. Einem systematischen Review zufolge lag das krankheitsfreie Überleben nach drei Jahren beim idiopathischen MCD bei 45,7%, beim HIV-positiven (meist HHV-8-positiven) MCD nur bei 27,8% [14]. In einer eigenen retrospektiven Untersuchung waren nach einer Beobachtungszeit von 2,2 Jahren 19 von 52 Patienten mit HHV-8-MCD verstorben [6]. Vieles spricht allerdings dafür, dass sich die Prognose in den letzten Jahren durch spezifische Therapien (s. u.) deutlich verbessert hat.
Diagnostik
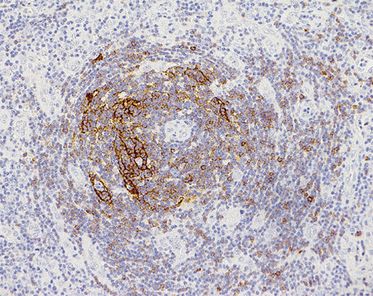
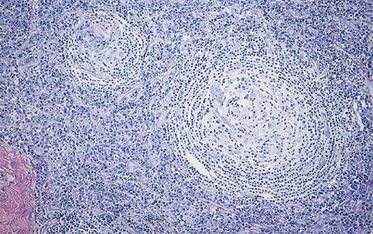
Die Diagnose wird histologisch aus einem exstirpierten Lymphknoten gestellt – eine Punktion reicht nicht aus. Im Präparat zeigen sich eine reaktive Lymphadenitis mit Plasmazell-Vermehrung in der Pulpa und regressive Veränderungen der Keimzentren, die meist zwiebelschalenartig geschichtet und von Gefäßen durchzogen sind. Beim HHV-8-MCD besteht oft zusätzlich ein sogenanntes Mottenfraß-Muster im Bereich der Mantelzone. Das charakteristische Zwiebelschalen-Muster aus den follikulären dendritischen Retikulum-Zellen ist dabei partiell zerstört (siehe Abb. 1, 2).
Die histopathologischen Veränderungen können sehr unterschiedlich stark ausgeprägt sein. Mikroskopisch unterscheidet man einen hyalin-vaskulären und einen Plasmazell-reichen Typ des Morbus Castleman. Nicht selten bereitet die Diagnose des MCD erhebliche Schwierigkeiten. Eine eindeutige, weithin akzeptierte Definition liegt leider bislang nicht vor. Zahlreiche Differenzialdiagnosen kommen in Betracht, Mischbilder existieren.
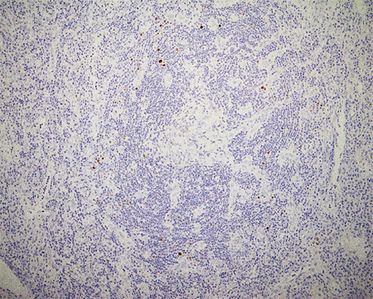
Beim HHV-8-MCD reicht nach Auffassung einiger Experten die Trias aus B-Symptomatik, nachweisbarer HHV-8-Virämie und histologischem Befund [1]. Die Abgrenzung zu einer HIV-assoziierten Lymphadenopathie ist bisweilen schwierig, die Färbung der Plasmazellen mit HHV-8 bringt hier meist die Diagnose (Abb. 3). Wichtig ist die enge Kooperation zwischen Klinikern und Pathologen: Erstere sollten explizit auf den Verdacht eines MCD hinweisen und sich bei schubweisem Verlauf mit B-Symptomatik, Splenomegalie, hohem CRP und fluktuierenden Lymphknotenschwellungen nicht mit der pathologischen Diagnose einer HIV-assoziierten Lymphadenopathie zufriedengeben.
Beim idiopathischen MCD ist überdies noch eine Vielzahl von Erkrankungen abzugrenzen [4]. Die durch eine IL-6-Überproduktion verursachten histopathologischen Veränderungen sind oft unspezifisch und finden sich bei einer Vielzahl von Infektionen (u. a. EBV), inflammatorischen Erkrankungen (u. a. Lupus erythematodes, rheumatoide Arthritis, Sjögren-Syndrom) und Neoplasien (v. a. Lymphome).
Neben den histopathologischen Veränderungen sind deshalb immer auch klinische und laborchemische Parameter zu berücksichtigen. Als Verlaufsparameter eignen sich beim MCD vor allem das CRP, IL-6 und im Falle eines HHV-8-MCD auch die quantitative HHV-8-PCR.
Therapie
Eine eindeutige Empfehlung für die Behandlung des MCD kann nicht gegeben werden. Während beim unizentrischen Morbus Castleman eine chirurgische Intervention meist erfolgreich ist, bleibt die Therapie des MCD schwierig. Verschiedene therapeutische Strategien wurden versucht, darunter a) antiinflammatorische und immunsuppressive Therapien (vor allem Steroide und Thalidomid), b) die zytotoxische Elimination der für die Zytokin-Überproduktion verantwortlichen Zellen (vor allem Rituximab mit und ohne Zytostatika), c) antivirale Substanzen (Valganciclovir, nur beim HHV-8-MCD) sowie neuerdings d) die Blockade des IL-6-Signalweges mittels monoklonaler Antikörper. Die überzeugendsten Ergebnisse liegen für Rituximab (beim HHV-8-MCD) und Siltuximab (beim idiopathischen MCD) vor, die beide hier kurz diskutiert werden sollen.
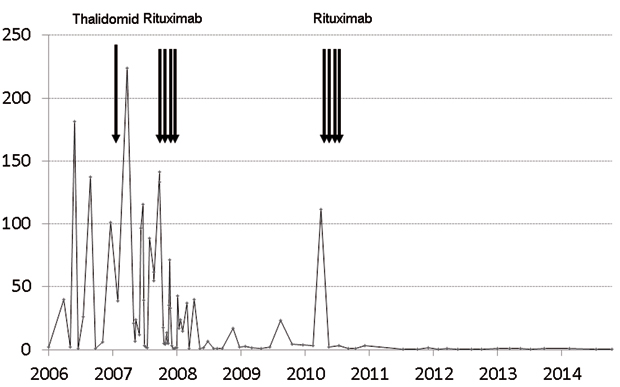
Rituximab, ein monoklonaler Antikörper gegen CD20, hat sich beim HHV-8-MCD in mehreren Fallserien als wirksam erwiesen. Gesamt- und krankheitsfreies Überleben waren gegenüber früheren Untersuchungen deutlich verbessert. Zytokine, aber auch CRP, Immunglobuline und HHV-8-Viruslast sanken unter Rituximab deutlich [2, 6]. Dauerhafte komplette Remissionen sind möglich (Abb. 4), auch sinkt das Lymphom-Risiko der Patienten [5]. In schweren Fällen ist nach Meinung einiger Experten auch die Kombination mit einer Chemotherapie, etwa mit oralem Etoposid, zu empfehlen. Wesentlicher unerwünschter Effekt von Rituximab ist die Reaktivierung oder Progression eines oft begleitenden Kaposi-Sarkoms, die wohl in etwa einem Drittel der Fälle zu beobachten sind. Möglicherweise ist die Kombination mit KS-wirksamen zytostatischen Substanzen wie liposomalem Doxorubicin sinnvoll [15]. Die Krankenkasse sollte vorher kontaktiert werden, da Rituximab teuer und für den MCD nicht zugelassen ist. Beim idiopathischen MCD scheint der Erfolg von Rituximab nicht so eindrucksvoll zu sein, allerdings fehlen dazu kontrollierte Studien.
Siltuximab ist ein monoklonaler Antikörper gegen humanes IL-6 und seit 2014 als erstes Medikament für die Behandlung des idiopathischen MCD zugelassen. In der Zulassungsstudie waren 79 zum Teil vorbehandelte Patienten mit idiopathischem MCD entweder mit dreiwöchentlichen Infusionen mit Siltuximab oder Placebo behandelt worden [16]. Primärer Endpunkt war ein über mindestens 18 Wochen andauerndes Ansprechen hinsichtlich Tumorgröße (mindestens „teilweises“ Ansprechen mit einem Rückgang von 50%) und der Verbesserung eines klinischen Symptom-Scores. Während in der Placebogruppe kein Ansprechen zu beobachten war, lag die Rate in der Verumgruppe bei 34%. Siltuximab war insgesamt gut verträglich. Angesichts des Wirkmechanismus sind die dreiwöchentlichen Infusionen bis auf Weiteres fortzuführen, allerdings können die Intervalle bei Ansprechen auf sechs Wochen ausgeweitet werden. Beim HHV-8-MCD ist Siltuximab bislang nicht getestet worden, weil es wahrscheinlich nicht an das virale IL-6 bindet. Allerdings gibt es Hinweise, dass es trotzdem wirksam sein könnte [11].
Literatur
1. Bower M et al. J Acquir Immune Defic Syndr 2014; 65: e80-2.
2. Bower M et al. Blood 2009; 113: 4521-4.
3. Castleman B, Towne VW. N Engl J Med 1954; 251: 396-400.
4. Fajgenbaum DC et al. Blood 2014; 123: 2924-33.
5. Gérard L et al. Blood 2012; 119: 2228-33.
6. Hoffmann C et al. Blood 2011; 118: 3499-503.
7. Li H et al. J Virol 2001; 75: 3325-34.
8. Moore PS et al. Science 1996; 274: 1739-44.
9. Oksenhendler E et al. Blood 2000; 96: 2069-73.
10. Oksenhendler E et al. AIDS 1996; 10: 61-7.
11. Polizzotto MN et al. Blood 2013; 122: 4189-98.
12. Powles T et al. Ann Oncol 2009; 20: 775-9.
13. Robinson D Jr et al. Br J Haematol 2014; 165: 39-48.
14. Talat N, Schulte KM. Oncologist 2011; 16: 1316-24.
15. Uldrick TS et al. Blood 2014; 124: 3544-52.
16. van Rhee F et al. Lancet Oncol 2014; 15: 966-74.

PD Dr. med. Christian Hoffmann
Infektionsmedizinisches Centrum Hamburg
Glockengiesserwall 1, 20095 Hamburg