Chronische lymphatische Leukämie
Kasuistik
Der Fall
Bei dem Patienten (Jahrgang 1936) wurde im Jahr 2001 in Australien eine chronische lymphatische Leukämie diagnostiziert, die zunächst keiner Behandlung bedurfte und nur beobachtet wurde. Als 2012 eine Therapie notwendig wurde, erhielt der fitte Patient das mittlerweile etablierte FCR-Regime (Fludarabin, Cyclophosphamid, Rituximab), gefolgt von einer Rituximab-Erhaltungstherapie, für die ein Nutzen nicht belegt ist. Darunter zeigte sich allerdings im Mai 2013 eine Progression der Erkrankung, sodass auf ein intensiveres, wenngleich bei der CLL bisher nicht erprobtes Protokoll umgestellt wurde: Der Patient erhielt nun wöchentlich alternierende Zyklen von oralem Prednisolon mit intravenösem Doxorubicin, Cyclophosphamid und Etoposid (PACE) bzw. Bleomycin, Vincristin und Methotrexat i. v. (BOM), was aber die weitere Progression ebenfalls nicht verhindern konnte. Mittlerweile in Deutschland angekommen, wurde bei dem Patienten im September 2013 eine Therapie mit Bendamustin-Rituximab (BR) eingeleitet. Wegen weiterer Progression wurde eine zytogenetische Testung veranlasst, die eine Deletion 17p ergab.
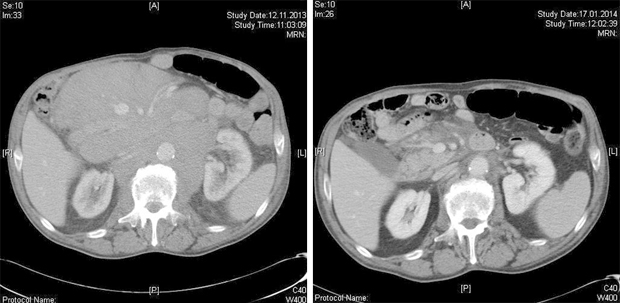
Glücklicherweise konnte der Patient zu diesem Zeitpunkt (im November 2013) in München in die kurz zuvor gestartete amerikanisch-europäisch-australische Phase-II-Studie M13-982 (ClinicalTrials.gov identifier: NCT01889186) eingeschlossen werden, in der die Wirksamkeit des BCL2-Inhibitors ABT-199 (Venetoclax) bei CLL-Patienten mit del(17p) getestet werden soll. Primärer Endpunkt der Studie ist neben Sicherheitsparametern die Ansprechrate. Hier ist unser Patient eindeutig als Responder zu klassifizieren, wie ein Vergleich der beiden Computertomogramme vor und etwa zwei Monate nach Beginn der Therapie zeigt (Abb. 1).
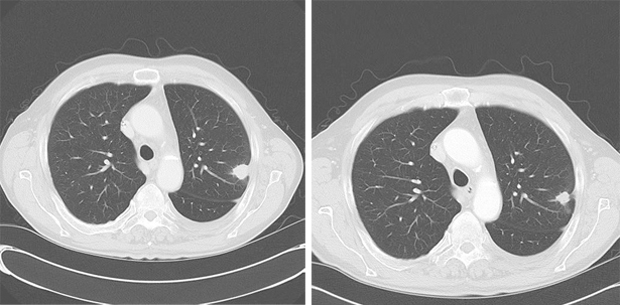
Unter der weiteren Behandlung mit Venetoclax trat im April 2014 eine Pilz-Pneumonie auf, die sich aber unter Behandlung mit Voriconazol zurückbildete (Abb. 2).
Diskussion
Die chronische lymphatische Leukämie, die häufigste Leukämie des Erwachsenen, ist mit den heute zugelassenen Therapien meist gut zu behandeln, wenngleich in der Regel noch nicht heilbar. Die Einführung des CD20-Antikörpers Rituximab zusätzlich zur FC-Chemotherapie durch die CLL8-Studie der Deutschen CLL-Studiengruppe (GCLLSG, [1]) hat die Therapie fitter Patienten grundlegend verbessert und erstmals in der Geschichte der CLL auch zu einer Lebensverlängerung geführt. Da fitte Patienten angesichts des Altermedians von 72 Jahren bei Diagnose der CLL in der Minderzahl sind, hat die GCLLSG mit ihrer CLL11-Studie bei den häufigeren älteren Patienten mit Komorbiditäten den Weg in die Zukunft eröffnet: Die Kombination des alten Standards bei diesen Patienten, einer milden Chlorambucil-Chemotherapie mit dem neuen Typ-II-CD20-Antikörper Obinutuzumab hat hier zumindest beim progressionsfreien Überleben die alleinige Chlorambucil-Behandlung, aber auch die Kombination aus Chlorambucil und Rituximab weit übertroffen [2].
Eine Gruppe von Patienten, die auf diese Standardtherapien nicht gut ansprechen, sind jedoch diejenigen mit bestimmten zytogenetischen Anomalien (z. B. del(17p), del(11q)) und mit unmutierten IGHV-Genen. Auch für diese Patienten scheint sich mittlerweile das Blatt zu wenden: Zwei vor Kurzem zugelassene Medikamente, der Btk-Inhibitor Ibrutinib und der PI3Kδ-Hemmer Idelalisib haben in Studien, an denen die GCLLSG ebenfalls beteiligt war, bei Patienten mit del(17p) ähnliche Wirksamkeit gezeigt wie bei der Gesamtheit der CLL-Patienten [3, 4].
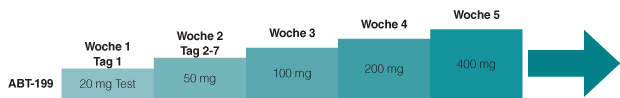
Eine weitere neue Substanz, die noch nicht zugelassen ist, aber Anlass zu den besten Hoffnungen gibt, ist der BCL2-Inhibitor Venetoclax (ABT-199). Das mitochondriale Protein BCL2, das durch Venetoclax gehemmt wird, ist in vielen Tumoren überexprimiert und verhindert die Apoptose der Tumorzellen. Bereits in einer Phase-I-Studie war die Wirksamkeit so gut, dass hier mehrere Tumorlyse-Syndrome beobachtet wurden, von denen eines letal endete [5]. Dieses Problem lässt sich durch ein einschleichendes Dosierungsschema umgehen, das in den Folgestudien – wie auch bei unserem Patienten –verwendet wird: An Tag 1 erhält der Patient eine Testdosis von
20 mg; verträgt er sie problemlos, werden für den Rest der ersten Woche 50 mg/d gegeben. Diese Dosis wird dann jede Woche verdoppelt, sodass man stufenweise bis zur vierten Woche zur Zieldosis von 400 mg/d kommt (Abb. 3). Seitdem dieses Schema verwendet wird, ist es zu keinen Tumorlyse-Syndromen mehr gekommen.
Die klinische Remission, die bei unserem Patienten innerhalb von gut zwei Monaten zu beobachten war, ist eindrucksvoll. In die Phase-II-Studie, in der er behandelt wird, werden nur Patienten mit CLL und del(17p13), d. h. mit Deletion des TP53-Lokus eingeschlossen. Die Hauptkohorte von 107 solchen Patienten ist bereits komplett rekrutiert, für eine Erweiterungskohorte, in der die Sicherheit und die Prophylaxe von Tumorlyse-Syndromen eingehender untersucht werden sollen, werden noch etwa 50 Patienten rekrutiert. Dass auch zielgerichtete Therapien nicht ohne Nebenwirkungen sind und dass deshalb die Analyse der Sicherheit wichtig ist, zeigt sich auch in unserem Fall an der Pilzinfektion der Lunge, die aber mit gängiger antifungaler Therapie gut behandelbar war.
Ein weiteres Problem, das auch bei modernen, zielgerichteten Therapien nicht vernachlässigt werden darf, ist die mögliche Entwicklung von Resistenzen. Für Ibrutinib sind solche Resistenzen bereits in der Klinik beschrieben worden [6], und auch für die anderen Substanzen sind sie zu erwarten. Für Venetoclax gibt es bisher lediglich In-vitro-Daten aus Zellkulturen und Tiermodellen, wo Mutationen im BCL2- ebenso wie in anderen Proteinen beschrieben wurden, die die Apoptose-Hemmung durch Venetoclax zu unterdrücken scheinen [7]. Vermutlich lassen sich solche Resistenzen in der Klinik am besten vermeiden, indem die Substanzen nicht in Monotherapie, sondern in Kombinationen angewendet werden. So wurden beim ASH-Kongress im Dezember 2014 in San Francisco erste Daten von Kombinationen von Venetoclax mit Rituximab [8] ebenso wie mit Obinutuzumab [9] gezeigt, die bei Patienten mit rezidivierter/refraktärer CLL hohe Ansprechraten ergaben.
Fazit: Unserem Patienten geht es unter der Behandlung mit Venetoclax gut, und die Entwicklung bei der CLL lässt in der näheren Zukunft eine weitere Verbesserung unserer therapeutischen Möglichkeiten erwarten.
Literatur
1. Hallek M et al. Addition of rituximab to fl udarabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: A randomised, open-label, phase 3 trial. Lancet 2010; 376: 1164-74.
2. Goede V et al. Obinutuzumab plus Chlorambucil in Patients with CLL and Coexisting Conditions. N Engl J Med 2014; 370: 1101-10.
3. O´Brien S et al. Efficacy and safety of ibrutinib in patients with relapsed or refractory chronic lymphocytic leukemia or small lymphocytic leukemia with 17p deletion: Results from the phase II RESONATE™-17 trial. ASH 2014, Abstract #327.
4. Sharman J et al. Second interim analysis of a phase 3 study of idelalisib (ZYDELIG®) plus rituximab ® for relapsed chronic lymphocytic leukemia (CLL): Efficacy analysis in patient subpopulations with del(17p) and other adverse prognostic factors. ASH 2014, Abstract #330.
5. Seymour JF et al. EHA 2014, Abstract S702.
6. Woyach JA et al. Resistance mechanisms for the Bruton's tyrosine kinase inhibitor ibrutinib. N Engl J Med 2014; 370(24):2286-94.
7. Fresquet V et al. Acquired mutations in BCL2 family proteins conferring resistance to the BH3 mimetic ABT-199 in lymphoma. Blood 2014; 123(26):4111-9.
8. Roberts A et al. Determination of recommended phase 2 dose of ABT-199 (GDC-0199) combined with rituximab (R) in patients with relapsed/refractory (R/R) chronic lymphocytic leukemia (CLL). ASH 2014, Abstract #325.
9. Flinn I et al. Preliminary results of a phase 1b study (GP28331) combining GDC-0199 (ABT-199) and obinutuzumab in patients with relapsed/refractory or previously untreated chronic lymphocytic leukemia. ASH 2014, Abstract #4687.
Prof. Dr. Clemens-Martin Wendtner
Klinik für Hämatologie, Onkologie, Immunologie, Palliativmedizin, Infektiologie und Tropenmedizin, Klinikum Schwabing
Akademisches Lehrkrankenhaus der
Universität München
Kölner Platz 1, 80804 München

