Neues zum Multiplen Myelom
ASH 2014
Die Therapie des Multiplen Myeloms hat in den letzten Jahren durch die Einführung zielgerichteter Therapien, vor allem von Immunmodulatoren und Proteasominhibitoren, enorme Fortschritte gemacht, aber heilbar ist die Erkrankung in der Regel noch immer nicht. Früher oder später werden nahezu alle Patienten ein Rezidiv erleiden, und mit jedem folgenden Rezidiv werden Tiefe und Dauer des Ansprechens geringer. Deshalb werden weiter neue Substanzen entwickelt, um die Dauer der Remissionen und hoffentlich auch die Überlebenszeiten immer mehr zu verlängern. Ziel ist die sogenannte personalisierte Myelom-Therapie, bei der molekularbiologisch und genetisch umfassend charakterisierte Patienten individuell entsprechend ihres Risikoprofils therapiert werden können. Beim ASH-Kongress in San Francisco wurden neue Daten zu Zweitgenerations-Proteasominhibitoren und -Immunmodulatoren sowie zu neuen Substanzklassen wie Deacetylaseinhibitoren und monoklonalen Antikörpern vorgestellt.
Für Myelom-Patienten im Rezidiv ist Lenalidomid in Kombination mit niedrig-dosiertem Dexamethason (Rd) ein Standard in den USA ebenso wie in Europa. Diese Patienten haben in aller Regel in der Erstlinientherapie bereits den Proteasominhibitor Bortezomib erhalten, aber die Zweitgenerations-Substanz Carfilzomib hat in frühen Studien auch bei Bortezomib-refraktären Myelom-Erkrankungen Wirkung gezeigt. In der ASPIRE-Studie wurden deshalb 792 Patienten mit rezidiviertem Myelom, die bis zu drei Vortherapien erhalten hatten, randomisiert, um Rd alleine oder in Kombination mit Carfilzomib zu erhalten [1].
In einer Interimsanalyse, die Keith Stewart, Scottsdale, präsentierte, konnte Carfilzomib die Ansprechrate signifikant von 66,9% auf 87,4% erhöhen (p < 0,0001), ebenso den Anteil an Komplettremissionen (31,8% vs. 9,3%; p < 0,0001). Auch die Dauer des progressionsfreien Überlebens – der primäre Endpunkt der Studie – verlängerte sich von median 17,6 auf 26,3 Monate (Hazard Ratio 0,69; p < 0,0001). Damit wurde erstmals in einer solchen Population die 2-Jahres-Marke beim progressionsfreien Überleben überschritten; die mediane Dauer des Ansprechens lag sogar bei 28,6 Monaten (versus 21,2 Monate in der Kontrollgruppe). Beim Gesamtüberleben waren die Medianwerte in beiden Armen noch nicht erzielt worden; mit 2-Jahres-Überlebensraten von 73,3% vs. 65,0%, einer Hazard Ratio von 0,79 und einem p-Wert von 0,018 war der Unterschied zwar nach herkömmlichen statistischen Kriterien signifikant, aber die vorab festgelegte Grenze von p = 0,005 für eine Beendigung der Studie war zu diesem Zeitpunkt noch nicht erreicht. Signifikant verbessert war außerdem die Gesundheits-bezogene Lebensqualität (p = 0,0001), die mit dem EORTC QLQ-C30-Fragebogen erhoben worden war, und Nebenwirkungen waren unter der Dreierkombination seltener, was sich in weniger Therapieabbrüchen und einer längeren Behandlungsdauer äußerte. Eine Phase-III-Studie, in der Carfilzomib plus Dexamethason bei Myelom-Patienten im Rezidiv randomisiert mit Bortezomib/Dexamethason verglichen wird, hat mittlerweile die Rekrutierung abgeschlossen.
Pomalidomid/Dexamethason wirkt unabhängig von Vortherapien
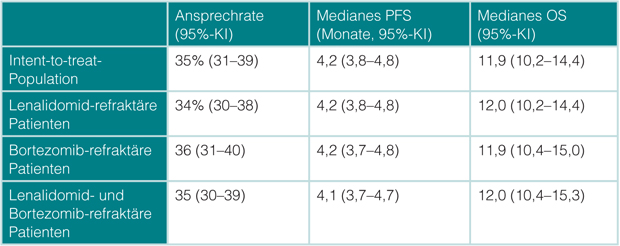
Carfilzomib ist in Nordamerika seit eineinhalb Jahren, in Europa aber noch nicht zugelassen, wohl aber seit etwas mehr als einem Jahr der neue Immunmodulator Pomalidomid, der auch direkte Anti-Myelom-Aktivität aufweist und außerdem hemmend auf Stromazellen wirkt. Er ist auf der Basis der MM-003-Studie [2, 3] in Kombination mit niedrig-dosiertem Dexamethason indiziert bei Patienten, die mindestens schon Bortezomib und Lenalidomid erhalten haben und unter der letzten Therapie progredient waren. In der europaweiten Phase-IIIb-Studie STRATUS, an der auch einige deutsche Zentren teilnahmen (darunter auch die Sektion Multiples Myelom in Heidelberg), konnten, wie Meletios Dimopoulos, Athen, berichtete, diese Ergebnisse an der bisher größten mit dieser Kombination behandelten Population von 604 Patienten bestätigt werden [4]: Die Gesamtansprechrate von 35% bei 7% sehr guten partiellen und 1% kompletten Remissionen war unabhängig davon, ob die Patienten refraktär gegenüber Lenalidomid, Bortezomib oder beiden Substanzen gewesen waren (Tab. 1). Die mediane progressionsfreie Überlebenszeit lag bei 4,2, die Gesamtüberlebenszeit bei 11,9 Monaten; auch das war unabhängig von der Art der Vorbehandlung und vom Ansprechen darauf (Tab. 1). Damit wird der Status von Pomalidomid/Dexamethason als Therapiestandard für Patienten mit rezidiviertem/refraktärem Myelom nach Versagen von Bortezomib und Lenalidomid bestätigt.
Auch das Gute kann mitunter mit einfachen Mitteln noch verbessert werden: Das zeigt eine US-amerikanische Phase-II-Studie, in der Rachid Baz, Tampa, und Kollegen 70 Patienten, die den Einschlusskriterien der STRATUS-Studie entsprachen, randomisiert mit Pomalidomid/Dexamethason mit oder ohne Zugabe von Cyclophosphamid behandelten [5]. Die Patienten hatten im Median vier Vortherapien erhalten und waren alle refraktär gegen Lenalidomid. Nach median 15 Monaten Follow-up war die Dreierkombination mit einer Ansprechrate von 65% (versus 39%, p = 0,03) deutlich überlegen. Die progressionsfreie Überlebenszeit war von 4,4 auf 9,2 Monate verdoppelt worden (p = 0,04), beim Gesamtüberleben ergab sich mit 16,4 vs. 10,5 Monaten ein nicht ganz signifikanter Vorteil (p = 0,08); das ist auch unter dem Aspekt zu sehen, dass 13 Patienten im Verlauf der Studie vom Kontroll- in den experimentellen Arm wechselten und ebenfalls Cyclophosphamid erhielten. Hämatologische Grad-3/4-Toxizitäten waren hier etwas häufiger, aber gut handhabbar.
Carfilzomib mit Deacetylaseinhibitor kombiniert
Die Zulassung des Pan-Deacetylase-inhibitors Panobinostat wurde von der US-amerikanischen Food and Drug Administration im November 2014 abgelehnt, trotz sehr guter Ergebnisse in der Phase-III-Studie PANORAMA1 in Kombination mit Bortezomib und Dexamethason bei Patienten mit rezidiviertem und refraktärem Myelom [6]. Bei der ASH-Tagung stellte Jonathan Kaufman, Atlanta, eine Phase-I-Studie des Multiple Myeloma Research Consortium vor, in der Panobinostat bei therapierefraktären Patienten mit Carfilzomib und Dexamethason kombiniert worden war [7].
Die bislang 26 behandelten Patienten hatten vorher median drei Therapien erhalten, 62% waren gegen Bortezomib, 85% gegen Immunmodulatoren refraktär, und 88% hatten bereits mindestens eine autologe Stammzelltransplantation bekommen. Unter den maximal tolerierten Dosierungen beider Medikamente wurden keine unerwarteten Toxizitäten registriert – die häufigsten Grad-3-Nebenwirkungen waren hämatologischer Natur –, und die Patienten konnten mehr als 90% der geplanten Dosen erhalten.
Die Gesamtansprechrate war mit 46% für eine so stark vorbehandelte Patientenpopulation bemerkenswert. Patienten, die gegen Bortezomib refraktär waren, schnitten mit 44% Ansprechrate nicht schlechter ab. Bei einer medianen progressionsfreien Überlebenszeit von 11,4 Monaten und der guten Verträglichkeit ist die Kombination aus Carfilzomib und Panobinostat auf jeden Fall für die Untersuchung in weiterführenden Studien prädestiniert.
Wurde in der ASPIRE-Studie der neue Proteasominhibitor Carfilzomib mit dem Erstgenerations-Immunmodulator Lenalidomid kombiniert, so wählte die Myelom-Gruppe der Mayo Clinic den umgekehrten Ansatz: In einer Phase-I/II-Studie, die Martha Lacy, Rochester, vorstellte, gab sie bei 50 ebenfalls vorbehandelten Patienten Pomalidomid zum Erstgenerations-Proteasominhibitor Bortezomib und Dexamethason (PVD, [8]). Mit einer Ansprechrate von 81% sind nach median neun Monaten 72% der Patienten progressionsfrei und 96% noch am Leben; der Medianwert des progressionsfreien Überlebens liegt bei 17,7 Monaten. Durch die einmal wöchentliche Gabe wurde die Verträglichkeit von Bortezomib in diesem Regime verbessert; es gab keine Neuropathien und lediglich bei einem Patienten ein thromboembolisches Ereignis.
Monoklonale Antikörper jetzt auch beim Myelom
Monoklonale Antikörper wurden vor mehr als 15 Jahren erstmals in die Hämatologie eingeführt – nun sind sie dabei, Einzug auch in die Therapie des Multiplen Myeloms zu halten. Es gibt auf den Myelomzellen eine Reihe von Antigenen, die sich für einen immuntherapeutischen Angriff eignen; am weitesten fortgeschritten sind Antikörper gegen CD38, vor allem Daratumumab. Er hat in Phase-I- und Phase-II-Studien in Monotherapie eine signifikante Reduktion des M-Proteins, eine Abnahme des Anteils an Plasmazellen im Knochenmark bei Patienten mit refraktärem Myelom und ein akzeptables Toxizitätsprofil gezeigt (z. B. [9]) und erhielt von der Food and Drug Administration in den USA eine „Breakthrough Drug Designation“. In-vitro-Untersuchungen legen nahe, dass sich der Antikörper auch sehr gut als Kombinationspartner eignet, und das wird in einer Phase-I/II-Studie untersucht, die Torben Plesner, Velje, Dänemark, in San Francisco vorstellte [10]: In Kombination mit Lenalidomid und Dexamethason war die Verträglichkeit ausgezeichnet, alle Patienten zeigten eine merkliche Abnahme des M-Proteins, und von 20 auswertbaren Patienten mit rezidiviertem und/oder refraktärem Myelom erzielten 15 mindestens eine partielle Remission (darunter drei komplette und sechs sehr gute partielle Remissionen).
Ein weiterer CD38-Antikörper, SAR650984, konnte ebenfalls in Monotherapie hohe Ansprechraten bei Patienten mit rezidiviertem/refraktärem Myelom bewirken [11] und wird auch in Kombination mit Lenalidomid und Dexamethason untersucht – mit ähnlicher Wirksamkeit wie Daratumumab [12], nämlich einer Ansprechrate von 64,5% (das Ansprechen vertieft sich mit zunehmender Behandlungsdauer) und einer medianen progressionsfreien Überlebenszeit von 6,2 Monaten. Die weitere Untersuchung beider Antikörper in klinischen Studien dürfte zu vielversprechenden Ergebnissen führen.
Neues beim neu diagnostizierten Myelom
Zum neu diagnostizierten Multiplen Myelom gab es dieses Mal nicht so viele Präsentationen. Eine interessante Studie der spanischen Myelom-Studiengruppe versuchte, die Erstlinientherapie älterer Patienten, die nicht für eine autologe Stammzelltransplantation infrage kommen, zu optimieren [13]. Zwei der wirksamsten derzeit verfügbaren Protokolle für diese Patienten sind das „VISTA“-Protokoll (VMP: Bortezomib, Melphalan, Prednison) und Rd (Lenalidomid mit niedrig-dosiertem Dexamethason). Alle vier Anti-Myelom-Substanzklassen (Proteasominhibitor, Immunmodulator, Alkylans und Steroid) gleichzeitig einzusetzen ist sicherlich nicht geraten, weil die wahrscheinlich bessere Wirksamkeit aufgrund zu hoher Toxizität nicht zur Geltung kommen würde. Alternativen dazu wären die sequenzielle oder aber die alternierende Gabe von VMP und Rd, wobei die alternierende Gabe theoretisch die Entwicklung resistenter Zellklone und die Entstehung von kumulativer Toxizität besser vermeiden könnte. Die spanischen Kollegen um Maria-Victoria Mateos, Salamanca, randomisierten 242 Patienten, entweder neun Zyklen VMP und danach neun Zyklen Rd oder beide Regimes abwechselnd (insgesamt ebenfalls 18 Zyklen) zu erhalten.
Nach Ende der Therapie hatten die Patienten mit dem alternierenden Protokoll niedrigere Raten an Komplettremissionen, aber das progressionsfreie Überleben war mit median 30 Monaten in beiden Armen absolut identisch, ebenso das Gesamtüberleben nach drei Jahren mit 68% bzw. 67%. Besser war die Prognose im Sinne eines längeren progressionsfreien und Gesamtüberlebens für die Patienten, die eine komplette Remission erreichten und unter 75 Jahre alt waren, aber auch hier zeigten sich keine Unterschiede zwischen den beiden Therapiealternativen. Hinsichtlich der Toxizität fand sich ebenfalls kein Unterschied zwischen beiden Armen.
Patienten, die eine komplette oder sogar eine stringente Komplettremission erzielten, hatten nach drei Jahren ein exzellentes progressionsfreies (76%) und Gesamtüberleben (94%); diese Prognose kann sich mit der von Patienten messen, die für eine Transplantation geeignet sind. Insbesondere für Patienten im Alter zwischen 65 und 75 Jahren stellt dieser „Total Therapy“-Ansatz, in dem die vier wirksamsten Myelom-Medikamente vertreten sind, eine attraktive Option dar.
Neue Medikamente in der Erstlinie
In einer weiteren Phase-I/Ib-Studie, die Jatin Shah, Houston, vorstellte, wurde Panobinostat auch bei Patienten mit neu diagnostiziertem Myelom getestet, und zwar in Kombination mit der Dreierkombination aus Lenalidomid, Bortezomib und Dexamethason (RVD, [14]). Diese Patienten erhalten, wenn sie jung und fit genug sind, zunächst eine Induktionstherapie und daraufhin eine autologe Stammzelltransplantation. Das langfristige Outcome ist umso besser, je tiefer das Ansprechen auf die Induktion war. Die Kombination wurde ausgezeichnet vertragen, und nach vier Zyklen war die Ansprechrate mit 95% überragend, davon hatten 77% der Patienten mindestens eine sehr gute partielle und 50% eine komplette Remission. Panobinostat beeinträchtigte nicht die Mobilisierung und Gewinnung von hämatopoetischen Stammzellen für die Transplantation. In einer randomisierten Phase-II-Studie sollen diese Ergebnisse nun bestätigt werden.
Ebenfalls der Bestätigung bedürfen die Resultate einer weiteren Phase-Ib-Studie, in der sich der CD38-Antikörper Daratumumab auch in Kombination mit mehreren weiteren Myelom-Regimes (Bortezomib mit Dexamethason, Melphalan/Dexamethason oder Thalidomid/Dexamethason sowie Pomalidomid mit Dexamethason) als hochwirksam und sicher erwies [15]. Das Ansprechen der ersten 25 Patienten war unabhängig vom verwendeten „Backbone“-Regime ausgezeichnet, so Philippe Moreau, Nantes, und die Zugabe des Antikörpers war nicht mit mehr Toxizität assoziiert.
Literatur
1. Stewart AK et al. ASH 2014, Abstract #79.
2. San Miguel, Lancet Oncol, 2013.
3. Richardson et al. Blood 2014.
4. Dimopoulos MA et al. ASH 2014, Abstract #80.
5. Baz R et al. ASH 2014, Abstract #303.
6. San Miguel JF et al. Lancet 2014; 15: 1195-206.
7. Kaufman JL et al. ASH 2014, Abstract #32.
8. Lacy MQ et al. ASH 2014, Abstract #304.
9. Lokhorst HM et al. ASCO 2014, Abstract #8513.
10. Plesner T et al. ASH 2014, Abstract #84.
11. Martin TG et al. ASCO 2014, Abstract #8532.
12. Martin TG et al. ASH 2014, Abstract #83.
13. Mateos MV et al. ASH 2014, Abstract #178.
14. Shah JJ et al. ASH 2014, Abstract #33.
15. Moreau P et al. ASH 2014, Abstract #176.

Prof. Dr. med. Hartmut Goldschmidt
Sektion Multiples Myelom der Medizinischen Klinik V, Universitätsklinikum Heidelberg, und des Nationalen Centrums für Tumorerkrankungen (NCT) Heidelberg,
Im Neuenheimer Feld 410, 69120 Heidelberg

