Neues zu malignen Lymphomen
ASH 2014
Bezüglich der Lymphome muss man die Jahrestagung der American Society of Hematology (ASH) 2014 eher als einen „ASH der Konsolidierung“ einstufen; es gab zwar keine bahnbrechenden neuen Erkenntnisse, aber nichtsdestotrotz einige sehr interessante Resultate, die kurz- oder mittelfristig die Praxis in der Lymphom-Therapie verändern werden.
Patienten mit Hodgkin-Lymphom, die nach der initialen Therapie rezidivieren oder gar refraktär werden, erhalten in der Regel eine autologe Stammzelltransplantation (ASCT), mit der etwa die Hälfte von ihnen geheilt werden kann. Diese Werte haben sich in den vergangenen 20 Jahren nicht verbessert, aber die Einführung des Immunkonjugats Brentuximab Vedotin hat die Situation für diese schwer zu behandelnden Patienten jüngst weiterhin verbessert: Bei Patienten, die nach einer ASCT rezidiviert oder refraktär sind, ist das Präparat aufgrund seiner bemerkenswerten Wirksamkeit bereits zugelassen. Das Wirkprinzip dieser gezielten Chemotherapie konnte aber nach jahrzehntelangen Versuchen erst kürzlich in die Klinik eingeführt werden (neben Lymphomen bisher auch beim Mammakarzinom): Ein Antikörper bindet an ein möglichst tumorspezifisches Antigen, im Falle von Brentuximab an das CD30-Antigen auf den Reed-Sternberg-Zellen des Hodgkin-Lymphoms. An diesen Antikörper ist mittels eines chemischen Linkers ein starkes Zellgift (bei Brentuximab Vedotin das Spindelgift Monomethyl-Aurostatin E) gekoppelt. Diese Bindung löst sich erst nach Aufnahme des Komplexes in die Tumorzellen, sodass die maligne Zelle von innen zerstört, systemische Wirkung des Toxins aber minimiert wird.
In der Phase-III-Studie AETHERA wurde Brentuximab Vedotin nun randomisiert bei Patienten getestet, die eine ASCT erhalten hatten und trotzdem ein hohes Progressionsrisiko aufwiesen – entweder weil sie bereits auf die Erstlinientherapie refraktär waren, bereits kurz darauf wieder progredient waren oder ein extranodaler Befall der Krankheit vorlag [1]. 329 solche Patienten aus Nordamerika oder Europa erhielten sofort im Anschluss an die Transplantation „Best Supportive Care“ mit oder ohne eine Konsolidierungsbehandlung mit Brentuximab Vedotin bis zu 16 Zyklen, d. h. über etwa ein Jahr .
Nach einer medianen Nachbeobachtung von zwei Jahren, so Craig Moskowitz, New York, war ein hochsignifikanter Unterschied zwischen beiden Armen beim progressionsfreien Überleben nachweisbar: Nur 51% der Patienten im Kontrollarm, aber 63% im Brentuximab-Arm waren zu diesem Zeitpunkt noch progressionsfrei, die Medianwerte lagen bei 24 bzw. 43 Monaten (Hazard Ratio 0,57; p = 0,001). Dieser Vorteil des Antikörper-Konjugats war in allen untersuchten Subgruppen gleichermaßen zu sehen. Die Entwicklung eines Plateaus in den Kurven ab dem zweiten Jahr deutet darauf hin, dass diese Patienten möglicherweise geheilt sind. Damit ist es zum ersten Mal gelungen, durch eine Erhaltungstherapie die Therapieresultate nach ASCT bei einer Lymphom-Entität zu verbessern. Die Überlebenskurven unterscheiden sich bisher noch nicht – vermutlich aufgrund einer Crossover-Option im Studiendesign, d. h. progrediente Patienten im Kontrollarm konnten auch Brentuximab Vedotin erhalten.
Immuntherapien auch bei Lymphomen
Immuncheckpoint-Inhibitoren haben im vergangenen Jahr vor allem bei soliden Tumoren Aufsehen erregt. Das Immunsystem hat bei der zellulären Abwehr „Bremsen“ eingebaut, um der Entstehung von Autoimmunreaktionen vorzubeugen. Einer dieser Mechanismen basiert auf dem Oberflächenrezeptor PD-1 (Programmed Death 1), der sich auf T-Lymphozyten findet und mit Liganden wie PD-L1 interagiert, die von Zellen des entzündlichen Begleitinfiltrats exprimiert werden. Durch die Bindung von PD-1 und PD-L1 wird die Aktivierung immunologischer Effektorzellen gehemmt. Tumorzellen machen sich das zunutze, indem sie selbst PD-L1 exprimieren und auf diesem Weg das Immunsystem inhibieren, weshalb Inhibitoren dieses „Checkpoints“ wie der monoklonale PD-1-Antikörper Nivolumab gewebeübergreifend ein eindrucksvolles Ansprechen in Tumoren von Haut, Lunge, Urogenitalsystem und anderen Organen erzielen.
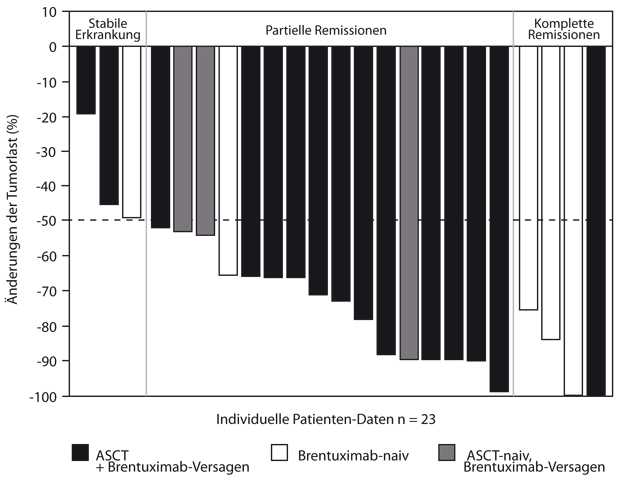
Dieses therapeutische Prinzip ist mittlerweile auch in der Hämatologie angekommen, wo sich das Hodgkin-Lymphom ebenfalls durch ein hochgradig entzündliches Microenvironment auszeichnet. Deshalb ist es nicht verwunderlich, dass die Reed-Sternberg-Zellen ebenfalls den Mechanismus der PDL1-Expression nutzen, um sich der Vernichtung durch die Immunabwehr zu entziehen. Ob eine Unterbrechung der Interaktion zwischen PD-1 und seinen Liganden möglicherweise auch diese stark immunologisch getriggerte Erkrankung an ihrer Achillesferse treffen könnte, wurde in einer Phase-I-Studie untersucht, die Philippe Armand, Boston, in San Francisco vorstellte [2]. Bisher 23 extrem stark vorbehandelte Patienten mit rezidiviertem oder refraktärem Hodgkin-Lymphom wurden eingeschlossen, von denen jeweils 19 (83%) zuvor bereits eine autologe Stammzelltransplantation bzw. das Immunkonjugat Brentuximab Vedotin erhalten hatten. Sie bekamen Nivolumab (3 mg/kg) alle zwei Wochen bis zu einer bestätigten Tumorprogression oder bis zum Auftreten inakzeptabler Toxizität. 20 Patienten (87%) erfuhren eine Reduktion der Tumorlast um mindestens 50%, vier davon (17%) eine komplette Remission, die übrigen drei Patienten zeigten zumindest eine Krankheitsstabilisierung (Abb. 1). Diese Remissionen waren lang anhaltend: Nach 24 Monaten waren 86% der Patienten noch progressionsfrei am Leben, der Medianwert der Gesamtüberlebenszeit ist noch nicht erreicht. Ähnliche Daten gab es mit dem zweiten derzeit in Entwicklung befindlichen PD-1-Antikörper Pembrolizumab in einem vergleichbaren Kollektiv in einer Phase-Ib-Studie, wo von 15 Patienten 53% ansprachen, davon 20% mit einer kompletten Remission [3].
Diese Resultate dürften nach der Einführung von Brentuximab Vedotin einen erneuten Durchbruch beim Hodgkin-Lymphom darstellen – so hat auch die Food and Drug Administration Nivolumab in dieser Indikation eine „Breakthrough Designation“ gewährt. Derzeit laufen internationale Phase-II/III-Studien zur weiteren Prüfung von Nivolumab beim Hodgkin-Lymphom, an denen auch die Deutsche Hodgkin-Studiengruppe beteiligt ist.
Follikuläres Lymphom: Über BR zur Chemotherapie-freien Behandlung?
Beim follikulären Lymphom besteht die Standardtherapie derzeit noch in einer Immunchemotherapie mit dem CD20-Antikörper Rituximab; in letzter Zeit setzt sich bei der Chemotherapie gegenüber dem früheren Standard CHOP (Cyclophosphamid, Doxorubicin, Vincristin, Prednison) zunehmend Bendamustin als gut verträgliche Alternative durch. Das geht vor allem auf die Studien der deutschen Studiengruppe indolente Lymphome (StiL) zurück, die Mathias Rummel, Gießen, schon mehrmals bei großen Kongressen vorgestellt hatte. In der First-line-Therapie war Bendamustin-Rituximab (BR) dem klassischen R-CHOP-Schema überlegen gewesen [4], für die Studie zur rezidivierten Situation konnte er in San Francisco die finale Auswertung präsentieren [5]: Die 219 Patienten mit rezidivierten indolenten Lymphomen (davon knapp die Hälfte follikuläre und ungefähr ein Fünftel Mantelzell-Lymphome) erhielten Rituximab und randomisiert entweder Fludarabin oder Bendamustin. Nach der Zulassung von Rituximab für die Erhaltungstherapie 2006 erhielten die verbleibenden Patienten zusätzlich diese Erhaltungstherapie.
Der Studienarm mit Bendamustin schnitt gegenüber dem (allerdings unterdosierten) Fludarabinarm in der Endauswertung durchweg besser ab; das betraf sowohl das Ansprechen mit 82% vs. 49% (p < 0,0001), mit einem Anteil der Komplettremissionen von 39% vs. 16% (p = 0,0004), als auch die progressionsfreie Überlebenszeit (im Median 12,0 vs 34,3 Monate; Hazard Ratio 0,54; p = 0,000064) und das Gesamtüberleben (im Median 49,4 vs 109,7 Monate; HR 0,64; p = 0,012).
44 Patienten erhielten zusätzlich eine Rituximab-Erhaltungstherapie; dieser Vergleich war nicht randomisiert, dennoch war gegenüber den Patienten ohne Erhaltungstherapie ein deutlicher Vorteil sowohl beim progressionsfreien (median 72,4 vs. 30,5 Monate; HR 0,52; p = 0,0083) als auch beim Gesamtüberleben nachweisbar (HR 0,52; p = 0,024). Mit diesen Ergebnissen wurde insbesondere die Wirksamkeit einer Rituximab-Erhaltung nach BR bestätigt; die Toxizität beider Regimes war vergleichbar.
Wie bei der chronischen lymphatischen Leukämie (CLL) stellt sich auch bei den indolenten Lymphomen immer stärker die Frage, ob wir überhaupt noch eine Chemotherapie benötigen. In einer randomisierten Phase-II-Studie der Schweizerischen Arbeitsgemeinschaft für Klinische Krebsforschung (SAKK) und der Nordic Lymphoma Group (NLG), die Eva Kimby, Stockholm, vorstellte, wurde bei mehr als 150 nicht vorbehandelten Patienten mit follikulärem Lymphom in der Primärtherapie die alleinige Rituximab-Gabe mit der Kombination aus Rituximab und dem bisher nur beim multiplen Myelom zugelassenen Immunmodulator Lenalidomid verglichen [6]. Die Ansprechraten lagen in der Kombinationsgruppe nach zweieinhalb Monaten bei 45% vs. 75% und nach knapp sechs Monaten bei 61% vs. 82%, wobei insbesondere die Komplettremissionsrate von 36% im Kombinationsarm nach 23 Wochen bemerkenswert ist (Abb. 2.). Zwar wurden im Kombinationsarm auch mehr Nebenwirkungen beobachtet, trotzdem war die Therapie verträglicher als eine konventionelle Chemotherapie.
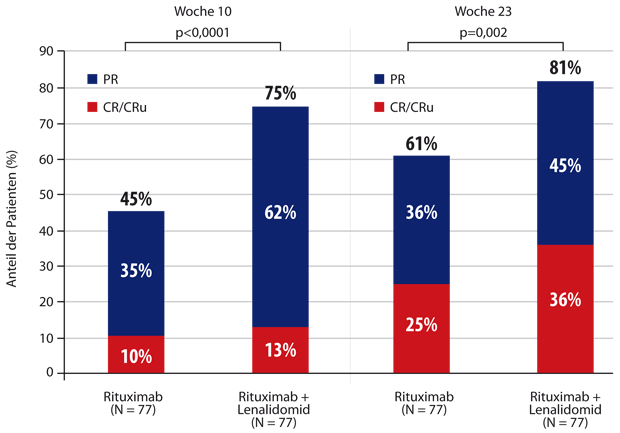
Zur Bewertung dieser Ergebnisse sind zwei Dinge anzumerken: Eine US-amerikanische Phase-II-Studie mit der Rituximab/Lenalidomid-Kombination hat mit einer nahezu 100-prozentigen Ansprechrate (bei 87% Komplettremissionen) hohe Vorgaben gemacht [7]. Dabei handelte es sich allerdings um eine monozentrische Studie aus dem
M. D. Anderson Cancer Center, die zudem eine längere Behandlungsdauer von bis zu zwölf Monaten vorsah. Die Ergebnisse der randomisierten, internationalen, multizentrischen Studie aus der Schweiz und Skandinavien stellt eine eindrucksvolle Bestätigung der Resultate aus Texas dar. Entscheidend für die Bewertung dieser Therapieoption wird aber sein, wie lange diese Remissionen anhalten und ob sie zu einer substanziellen Verbesserung auch der Überlebensdaten führen. Im Übrigen spielt eine Rituximab-Monotherapie zumindest in Europa in der Primärtherapie beim fortgeschrittenen follikulären Lymphom nur eine untergeordnete Rolle [8]. Deshalb wird man, ehe man die Rolle dieser Kombination endgültig einordnen kann, die Ergebnisse einer großen weltweiten Phase-III-Studie abwarten müssen, deren Rekrutierung inzwischen abgeschlossen ist und in der Rituximab/Lenalidomid mit einer Immunchemotherapie verglichen wird.
Rituximab-Erhaltung beim Mantelzell-Lymphom
Beim Mantelzell-Lymphom sieht die deutsche DGHO-Leitlinie [9] für junge (≤ 65 Jahre) und fitte Patienten eine dosisintensivierte Immunchemotherapie vor, die gefolgt wird von einer autologen Stammzelltransplantation, während weniger fitte (ECOG ≥ 3) junge ebenso wie ältere Patienten eine Standard-Immunchemotherapie gefolgt von einer Rituximab-Erhaltung erhalten sollen. Die naheliegende Frage, ob es Sinn macht, bei den jungen Patienten Hochdosis- und Erhaltungstherapie zu kombinieren, haben die Kollegen der französischen Lysa-Gruppe in ihrer LyMa-Studie untersucht [10]. 299 Patienten erhielten zunächst eine konventionelle Immunchemotherapie (R-DHAP) sowie eine Hochdosistherapie (Rituximab plus BEAM) und wurden dann, sofern sie mindestens in partieller Remission waren, randomisiert, entweder nur weiter beobachtet zu werden oder zusätzlich drei Jahre lang alle zwei Monate eine Dosis Rituximab zur Erhaltung zu bekommen.
Die erste Interimsanalyse nach median dreijähriger Nachbeobachtung, die Steven Le Gouill, Nantes, in San Francisco präsentieren konnte, ist beeindruckend: Die Werte für das ereignisfreie (Tab. 1) und das progressionsfreie Überleben trennen sich schon relativ früh, und der Unterschied zwischen den Kurven ist beträchtlich, während sich beim Gesamtüberleben noch kein Unterschied zeigt. Wenn diese Unterschiede nach längerer Nachbeobachtung bestehen bleiben, wird die wenig toxische Rituximab-Erhaltungstherapie auch nach der Stammzelltransplantation zum Standard werden, selbst wenn man sagen muss, dass Rituximab beim Mantelzell-Lymphom keine Zulassung hat – aufgrund des überzeugenden Vorteils im Gesamtüberleben wird es aber vom medizinischen Dienst der Krankenkassen in Kombination mit dem CHOP-Regime allgemein akzeptiert [11].
PET beim DLBCL: Kein Erfolg bei Therapiesteuerung
Der prädiktive Nutzen der 18-Fluordeoxyglukose-Positronenemissionstomografie (18FDG-PET), bei aggressiven Non-Hodgkin-Lymphomen nach wenigen Zyklen und zum Abschluss einer Immunchemotherapie durchgeführt, ist bisher nicht zweifelsfrei im Rahmen der aktuellen Lugano-Kriterien international etabliert [12]. Dagegen beruhen die widersprüchlichen Studienergebnisse, was die Vorhersage des Therapieerfolgs durch ein Interims-PET angeht, vermutlich auf Unterschieden in den Studiendesigns. Zu der Frage, ob Patienten, bei denen ein Interims-PET ein ungünstiges Ansprechen auf die Therapie anzeigt, von einer Änderung der Behandlungsstrategie profitieren, gab es bisher keine randomisierten Untersuchungen. Das hat eine deutsche Studiengruppe unter Leitung von Ulrich Dührsen, Essen, nun mit der PETAL-Studie in Angriff genommen [13]. Die Patienten erhielten zunächst zwei Zyklen einer normalen R-CHOP-Therapie und darauf ein Interims-PET. Fiel dieses günstig aus (> 66% Abnahme des „Standard Uptake Value“ (SUV)), wurden die Patienten randomisiert, weitere vier Zyklen R-CHOP alleine oder zusätzlich mit zwei weiteren Dosen Rituximab zu erhalten. Patienten mit einem ungünstigen Interims-PET hingegen wurden randomisiert, sechs weitere Zyklen R-CHOP oder sechs Zyklen eines des intensiveren B-ALL Protokolls zu bekommen, das gute Resultate bei Burkitt- und anderen hochaggressiven Lymphomen erzielt hat und unter anderem hyperfraktionierte Alkylanzien und hochdosiertes Methotrexat und Cytarabin enthielt.
Das Ergebnis war enttäuschend: Patienten mit positivem und negativem PET unterschieden sich zwar deutlich und hochsignifikant hinsichtlich Zeit bis zum Therapieversagen und Gesamtüberleben, aber die Therapieänderungen hatten in keiner der beiden pro-gnostischen Gruppen einen signifikanten Einfluss; in der Gruppe mit positivem Interims-PET schien die herkömmliche R-CHOP-Behandlung sogar tendenziell günstiger zu sein als die intensivierte Therapie.
Selbst wenn mit dem PET Hochrisiko-Patienten identifiziert werden können, lassen sich daraus also bisher noch keine chemotherapeutischen Konsequenzen ableiten. Das ist sicherlich ein Szenario, in dem die neuen molekularen Substanzen im Rahmen von kon-trollierten Studien gestestet werden sollten.
Literatur
1. Moskowitz CH et al. ASH 2014, Abstract #673.
2. Armand P et al. ASH 2014, Abstract #289.
3. Moskowitz CH et al. ASH 2014, Abstract #290.
4. Rummel MJ et al. Lancet 2013; 381: 1203-10.
5. Rummel MJ et al. ASH 2014, Abstract #145.
6. Kimby E et al. ASH 2014, Abstract #799.
7. Fowler N et al. Lancet Oncology 2014; 15: 1311-8.
8. Dreyling M et al. Ann Oncol 2014; 25 (Suppl 3): iii76-iii82.
9. Dreyling M et al. www.dgho-onkopedia.de/de/onkopedia/leitlinien/mantelzell-lymphom.
10. Le Gouill S et al. ASH 2014, Abstract #146.
11. Kluin-Nelemans HCet al. N Engl J Med. 2012; 367: 520-31.
12. Cheson BD et al. J Clin Oncol. 2014; 32: 3059-68.
13. Duehrsen U et al. ASH 2014, Abstract #391.

Prof. Dr. Martin Dreyling
Medizinische Klinik und Poliklinik III
Klinikum der Universität München
Marchioninistraße 15, 81377 München

