Retroperitoneale Weichteilsarkome: chirurgisches Vorgehen
Paolo Girotti, Jens Rolinger, Alfred Königsrainer, Ruth Ladurner
Hintergrund
Das Retroperitoneum ist ein „virtueller“ anatomischer Raum zwischen der Muskulatur dorsal und dem Darmpaket ventral. Es kann Sitz multipler histopathologisch benigner oder maligner Tumoren sein, die entweder ihren Ursprung von den retroperitonealen Strukturen genommen haben oder Metastasen von Tumoren anderer Lokalisation sind.
Die Gruppe der Weichteiltumoren ist eine sehr heterogene Familie, was die Altersverteilung, die Histologie und die Prognose betrifft: Circa 50 histopathologisch unterschiedliche Typen können in zwei große Klassen von Sarkomen eingeteilt werden: Weichteilsarkome und ossäre Sarkome. Für die Entstehung dieser Neoplasien wurden keine spezifischen Risikofaktoren identifiziert, und in 90% der Fälle treten Sarkome sporadisch auf.
Gutartige Läsionen im Retroperitoneum machen weniger als 5% aus, während Sarkome circa 30–40 % aller retroperitoneal diagnostizierten Weichteiltumoren darstellen. Vermutlich wird die wirkliche Inzidenz dieser Tumoren unterschätzt. Sarkome stellen circa 1% aller maligner Neoplasien im Erwachsenenalter dar, und die retroperitonealen Sarkome machen ca. 0,2–0,3% aus. In England werden etwa 3.000 Sarkome pro Jahr neu diagnostiziert. Davon sind nur 15% retroperitoneal lokalisiert; allerdings werden viele Läsionen nicht korrekt diagnostiziert [1–3].
Die chirurgische Therapie retroperitonealer Tumoren stellt eine echte Herausforderung dar und ist extrem komplex und heterogen, wobei folgende Punkte bei der Wahl des richtigen chirurgischen Vorgehens zu berücksichtigen sind:
• Diagnosezeitpunkt,
• Lokalisation bzw. anatomischer Sitz,
• Histopathologie,
• Erstmanifestation oder Rezidiv.
Diagnosezeitpunkt
Aufgrund der Unzugänglichkeit des retroperitonealen Raumes wird die Diagnose eines Sarkoms entweder zufällig gestellt oder erst bei Auftreten von Symptomen durch Kompression und sehr spät durch das große Ausmaß des raumfordernden Prozesses, was eine radikale Resektion erschwert.
Lokalisation bzw. anatomischer Sitz
Das Retroperitoneum ist ein komplexer „virtueller“ Raum zwischen multiplen vitalen Strukturen, begrenzt
1. vorne vom Mesocolon und dem entsprechenden Hemicolon, dem Magen und Duodenum,
2. hinten durch die dorsale Muskulatur (M. quadratus lumborum, M. transversus abdominis, M. iliacus, M. psoas, paravertebrale Muskulatur) und die Wirbelsäule sowie
3. oben durch das Diaphragma, die Milz und die Leber.
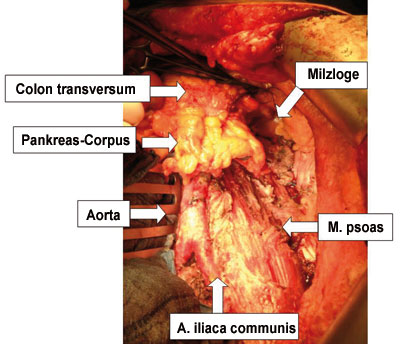
Darüber hinaus beinhaltet das Retroperitoneum Organe und Gefäße: das Pankreas, Nieren und Ureteren, den Samenstrang, die Vena cava inferior und die Aorta abdominalis. Diese Strukturen sind in einen Fettmantel eingehüllt, der sie stützt und von den anderen Organen und von den großen arteriellen und venösen Gefäßen trennt [4, 5].
Histopathologie
Bei den retroperitonealen Sarkomen dominieren Liposarkome (80%) und Leiomyosarkome (20%). Weniger häufig auftretende Histologien sind: lymphoproliferative Erkrankungen (Hodgkin- und Non-Hodgkin-Lymphome), epitheliale Tumoren (Niere, Nebenniere, Pankreas) und sekundäre Absiedelungen (von Keimstrangtumoren, von anderen Karzinomen oder Melanomen, [1]).
Was die chirurgische Therapie betrifft, ist die genaue Zuteilung zu den häufigsten histologischen Formen retroperitonealer Sarkome, Lipo- oder Leiomyosarkom, essentiell, um das für den histologischen Typ optimale Vorgehen zu wählen [6].
Erstmanifestation oder Rezidiv
Die chirurgische Therapie ist unterschiedlich, je nachdem ob es sich um die primäre Manifestation oder um das Lokalrezidiv eines retroperitonealen Sarkoms handelt. Das Lokalrezidiv ist im Grunde der wichtigste negative prognostische Faktor. Umso wichtiger ist bereits die Wahl der interdisziplinären und chirurgischen Strategie bei der Erstmanifestation, um das Risiko eines Lokalrezidivs zu vermeiden [4, 5, 7–10].
Radikale versus marginale Resektion
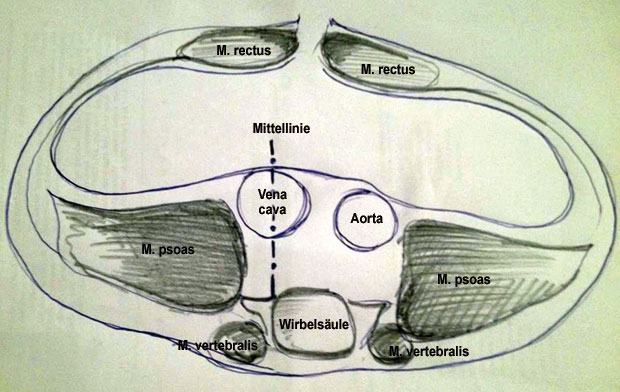
Von chirurgischer Seite ist es essenziell, das retroperitoneale Kompartiment in ein rechtes und ein linkes einzuteilen. Die Grenze in der Mitte stellt definitionsgemäß die Vena cava inferior dar, wodurch neoplastische retroperitoneale Läsionen entweder unilateral oder bilateral lokalisiert sein können, mit der Konsequenz eines unterschiedlichen chirurgischen Vorgehens (Abb.1, [1, 5, 7]).
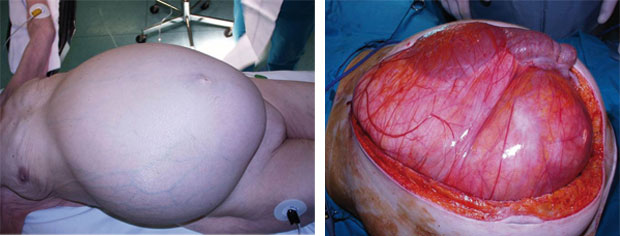
Unterschieden werden muss eine aggressive, chirurgisch radikale Resektion von einer marginalen Resektion. Sieht man allerdings oft das Ausmaß retroperitonealer Sarkome (Abb. 2), dann relativiert sich die Indikation zur aggressiven Chirurgie und die Resektion kann von vorneherein nur „marginal“ sein. Die aggressive Chirurgie umfasst en-bloc-Resektionen des Sarkoms mit anliegenden viszeralen Organen; je nachdem, ob das Sarkom im rechten oder linken Kompartiment lokalisiert ist, sind dies die rechte Niere, Teile der Leber, der Bauchspeicheldrüsen-Kopf, das rechte Hemicolon oder der Magen, die Milz, der Pankreasschwanz, die linke Niere und das linke Hemicolon (Abb. 3). Lokal wird auch Peritoneum entfernt und Muskulatur des M. psoas oder iliacus oder es werden Gefäße (Aorta, Vena cava inferior) ersetzt und Knochen reseziert (z. B. Wirbelkörper, Beckenschaufel). Die marginale Chirurgie orientiert sich an der in der Regel vorhandenen Tumorkapsel. Aber:
• Wann ist die sogenannte radikale Chirurgie des Kompartiments gerechtfertigt?
• Welche Rolle spielt die Chirurgie in Abhängigkeit vom histologischen Typ und im Fall eines Rezidivs?
Wann radikale Chirurgie des Kompartiments?
Die postoperative Gesamtmorbidität (größere Komplikationen der Klasse III–V nach Dindo-Clavien, [11]) im Falle einer radikalen multiviszeralen Resektion wird mit circa 30% angegeben [1–5, 7], die perioperative Mortalität mit 3% und Reoperationen sind in circa 18–20% der Fälle notwendig. Bei Patienten mit einem Lokalrezidiv sieht man bei einem aggressiven chirurgischen Vorgehen sogar eine Zunahme der Früh- und Spätkomplikationen auf bis zu 50% der Fälle. Diese Ergebnisse, die Morbidität betreffend, wurden in einem einzelnen Zentrum mit sehr großer Erfahrung in der chirurgischen Therapie retroperitonealer Sarkome publiziert. In anderen Fallberichten aus Zentren mit geringerer Expertise werden die Komplikationsraten ähnlich angegeben, aber vermutlich ziemlich unterschätzt [12, 13].
Sieht man die chirurgischen Risiken einer multiviszeralen Resektion, muss man sich bei einer aggressiven chirurgischen Therapie folgende Fragen stellen:
• Kann durch das aggressive chirurgische Vorgehen auf lange Sicht auch bei einer tolerablen Minderfunktion der verbliebenen Organe (z. B. unter anderem reduzierte Nierenfunktion bei einseitiger Nephrektomie) eine gute Lebensqualität aufrechterhalten bleiben?
• Nimmt durch die Aggressivität der Chirurgie das onkologische Langzeitüberleben auch tatsächlich zu?
Analysiert man die Literatur zur postoperativen Lebensqualität von Patienten mit retroperitonealen Sarkomen, so scheint sich kein Autor mit dem Thema richtig befasst zu haben, und auch bei den größeren chirurgischen Fallserien findet man kaum Daten dazu. Nur Davis et al. [14] haben im Falle von Sarkomen an den Extremitäten eine Verbesserung des funktionellen Ergebnisses nach Extremitäten-erhaltenden und nicht radikal resezierenden Eingriffen bzw. Amputationen in Kombination mit einer neoadjuvanten Radiotherapie publiziert. Diese Daten können allerdings nicht für die retroperitonealen Sarkome übernommen werden, wo eine multiviszerale chirurgisch radikale Therapie im Prinzip die Funktion mehrerer Organe beeinträchtigen kann und eine ausgedehnte präoperative Radiotherapie vor allem aufgrund der Größe der Sarkome und ihrer Lage nicht immer möglich ist. Andererseits kann eine en-bloc-Resektion in Kombination mit der Entfernung von retroperitonealer Muskulatur, Sehnen und Nerven auch mit einer postoperativen Einschränkung der Beweglichkeit bzw. einer Behinderung auf lange Sicht verbunden sein. Als weiteres Beispiel kann die einseitige Nephrektomie in Kombination mit einer zumeist nephrotoxischen neoadjuvanten Chemotherapie den Patienten in eine terminale Niereninsuffizienz führen.
Wichtig ist zu bedenken, ob die Prognose des Patienten nach radikalen multiviszeralen Eingriffen im Vergleich zu marginalen Resektionen sich verbessert. Anaya et al. berichten über ein 5-Jahres-Überleben von 65% mit einer Rate von 22% Lokalrezidiven bei Patienten nach radikalen multiviszeralen Eingriffen [15]; diese Daten scheinen bei Weitem besser als die bisher publizierten zu sein, sind aber sehr inhomogen und beinhalten Erstmanifestationen ebenso wie Lokalrezidive, die an und für sich schon eine schlechtere Prognose haben, hochdifferenzierte Sarkome, die eine 5-Jahres-Überlebensrate von 90% haben, und ebenso gering differenzierte Tumoren [2, 5, 16].
Andere Autoren haben das Überleben besser definiert, und zwar in Abhängigkeit von der Histologie: Pawlik et al. geben 5-Jahres-Überlebensraten von 61% im Falle von mäßig bis hochdifferenzierten Sarkomen an [17] und Lehnert et al. eine rezidivfreie Überlebensrate von 59% bei Patienten mit denselben Differenzierungsgraden sowohl nach chirurgisch radikaler Therapie des Primärtumors als auch nach radikaler Therapie des Rezidivs [10]. Angesichts dieser Ergebnisse scheint das Risiko einer erhöhten perioperativen Morbidität und einer Reduktion der Lebensqualität mit Blick auf ein längeres rezidivfreies und Gesamtüberleben gerechtfertigt [8, 10, 15, 18, 19].
Warum verlängert die multiviszerale chirurgische Therapie das Langzeitüberleben der Patienten? Multiviszerale Resektionen ermöglichen in den meisten Fällen tumorfreie Resektionsränder, und dieser Parameter scheint der einzige Faktor zu sein, der das Gesamtüberleben und das rezidivfreie Überleben statistisch signifikant verlängert [7, 10, 12, 17, 20–22]. Auch die Expertise des Chirurgen ist ein entscheidender prognostischer Faktor, was die Verhinderung peri- bzw. postoperativer Komplikationen einerseits und die Chance auf Erreichen einer R0-Resektion andererseits betrifft [20–22].
Was aber ein ausreichender Sicherheitsabstand und somit eine R0-Resektion ist, ist nach wie vor Thema unzähliger Diskussionen, die bisher noch zu keinem Konsens geführt haben [23, 24]. Ziel ist es, zumindest mikroskopisch Tumorfreiheit zu erreichen. Allerdings gibt es bisher keine standardisierten Leitlinien oder objektive Methoden, um Tumorfreiheit zu definieren bzw. nachzuweisen, nicht zuletzt auch, weil der Durchmesser retroperitonealer Sarkome im Median etwa 10 cm beträgt (Abb.3, [7, 12, 13, 19, 22]).
Aufgrund der Schwierigkeit der Definition eines mikroskopisch tumorfreien Randes haben sich viele Autoren auf makroskopische Tumorfreiheit konzentriert. Es stellt sich allerdings die Frage, ob mikroskopische Tumorzellen am Resektionsrand (histologisch R1) und makroskopische Tumorfreiheit und somit „chirurgische“ R0-Resektion ein negativer prognostischer Faktor sind. Singer et al. [5] zeigen, dass lediglich makroskopisch sichtbarer Tumor am Resektionsrand (R2-Situation) mit einem höheren Risiko eines Lokalrezidivs und somit mit einem schlechteren Langzeitüberleben verbunden ist. Die Betrachtung in dieser Studie ist jedoch einseitig aufgrund der Tatsache, dass die Definition des mikroskopisch tumorfreien Resektionsrandes nicht standardisiert ist bzw. aufgrund der in der Regel großen Tumordurchmesser und der natürlichen anatomischen Grenzen nicht standardisiert werden kann. Es erscheint aber klar, dass die technische Erfahrung des Chirurgen die en-bloc-Resektion von Organen auf ein Minimum reduziert, um eine R0-Situation zu erreichen. Das Risiko für postoperative Komplikationen wird dadurch reduziert und ein besseres Langzeitüberleben ermöglicht.
Chirurgie in Abhängigkeit vom histologischen Typ und im Rezidiv?
Die Rolle eines aggressiven chirurgischen Vorgehens für eine bessere Prognose ist in der Therapie retroperitonealer Sarkome mittlerweile bei Erstmanifestationen oder ersten lokalen Rezidiven evident. Dem gegenüber stehen lokale chirurgische Verfahren, die mit einer hohen Rate an R2-Resektionen verbunden sind und somit ein höheres Risiko für die Entstehung lokaler Sarkom-Rezidive haben. Nicht klar ist allerdings, ob diese Ergebnisse unabhängig vom histopathologischen Typ des Sarkoms und auch bei der aggressiven Therapie von Rezidiven zu sehen sind. Sicherlich haben die zwei führenden histopathologischen Sarkome, das Lipo- und das Leiomyosarkom, ein unterschiedliches biologisches Verhalten, was das Auftreten von Lokalrezidiven und das Potenzial zur Fernmetastasierung betrifft.
Dabei können verschiedene Situationen unterschieden werden, und zwar in Abhängigkeit von der histopathologischen Differenzierung und von der Manifestation:
• Erstmanifestation eines hoch-/mittelgradig differenzierten Liposarkoms,
• Erstmanifestation eines gering differenzierten Liposarkoms,
• Lokalrezidiv eines Liposarkoms,
• Erstmanifestation eines Leiomyosarkoms,
• Lokales Rezidiv und Fernmetastasierung von Leiomyosarkomen.
Erstmanifestation eines hoch-/mittelgradig differenzierten Liposarkoms
Erstmanifestationen von gut differenzierten Liposarkomen neigen zum Auftreten von lokalen Rezidiven, haben aber eine geringe Tendenz zum Auftreten hämatogener Fernmetastasen. Verschiedene Autoren haben gezeigt, dass bei solchen histologischen Typen, wenn sie durch eine multiviszerale Therapie reseziert werden, das Risiko für die Entwicklung eines Lokalrezidivs innerhalb von 5 Jahren < 20% ist [8] im Vergleich zu einem Risiko von 30–40 % bei Patienten, die nur marginal reseziert wurden [8, 10, 15, 18, 19, 26]. Wenn Sarkome in der Bildgebung bilateral oder multifokal sind und die Medianlinie bzw. die Vena cava inferior überschreiten, sind sie meistens gering differenziert und das Risiko für die Entstehung von Lokalrezidiven ist von vorneherein erhöht. In solchen Fällen ist eine eher konservative Chirurgie bzw. die marginale Resektion ausreichend.
Das Problem allerdings ist die radiologisch oft schwierige Einschätzung der Bilateralität bzw. Multifokalität lipomatöser Tumoren. In Fällen, wo die radiologische Diagnostik das Sarkom lediglich einseitig und als eine solitäre Masse beschreibt, muss aus diesem Grund dennoch ein chirurgisch radikales Vorgehen angestrebt werden [8].
Erstmanifestation eines gering differenzierten Liposarkoms
Bei gering differenzierten Sarkomen muss man vor allem das Risiko eines Lokalrezidivs und das der Fernmetastasierung berücksichtigen. Zu unterscheiden sind sie von Sarkomen mit einem mäßigen Risiko für eine Fernmetastasierung (< 10%), die damit wie Sarkome mit einem geringen Risiko zu behandeln sind [1, 5–8, 18–21]. Gering differenzierte Sarkome haben auch nach aggressiven chirurgischen Maßnahmen ein Risiko für ein Lokalrezidiv von > 60% innerhalb von fünf Jahren und ein Fernmetastasierungsrisiko von > 10%. In diesen Hochrisiko-Fällen, die meistens bilateral und multifokal sind, wird nach einer neoadjuvanten Vorbehandlung eine zwar radikale, aber nicht sehr aggressive Chirurgie empfohlen.
Lokalrezidiv eines Liposarkoms
Im Hinblick auf ein neuerliches chirurgisches Vorgehen muss berücksichtigt werden, ob es sich um ein multifokales Geschehen handelt und ob das Rezidiv innerhalb des ersten Jahres nach Operation des Primärtumors aufgetreten ist. In solchen Fällen ist ein chirurgisches Vorgehen nicht sinnvoll, weil diese Sarkome in der Regel dedifferenziert sind und häufig zur Infiltration abdomineller Strukturen neigen, was die Aussicht auf eine neuerliche R0-Resektion verringert. Umgekehrt, wenn das Rezidiv unifokal und das tumorfreie Überleben länger als ein Jahr ist, kann man erneut an ein radikal chirurgisches Vorgehen denken.
Leiomyosarkom-Primärmanifestation
Handelt es sich bei dem Weichteilsarkom um die Erstmanifestation eines Leiomyosarkoms, beträgt das Risiko einer hämatogenen Fernmetastasierung > 50%. Eine ausgedehnte Resektion erlaubt zwar eine bessere lokale Tumorkontrolle mit einem lokalen tumorfreien Überleben von 95% nach fünf Jahren, aber ausgedehnte chirurgische Maßnahmen haben keinen Einfluss auf die Entstehung von Fernmetastasen. Deshalb muss das chirurgische Vorgehen beim Primärtumor stets mit einer neoadjuvanten oder adjuvanten Chemotherapie verbunden werden, um das Risiko von Metastasen zu reduzieren. Aufgrund des geringen Lokalrezidiv-Risikos ist auch eine geringere chirurgische Aggressivität anzustreben.
Leiomyosarkomrezidiv bzw. -metastasen
Rezidive eines Leiomyosarkoms sind selten lokal, aber häufig distant. Die Rolle der Chirurgie bei der Behandlung der Leiomyosarkom-Rezidive, lokal und distant, ist bisher noch nicht ganz klar, vor allem, weil bei Auftreten von Lokalrezidiven häufig auch bereits Fernmetastasen vorhanden sind. Im Moment wird die Indikation zum chirurgischen Vorgehen zurückhaltend gestellt. Randomisierte Studien, die die Rolle der Chirurgie mit der der Chemotherapie vergleichen, stehen aktuell noch aus [8, 10, 21, 22].
Literatur
1. Van Roggen JF, Hogendoorn PC. Soft-tissue tumours of the retroperitoneum. Sarcoma 2000; 4: 17-26.
2. Jemal A et al. Cancer statistics, 2007. CA Cancer J Clin 2007; 57: 43-66.
3. Singer S, Maki RG, O´Sullivan B. Soft-tissue Sarcomas. In: Cancer: Principles and Practice of Oncology. 9th ed. Philadelphia: Lippincott Williams end Wilkins; 2011; p. 1533-77.
4. Bonvalot S et al. Technical considerations in surgery for retroperitoneal sarcomas: Position paper from E-Surge, a master class in sarcoma surgery, and EORTC-STBSG. Ann Surg Oncol 2012; 19: 2981-91.
5. Raut CP, Swallow CJ. Are radical compartmental resections for retroperitoneal sarcomas justified? Ann Surg Oncol 2010; 17: 1481-4.
6. Gronchi A et al. Personalizing the approach to retroperitoneal soft-tissue sarcoma: Histology-specific patterns of failure and post-relapse outcome after primary extended resection. Ann Surg Oncol 2014, Oct 10 [Epub ahead of print, DOI 10.1245/s10434-014-4130-7].
7. Neuhaus SJ et al. Surgical management of primary and recurrent retroperitoneal liposarcoma. Br J Surg 2005; 92: 246-52.
8. Gronchi A et al. Outcome prediction in primary resected retroperitoneal soft-tissue sarcoma: Histology-specific overall survival and disease-free survival nomograms built on major sarcoma center data sets. J Clin Oncol 2013; 31: 1649-55.
9. Anaya DA et al. Establishing prognosis in retroperitoneal sarcoma: A new histology-based paradigm. Ann Surg Oncol 2009; 16: 667-75.
10. Lehnert T et al. Primary and locally recurrent retroperitoneal soft-tissue sarcoma: Local control and survival. Eur J Surg Oncol 2009; 35: 986-93.
11. Dindo D et al. Classification of surgical complications: A new proposal with evaluation in a cohort of 6336 patients and results of a survey. Ann Surg 2004; 240: 205-13.
12. Gutierrez JC et al. Should soft-tissue sarcomas be treated at high-volume centers? An analysis of 4205 patients. Ann Surg 2007; 245: 952-8.
13. Gutierrez JC et al. Outcomes for soft-tissue sarcoma in 8249 cases from a large state cancer registry. J Surg Res 2007; 141: 105-14.
14. Davis AM et al.; Canadian Sarcoma Group; NCI Canada Clinical Trial Group Randomized Trial. Late radiation morbidity following randomization to preoperative versus postoperative radiotherapy in extremity soft-tissue sarcoma. Radiother Oncol 2005; 75: 48-53.
15. Anaya DA et al. Multifocality in retroperitoneal sarcoma: A prognostic factor critical to surgical decision-making. Ann Surg 2009; 249: 137-42.
16. Ballo MT et al. Retroperitoneal soft-tissue sarcoma: An analysis of radiation and surgical treatment. Int J Radiat Oncol Biol Phys 2007; 67: 158-63.
17. Pawlik TM et al. Long-term results of two prospective trials of preoperative external beam radiotherapy for localized intermediate- or high-grade retroperitoneal soft-tissue sarcoma. Ann Surg Oncol 2006; 13: 508-17.
18. Strauss DC et al. Surgical management of primary retroperitoneal sarcoma. Br J Surg 2010; 97: 698-706.
19. Stoeckle E et al.; French Federation of Cancer Centers Sarcoma Group. Prognostic factors in retroperitoneal sarcoma: A multivariate analysis of a series of 165 patients of the French Cancer Center Federation Sarcoma Group. Cancer 2001; 92: 359-68.
20. Bonvalot S et al. Primary retroperitoneal sarcomas: A multivariate analysis of surgical factors associated with local control. J Clin Oncol 2009; 27: 31-7.
21. Gronchi A et al. Resection of uninvolved adjacent organs can be part of surgery for retroperitoneal soft tissue sarcoma. J Clin Oncol 2009; 27: 2106-7.
22. Gronchi A et al. Aggressive surgical policies in a retrospectively reviewed single-institution case series of retroperitoneal soft-tissue sarcoma patients. J Clin Oncol 2009; 27: 24-30.
23. Gerrand CH et al. Classification of positive margins after resection of soft-tissue sarcoma of the limb predicts the risk of local recurrence. J Bone Joint Surg Br 2001; 83: 1149-55.
24. Sampo M et al. Impact of the smallest surgical margin on local control in soft-tissue sarcoma. Br J Surg 2008; 95: 237-43.
25. Singer S et al. Histologic subtype and margin of resection predict pattern of recurrence and survival for retroperitoneal liposarcoma. Ann Surg 2003; 238: 358-70; discussion 370-1.
26. Dalal KM et al. Subtype-specific prognostic nomogram for patients with primary liposarcoma of the retroperitoneum, extremity, or trunk. Ann Surg 2006; 244: 381-393.
Jens Rolinger
Prof. Dr. med. Alfred Königsrainer
Korrespondierende Autoren:
Dr. med. Paolo Girotti
p.gir88@libero.it

PD Dr. med. Ruth Ladurner
Klinik für Allgemeine, Viszeral- und
Transplantationschirurgie
Eberhard-Karls Universität Tübingen
Hoppe-Seyler-Str. 3, 72076 Tübingen