Molekulargenetische Untersuchungen beim fortgeschrittenen nicht-kleinzelligen Lungenkarzinom
Frank Griesinger
Die personalisierte Behandlung ist für Patienten mit NSCLC heute bereits Realität: Ein routinemäßiges Screening aller neu diagnostizierten Patienten, das Mutationen im EGFR-Gen und Fusionsereignissen im Zusammenhang mit dem ALK- und dem ROS1-Gen in den Tumorzellen aufdeckt, gestattet es, Patienten mit diesen Aberrationen anstelle einer herkömmlichen Chemotherapie eine individuelle, speziell auf die molekularen Eigenschaften ihres Tumors wirkende Therapie zukommen zu lassen.
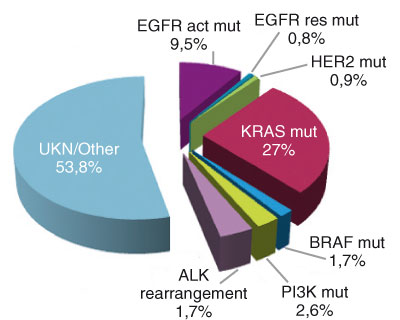
Nicht-kleinzellige Lungenkarzinome (NSCLC), insbesondere Adenokarzinome sind genetisch sehr instabile Tumoren mit starker genetischer Heterogenität. Bei einem erheblichen Anteil der Tumoren können Treibermutationen identifiziert werden, die ursächlich für das maligne Wachstum sind (Abb. 1, [1]). Für einige wenige dieser Treibermutationen existieren auch bereits Hemmstoffe, die den Patienten zumindest ein längeres progressionsfreies, in einigen Fälle auch ein längeres Gesamtüberleben ermöglichen. Die entsprechenden molekulargenetischen Veränderungen haben damit prädiktive Bedeutung, und man sollte bereits bei der Erstdiagnose nach ihnen suchen, um die Anwendung der hier infrage kommenden Medikamente zu ermöglichen.
Es gibt derzeit zwei Arten von Therapien, deren Wirksamkeit mit diesen Markern vorhergesagt werden kann: zum einen aktivierende Mutationen des Rezeptors für epidermalen Wachstumsfaktor (EGFR), zum anderen Translokationen, die das Gen für die anaplastische Lymphomkinase (ALK) bzw. das ROS1-Gen betreffen. In einer deutsch-österreichischen Expertengruppe haben wir kürzlich die aktuellen Erkenntnisse hierzu zusammengefasst und insbesondere ihre praktische Relevanz bewertet [2]. Diese Bewertungen decken sich weitgehend mit einer Leitlinie mehrerer US-amerikanischer und internationaler Fachgesellschaften, der sich auch die American Society of Clinical Oncology (ASCO) in einer jüngst erschienenen Publikation angeschlossen hat [3].
Zur Frage, welche Patienten zu welchem Zeitpunkt getestet werden sollten, besagen unsere deutschen Praxisempfehlungen Folgendes:
- Am Anfang steht wie gehabt die histologisch-pathologische Beurteilung. Bei Patienten mit einem metastasierten NSCLC, das histologisch kein Plattenepithelkarzinom ist, ist ein stufenweises Vorgehen sinnvoll: Zunächst sollte unabhängig von der ethnischen Herkunft und dem Raucherstatus eine EGFR-Mutationsanalyse erfolgen. Fällt sie negativ aus, so sollte man nach ALK-Rearrangements suchen. Bringt dies ebenfalls keine positiven Ergebnisse, wird die Suche nach ROS1-Translokationen empfohlen. Diese Untersuchungen sollten bereits im Rahmen der primären diagnostischen Aufarbeitung an Tumormaterial erfolgen. Das gleiche Procedere gilt für Patienten mit Plattenepithelkarzinomen, die nie geraucht haben bzw. vor mindestens 15 Jahren einen leichten Nikotinabusus hatten (weniger als zehn Pack-years).
- Die molekulargenetische Analyse sollte auf jeden Fall in einem Labor durchgeführt werden, das in einem Ringversuch der Deutschen Gesellschaft für Pathologie dafür zertifiziert wurde. Bei der Erstdiagnose und der Biopsie-Gewinnung muss man darauf achten, ausreichend Tumormaterial zu gewinnen, mit dem man wiederum im Pathologie-Labor möglichst sparsam umgehen sollte, um so viele molekulare Tests wie möglich durchführen zu können.
Die Ergebnisse dieser Tests können erhebliche Konsequenzen für die betroffenen Patienten haben:
- Patienten, deren Tumor eine aktivierende EGFR-Mutation trägt, haben deutliche Vorteile von der Behandlung mit einem EGFR-Tyrosinkinaseinhibitor (TKI, Gefitinib, Erlotinib oder Afatinib): Diese Substanzen verursachen nicht nur wesentlich weniger Toxizität als eine Chemotherapie, sondern ermöglichen auch höhere Ansprechraten, ein längeres progressionsfreies Überleben sowie eine Verbesserung der Lebensqualität und der Symptomkontrolle [4–13]. In den übrigen Studien konnte der formale Beweis dafür nicht erbracht werden – Grund dafür ist vermutlich, dass in den betreffenden Studien zwischen 64% und 95% der Patienten in den Kontrollarmen die Möglichkeiten des Crossover-Designs dieser Studien ausgenutzt hatten und nach Progression auf den jeweiligen EGFR-TKI umgestellt worden waren. Zumindest in der Subgruppe von Patienten mit Adenokarzinomen und einer Deletion des Exons 19 bzw. einer Punktmutation L858R im Exon 21 des EGFR-Gens konnte für den Pan-ErbB-Inhibitor Afatinib sogar eine Verlängerung des Gesamtüberlebens nachgewiesen werden [14], sodass diese Patienten in der Erstlinie vorzugsweise damit behandelt werden sollten. Auch mit einem Cross-over nach Chemotherapie zu einem TKI konnte der Nachteil einer primären Chemotherapie nicht kompensiert werden.
- Der EGFR-TKI sollte bei diesen Patienten vorzugsweise in der Erstlinientherapie gegeben werden. Patienten mit einer aktivierenden L858R-Punktmutation im EGFR-Gen profitieren aber auch in der Erstlinientherapie quoad Ansprechen, Lebensqualität, Symptomkontrolle, geringerer Toxizität von der TKI-Therapie in der Erstlinie. Entscheidend ist, dass Patienten mit solchen Mutationen im Verlauf der Erkrankung auf jeden Fall mit einem TKI behandelt werden.
- Liegen keine aktivierenden EGFR-Mutationen im Tumor vor, so ist eine Therapie mit Erlotinib dennoch in der Zweit- oder Drittlinientherapie indiziert.
- Wurde im zweiten Schritt des beschriebenen molekulargenetischen Diagnostik-Algorithmus bei einem Patienten ein ALK-Rearrangement gefunden und ist der Patient nach der Erstlinientherapie wieder progredient, sollte das Anlass für eine Behandlung mit dem ALK-Inhibitor Crizotinib sein – dafür ist diese Substanz derzeit zugelassen [15, 16]. Auch in der Phase-III-Studie
PROFILE 1007, in der Crizotinib mit einer Zweitlinien-Chemotherapie verglichen wurde, zeigte sich wegen des ausgeprägten Crossovers der Patienten lediglich eine signifikante Verlängerung des progressionsfreien, nicht aber des Gesamtüberlebens [17]. Das Gleiche gilt für Patienten mit ROS1-Rearrangements [17–21]: Sie sollten nach Möglichkeit in klinische Studien eingebracht werden, in denen sich noch offene Fragen zum Umgang mit diesem Mutationen klären lassen. In einer Phase-III-Studie hat Crizotinib mittlerweile auch in der Erstlinie gezeigt, dass es gegenüber einer Chemotherapie aus Pemetrexed und einem Platinsalz das progressionsfreie Überleben verlängert, die symptomatische Verschlechterung hinauszögert und offenbar auch günstig auf Hirnmetastasen wirkt [22], sodass in absehbarer Zeit mit einer Erweiterung der Zulassung auf diese Indikation zu rechnen ist.
Literatur
1. Barlesi F et al. Biomarkers (BM) France: Results of routine EGFR, HER2, KRAS, BRAF, PI3KCA mutations detection and EML4-ALK gene fusion assessment on the first 10,000 non-small cell lung cancer (NSCLC) patients (pts). J Clin Oncol 2013; 31 (15S) (ASCO 2013, Abstract #8000).
2. Sebastian M et al. Molekulargenetische Untersuchungen bei fortgeschrittenem nicht-kleinzelligem Lungenkarzinom: praktische Relevanz. Dtsch Med Wochenschr 2014; 139: 2096-100.
3. Leighl NB et al. Molecular testing for selection of patients with lung cancer for epidermal growth factor receptor and anaplastic lymphoma kinase tyrosine kinase inhibitors: American Society of Clinical Oncology endorsement of the College of American Pathologists/International Association for the Study of Lung Cancer/Association for Molecular Pathology guideline. J Clin Oncol 2014, Oct 20 [prepub ahead of print, DOI 10.1200/JCO.2014.57.3055].
4. Fukuoka M et al. Biomarker analyses and final overall survival results from a phase III, randomized, open-label, first-line study of gefitinib versus carboplatin-paclitaxel in clinically selected patients with advanced nonsmall-cell lung cancer in Asia (IPASS). J Clin Oncol 2011; 29: 2866–74.
5. Han JY et al. First-SIGNAL: first-line single-agent Iressa versus gemcitabine and cisplatin trial in never-smokers with adenocarcinoma of the lung. J Clin Oncol 2012; 30: 1122–8.
6. Maemondo M et al. Gefitinib or chemotherapy for non-smallcell lung cancer with mutated EGFR. N Engl J Med 2010; 362: 2380–8.
7. Mitsudomi T et al. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label randomised phase 3 trial. Lancet Oncol 2010; 11: 121–8.
8. Mok TS et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009; 361: 947–57.
9. Rosell R et al. Erlotinib versus standard chemotherapy as firstline treatment for European patients withadvanced EGFR mutation-positive nonsmall-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2012; 13: 239–46.
10. Sequist LV et al. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013; 31: 3327–34.
11. Wu YL et al. LUX Lung 6: A randomized open label, Phase III study of Afatinib versus Gemcitabine/Cisplatin as first line treatment for Asian patients with EGFR mutation positive advanced adenocarcinoma of the lung. Lancet Oncol 2014; 15: 213–22.
12. Yang JC-H et al. Symptom control and quality of life in LUX-Lung 3: a phase III study of afatinib or cisplatin/pemetrexed in patients with advanced lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013; 31: 3342–50.
13. Zhou C et al. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): A multicenter, open-label, randomised phase 3 study. Lancet Oncol 2011; 12: 735–42.
14. Yang J et al. Overall survival (OS) in patients (pts) with advanced non-small cell lung cancer (NSCLC) harboring common (Del19/L858R) epidermal growth factor receptor mutations (EGFRmut): pooled analysis of two large open-label phase III studies (LUX-Lung 3 [LL3] and LUX-Lung 6 [LL6]) comparing afatinib with chemotherapy (CT). Proc ASCO 2014; #8004.
15. Camidge DR et al. Activity and safety of crizotinib in patients with ALK-positive non-small-cell lung cancer: updated results from a phase 1 study. Lancet Oncol 2012; 13: 1011–9.
16. Crinó L et al. Initial phase II results with crizotinib in advanced ALK-positive non-small cell lung cancer (NSCLC): PROFILE 1005. J Clin Oncol 2011; 29: #7514.
17. Davies KD et al. Identifying and targeting ROS1 gene fusions in non–small cell lung cancer. Clin Cancer Res 2012; 18: 4570–9.
18. Bergethon K et al. ROS1 rearrangements define a unique molecular class of lung cancers. J Clin Oncol 2012; 30: 863–70.
19. Shaw AT et al. Clinical activity of crizotinib in in advanced non-small cell lung cancer (NSCLC) harboring ROS1 gene rearrangement. J Clin Oncol 2012; 30: #7508.
20. Ou S-HI, Bang Y-J, Camidge DR et al. Efficacy and safety of crizotinib in patients with advanced ROS1-rearranged nonsmall cell lung cancer (NSCLC). Proc ASCO 2013; # 8032.
21. Shaw AT et al. Crizotinib in ROS1-rearranged non–small-cell lung cancer. N Engl J Med 2014; 371: 1963-71.
22. Solomon BJ et al. Overall and intracranial (IC) efficacy results and time to symptom deterioration in PROFILE 1014: 1ST-line crizotinib vs pemetrexed-platinum chemotherapy (PPC) in patients (pts) with advanced ALK-positive non-squamous non-small cell lung cancer (NSCLC). Ann Oncol 2014; 25, Suppl 4 (ESMO 2014, Abstract #1225O).

Prof. Dr. med. F. Griesinger
Klinik für Hämatologie und Onkologie
Pius-Hospital
Georgstr. 12
D-26121 Oldenburg

