Moderne Radiotherapie bei Sarkomen des Erwachsenen
Johanna Gellermann
Bei Weichteil-Sarkomen des Erwachsenen sind Lokalrezidive sehr häufig, eine Metastasierung erfolgt besonders oft pulmonal. Etwa die Hälfte der Erkrankten stirbt an dieser Tumorerkrankung [1, 2]. Das Progressionsrisiko einer Progression hängt stark von den Risikofaktoren ab: Tumorgröße, histologisches Grading und Lage des Tumors, wobei tiefliegende Tumoren ein höheres Risiko aufweisen [3].
Ziele der Therapie sind dementsprechend die Verbesserung der lokalen Kontrolle wie auch die Vermeidung von Fernmetastasen. Bei Tumoren der Extremitäten gilt es zusätzlich, die Funktion der Extremität bzw. des Organs zu erhalten, indem man z. B. multimodale Therapiekonzepte einsetzt, um mutilierende Operationen möglichst zu vermeiden. Aber auch bei anderen Lokalisationen muss man die Funktion der umliegenden gesunden Organe berücksichtigen, indem man deren Schädigung durch die (Vor-) Behandlungen abwägt, am besten im Rahmen interdisziplinärer Tumorkonferenzen in einem Organzentrum für diese Erkrankung.
Konservativere Operationsmethoden und adjuvante Strahlentherapie haben lokale Kontrolle und funktionelle Ergebnisse bei Patienten mit Weichteilsarkomen erheblich verbessert [4–6]. Die Strategien, mit denen das krankheitsfreie Überleben (DFS, Disease-Free Survival, inklusive der Freiheit von Fernmetastasen) verbessert werden soll, basieren in der Regel auf Anthrazyklin- und Ifosfamid-haltigen Chemotherapien. Studienergebnisse dazu besitzen jedoch häufig aufgrund fehlender Randomisierung eingeschränkte Aussagekraft; auch sind die Regimes durch erhebliche Toxizität belastet [7–9].
Radiotherapie
Die Strahlentherapie kann bei Sarkomen postoperativ (d. h. adjuvant) wie auch präoperativ (d. h. neoadjuvant) eingesetzt werden. Einzel- und Gesamtdosis der Bestrahlung sowie die technische Durchführung unterscheiden sich dabei je nach Lage des Tumors und der Risikoorgane sowie der Ausstattung der radioonkologischen Abteilung. Eine Normofraktionierung von 5 x 1,8 Gy bzw. 5 x 2 Gy pro Woche wird dabei am häufigsten angewendet, appliziert mit einer CT-geplanten 3D-konformalen Bestrahlungstechnik. Die Gesamtdosen liegen präoperativ zwischen 45 und 50,4, postoperativ zwischen 50 und 80 Gy, je nach Resektionsstatus und Belastung der umgebenden Risikoorgane.
Der Einsatz einer Intensitäts-modulierten Radiotherapie (IMRT) kann sinnvoll sein, wenn ein Risikoorgan wie die Niere nah am Zielvolumen liegt. Durch diese Technik wird oft eine deutlich niedrigere Strahlenbelastung für das Risikoorgan erreicht und dessen Funktion u. U. besser erhalten. Allerdings ist dabei oft das mit geringen Dosen bestrahlte Volumen deutlich größer.
Um die Strahlendosis millimetergenau applizieren zu können, wird in vielen Abteilungen die bildgeführte Strahlentherapie (Image-Guided Radiotherapy, IGRT) eingesetzt. Dabei werden vor Applikation der Dosis Kontrollaufnahmen bezüglich der Position des Patienten zur Strahlungsquelle in mehreren Ebenen bzw. als Conebeam-CT angefertigt. Die Position des Patienten wird anhand dieser Bildgebung mit dem Bestrahlungsplan verglichen und ggf. korrigiert, sodass die Bestrahlung exakt wie im Bestrahlungsplan vorgesehen verabreicht werden kann.
Eine Hyperfraktionierung (zweimal täglich 1,2 Gy) wird oft bei großer Nähe des zu bestrahlenden Zielvolumens zu empfindlichen Risikoorganen (z. B. Sehnerv, Dünndarm) eingesetzt. Eine akzelerierte Bestrahlung (zweimal täglich bis zu 1,8 Gy) kann aus logistischen Gründen notwendig sein, wenn eine schnellere Applikation der Zieldosis erforderlich ist, z. B. bei sequenzieller Chemo-Radio-Chemotherapie. In diesen Fällen reduziert sich gewöhnlich die Gesamtdosis, z. B. von 45 auf 36 Gy.
Für komplizierte anatomische Regionen mit mehreren strahlensensiblen Risikoorganen wird gelegentlich auch eine intraoperative Radiatio oder eine interstitielle Strahlentherapie im Afterloading-Verfahren zur Dosisaufsättigung eingesetzt. Mit diesen Techniken lassen sich die Risikoorgane besser schonen, ohne die Strahlendosis im Zielvolumen zu kompromittieren. Sie sind jedoch nicht in allen radioonkologischen Abteilungen verfügbar. In spezialisierten Zentren kann diese besondere Schonung auch durch den Einsatz einer Protonen- oder Schwerionen-Strahlenquelle erreicht werden. Er erfolgt bisher jedoch vorwiegend im Rahmen von klinischen Studien.
Bei der Bestrahlung der Extremitäten muss man darauf achten, dass nicht die komplette Zirkumferenz der Extremität mit der hochdosierten Bestrahlung erfasst wird. Ein schmaler Bereich an der nicht tumortragenden Seite sollte weitgehend unbestrahlt bleiben, um einer späteren Ödembildung durch Fibrose der Lymphgefäße in den abhängigen Partien vorzubeugen.
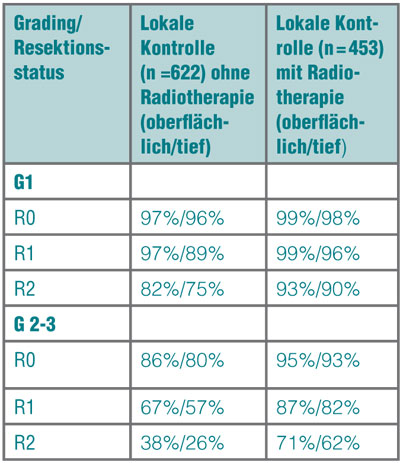
Die Wirksamkeit einer adjuvanten Radiotherapie für die lokale Tumorkontrolle konnte die Scandinavian Sarcoma Group in ihrer Studie eindrucksvoll an einer großen Population von 1.093 Patienten nachweisen [10]. Wie in Tab. 1 ersichtlich, kann der Effekt der Strahlentherapie sowohl bei niedriggradigen und oberflächlich gelegenen Sarkomen mit R0-Resektionsstatus als auch bei Sarkomen mit höherem Risiko (R > 0, G > 1, tiefliegend) nachgewiesen werden. Dabei zeigt sich, dass der Effekt der Radiatio umso höher ist, je mehr Risikofaktoren vorhanden sind.
Während die Wirksamkeit von neoadjuvanter und adjuvanter Radiotherapie weitgehend vergleichbar ist, konnte eine kanadische Studie zeigen, dass sich ihre Nebenwirkungen deutlich unterscheiden [11]:
Aufgrund der meist niedrigeren Dosis (um 50 Gy) und der oft kleineren Strahlenfelder sind klinisch relevante Fibrosen, Gelenkversteifungen und Ödeme nach neoadjuvanter Strahlentherapie seltener als nach adjuvanter Bestrahlung (Dosis um 66 Gy, 31,5% vs. 48,1%). Die Fibroserate ist v. a. mit der Größe der Strahlenfelder assoziiert, die bei adjuvanter Bestrahlung ausgedehnter sind. Bei postoperativer Radiatio wird meist das gesamte Operationsgebiet bestrahlt, wogegen die präoperative Bestrahlung nur den Tumor mit einem definierten Sicherheitsabstand umfasst. Zusätzlich verdrängt der Tumor häufig sensible Risikoorgane, sodass diese bei der neoadjuvanten Strahlentherapie aus rein geometrischen Gründen besser als bei postoperativer Bestrahlung geschont werden können. Postoperativ kommt es häufig vor, dass die Risikoorgane sich direkt in die ehemalige Tumorhöhle hineinverlagern, dort bisweilen auch narbig fixiert bleiben und damit im Zielvolumen der höchsten Dosis zu liegen kommen (z. B. der Dünndarm bei retroperitonealen Tumoren).
Allerdings sind Wundheilungsverzögerungen bei neoadjuvanter Bestrahlung deutlich häufiger als bei adjuvanter Bestrahlung (die in der Regel erst nach Wundheilung erfolgt). Speziell Wunden in hygienisch oder bewegungstechnisch problematischen Regionen sind davon betroffen, sodass später ein schlechteres funktionelles Ergebnis resultieren kann.
Aus diesen Gründen ist – trotz bereits guter Wirksamkeit der Bestrahlung bei Weichteilsarkomen – gerade bei Sarkomen mit höherem Risiko eine Intensivierung der Strahlentherapie-Wirkung wünschenswert, ohne die Nebenwirkungen zu verstärken.
Multimodale Therapiekonzepte
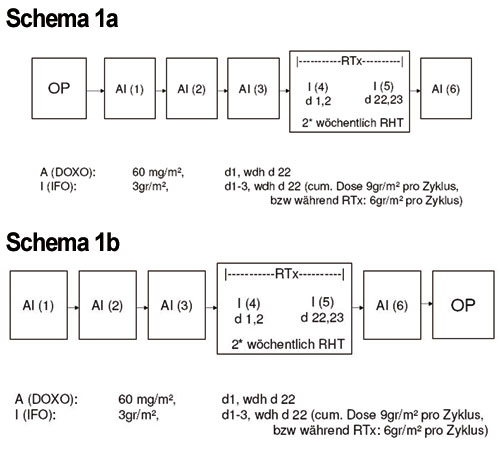
Das im Universitätsklinikum Tübingen (UKT) bereits seit mehreren Jahren verfolgte multimodale Therapiekonzept bei Patienten mit Weichteilsarkomen wurde schon 2009 veröffentlicht ([12], siehe Schema 1a und b in Abb. 1). Ebenso wurde über die damit bei irresektablen Tumoren erzielten Ergebnisse berichtet [13] sowie über einen Vergleich von neoadjuvant mit alleiniger Radiotherapie behandelten Patienten mit solchen, die neoadjuvant eine Radio-Chemotherapie (+ Ifosfamid), eine Radio-Thermotherapie oder eine trimodale Radio-Chemo-Thermotherapie erhalten hatten [14]. Dieser Vergleich legt den Schluss nahe, dass eine multimodale der alleinigen neoadjuvanten Radiotherapie überlegen sein könnte.
Es ist bekannt, dass die Rate der Tumornekrose nach neoadjuvanter Therapie gerade bei den prognostisch ungünstigen Tumoren mit dem Outcome korreliert [15]. V. a. bei diesen Patienten sind Strategien zur intensivierten weiteren Lokaltherapie zur Vermeidung lokaler Rezidive und von Fernmetastasen dringend notwendig. Sie profitieren potenziell von einer intensivierten Lokaltherapie durch Kombination von Radiotherapie mit Chemotherapie und regionaler Tiefenhyperthermie. Die Ursachen für erhöhte Radio- oder Chemotherapie-Resistenz liegen v. a. auch in tumorbiologischen Eigenschaften wie hohen interstitiellen Drücken, niederen pH-Werten, Tumorhypoxie und inhomogener Perfusion begründet. Gerade große Weichteilsarkome sind oft inhomogen perfundiert und weisen große Bereiche hypoxischer Areale auf [16–18]. Dieser Umstand ist auch ursächlich für die Schwierigkeiten bei der radiologischen Diagnostik des Ansprechens nach neoadjuvanter Therapie, sodass die RECIST-Kriterien alleine gerade bei Sarkomen oft nicht hinreichend aussagekräftig für ein Therapiemonitoring sind [19].
Hyperthermie
Eine der effektivsten Optionen zur Radio- und Chemosensibilisierung ist die regionale Hyperthermie. Sie entwickelt diese Eigenschaften besonders in Geweben mit niederen Sauerstoff-Partialdrücken durch Verbesserung der Perfusion, aber auch durch direkte Zytotoxizität für Zellfraktionen in Hypoxie oder saurem Milieu [20]. In Bereichen ohne funktionsfähige Gefäße ist sie oft besonders effektiv, weil man bei fehlender Kühlung durch Blutfluss besonders hohe Temperaturen erreicht.
Temperaturen von 40–43 °C führen zur Thermosensibilisierung, die in Kombination mit Chemo- oder Radiotherapie eine Erhöhung der Zytotoxizität und damit eine Verbesserung der lokalen Kontrolle erzielen kann [21, 22]. Die klinische Wirksamkeit der Kombination von Hyperthermie und Standard-Strahlentherapie wurde in der Behandlung verschiedener solider Tumoren (Melanom, Zervix-, Mammakarzinom) in prospektiv randomisierten Phase-III-Studien bereits nachgewiesen [23–26].
Eine Phase-III-Studie zur neoadjuvanten Chemo-Thermotherapie bei Hochrisiko-Weichteilsarkomen [22] zeigte nach median 34 Monaten eine verbesserte lokale Kontrolle im Arm mit Hyperthermie (Hazard Ratio 0,58; 95%-Konfidenzintervall 0,41–0,83; p = 0,003) mit einer absoluten Differenz im lokalen progressionsfreien Überleben (LPFS) nach zwei Jahren von 15%. Für das krankheitsfreie Überleben lag die HR bei 0,70 (95%-KI 0,54–0,92; p = 0,011). Die Ansprechrate auf die Therapie im Hyperthermie-Arm betrug 28,8%, im Gegensatz zu 12,7% im Kontrollarm (p = 0,002). In der Subgruppenanalyse der Patienten, bei denen die Therapie komplett durchgeführt werden konnte, war auch das Gesamtüberleben im Hyperthermie-Arm besser (HR 0,66; 95%-KI 0,45–0,98; p = 0,038). Bei einer Untergruppe von Patienten konnte gezeigt werden, dass die erreichte Tumortemperatur deutlich mit der Nekroserate korreliert ist [27].
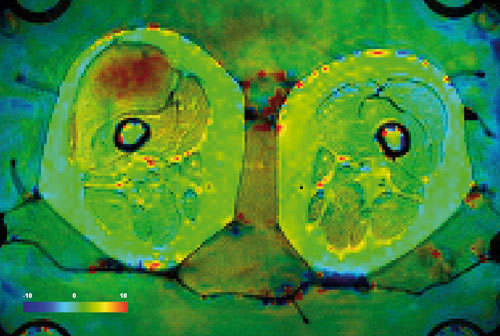
Die Durchführung der regionalen Hyperthermie wird am UKT nach den ESHO-Qualitätsguidelines [28] durchgeführt. Für Patienten mit Sarkomen wird die Hyperthermie analog zur Strahlentherapie nach einem individuellen Hyperthermie-Plan und unter Bildkontrolle mittels MR-Thermometrie durchgeführt (Abb. 2). Hierfür wird ein Hybrid-Hyperthermie-System mit integriertem 1,5-T-MR-Tomografen eingesetzt (BSD 2000 3D MRI, BSD mc, Salt Lake City, Utah, USA).
Diskussion
Basierend auf unseren Erfahrungen und Daten der genannten Studien [10, 11, 14, 22] wird die Hyperthermie in Kombination mit Bestrahlung und Chemotherapie am UKT als perioperative, lokal intensivierende Behandlungsoption (entsprechend Schema 1 a/b) bei Nicht-Rhabdomyo-Weichteilsarkomen mit hohem Risiko im Rahmen einer Fall-Kontroll-Serie eingesetzt.
Besonderer Wert wird jedoch darauf gelegt, dass die Patienten vor Therapiebeginn mit den Vertretern der beteiligten Fachdisziplinen im Zentrum für Weichteilsarkome (ZWS) gemeinsam besprochen werden und die Indikation gemeinsam gestellt wird. Die Erfahrung mit den unterschiedlichen Weichteilsarkom-Subtypen hat gezeigt, dass manche Weichteilsarkome (z. B. gastrointestinale Stromatumoren oder Leiomyosarkome des Uterus [30]) von einer anderen Behandlungsstrategie besser profitieren.
Durch Entwicklung und Testung neuer spezifischer Therapien wird sich die Therapie von Weichteilsarkomen im Laufe der Zeit immer wieder wandeln. Dennoch zeigt der Einsatz der Strahlentherapie gerade bei hochmalignen Sarkomen, knapper, zweizeitiger oder inkompletter Resektion und bei tief gelegenen Tumoren besondere Effektivität. Diese kann mit multimodalen Konzepten, wie z. B. dem Einsatz einer simultanen Chemotherapie oder Hyperthermie, noch weiter gesteigert werden.
Durch den Einsatz moderner Strahlentherapie-Techniken wie IMRT, IGRT, Afterloading oder intraoperative Bestrahlung kann die Strahlentherapie heutzutage exakt und mit besserer Schonung umliegender Risikoorgane eingesetzt werden. Die langjährige Erfahrung hat die größten Risikofaktoren für Spätfolgen wie Fibrose, Strikturen, Ödembildung und Verzögerung der Wundheilung aufgedeckt, sodass dieses Wissen bereits beim ersten interdisziplinären Austausch in die Entscheidung für die beste Therapie des individuellen Patienten mit einfließen kann.
Fazit
Die Möglichkeiten der modernen Strahlentherapie bieten perioperativ wirksame und sehr schonende Therapiemöglichkeiten für Patienten mit Weichteilsarkomen. Durch das Wissen um die Risikofaktoren der Erkrankung wie Grading, Größe, Lage und Resektionsstatus des Tumors und die bekannten dosisabhängigen Risiken für die umliegenden Organe kann im interdisziplinären Dialog die für den Patienten beste Gesamttherapie ausgewählt werden. Die Kombination der perioperativen Strahlentherapie mit Chemotherapie oder Hyperthermie kann zu weiteren Verbesserungen der Ergebnisse beitragen, insbesondere bei Patienten mit hohem Risiko für ein Rezidiv.
Literatur
1. Jemal A et al. Cancer statistics 2004. CA Cancer J Clin 2004; 54: 8-29.
2. Brennan M et al. Soft-tissue sarcoma. In: De Vita VT, Hellmann S, Rosenberg S, Rosenberg SA, Eds. Cancer: Principles and Practice of Oncology. Pennsylvania: Lippincott Williams and Wilkins, 2005: 1581–637.
3. Clark MA et al. Soft-tissue sarcomas in adults. N Engl J Med 2005; 353: 701-11.
4. Pisters PW et al. Long-term results of a prospective randomized trial of adjuvant brachytherapy in soft-tissue sarcoma. J Clin Oncol 1996; 14: 859-68.
5. Yang JC et al. Randomized prospective study of the benefit of adjuvant radiation therapy in the treatment of soft-tissue sarcomas of the extremity. J Clin Oncol 1998; 16: 197-203.
6. O’Sullivan B. et al. Preoperative versus postoperative radiotherapy in soft-tissue sarcoma of the limbs: A randomised trial. Lancet 2002; 359: 2235-41.
7. Casali PG et al. Adjuvant chemotherapy for soft-tissue sarcoma. Curr Opinion Oncol 2005; 17: 361-65.
8. Kraybill WG et al. Phase II study of neoadjuvant chemotherapy and radiation therapy in the management of high risk, high grade, soft-tissue sarcomas of the extremities and body wall: Radiation Therapy Oncology Group trial 9514. J Clin Oncol 2006; 24: 619-25.
9. Gortzak E et al. A randomized phase II study on neo-adjuvant chemotherapy in high risk adult soft tissue sarcoma. Eur J Cancer 2001; 37: 1096-103.
10. Jebsen NL et al. Radiotherapy to improve local control regardless of surgical margin and malignancy grade in extremity and trunk wall soft-tissue sarcoma: A Scandinavian Sarcoma Group study. Int J Radiat Oncol Biol Phys 2008; 71: 1196-203.
11. Davis AM et al. Late radiation morbidity following randomization to preoperative versus postoperative radiotherapy in extremity soft-tissue sarcoma. Radiother Oncol 2005; 75: 48-53.
12. Hartmann JT et al. Neoadjuvante Chemotherapie des lokalisierten Weichteilsarkoms. Onkologe 2009; 15: 389-97.
13. Eckert F et al. Definitive radiotherapy and single-agent radiosensitizing ifosphamid in patients with localized, irresectable soft tissue sarcoma: a retrospective analysis. Radiat Oncol 2010; 16: 5-55.
14. Eckert F et al. Effect of concurrent chemotherapy and hyperthermia on outcome of preoperative radiotherapy of high-risk soft-tissue-sarcomas. Strahlentherapie Onkologie 2013; 189: 482-5.
15. MacDermed D. et al. Primary tumor necrosis predicts distant control in locally advanced soft tissue sarcomas following preoperative concurrent chemoradiotherapy. Int J Radiat Oncol Biol Phys 2010; 76: 1147-53.
16. Brizel DM et al. Radiation therapy and hyperthermia improve the oxygenation of human soft-tissue sarcomas. Cancer Res 1996; 54: 5347-50.
17. Engellau J et al. Improved prognostication in soft-tissue sarcoma: Independent information from vascular invasion, necrosis, growth pattern and immunostaining using whole-tumor sections and tissue microarrays. Hum Pathol 2005; 36: 994-1002.
18. Søvik Ǻ et al. Radiotherapy adapted to spatial and temporal variability in tumor hypoxia. Int J Radiat Oncol Biol Phys 2007; 68: 1496-504.
19. Stacchiotti S et al. High-grade soft-tissue sarcomas: Tumor response assessment—pilot study to assess the correlation between radiologic and pathologic response by using RECIST and Choi criteria. Radiology 2009; 251: 447-56.
20. van der Zee J: Heating the patient: A promising approach. Ann Oncol 2002; 13: 1173-84.
21. Wust P et al. Hyperthermia in a combined treatment of cancer. Lancet Oncol 2002; 3: 487-97.
22. Issels RD et al. Neo-adjuvant chemotherapy alone or with regional hyperthermia for localised high-risk soft-tissue sarcoma: A randomised phase 3 multicentre study. Lancet Oncol 2010; 11: 561-70.
23. Overgaard J et al. Randomised trial of hyperthermia as adjuvant to radiotherapy for recurrent or metastatic malignant melanoma. European Society for Hyperthermic Oncology. Lancet 1995; 345, 8949: 540-43.
24. van der Zee J et al. Comparison of radiotherapy alone with radiotherapy plus hyperthermia in locally advanced pelvic tumours: A prospective, randomised, multicentre trial. Dutch Deep Hyperthermia Group. Lancet 2000; 355: 1119-25.
25. Jones E et al. Randomized trial of hyperthermia and radiation for superficial tumors. J Clin Oncol 2005; 23: 3079-85.
26. Franckena M et al. Long-term improvement in treatment outcome after radiotherapy and hyperthermia in locoregionally advanced cervix cancer: An update of the Dutch Deep Hyperthermia Trial. Int J Radiat Oncol Biol Phys 2008; 70: 1176-82.
27. Gellermann J et al. Non-invasive MR-thermography of soft-tissue sarcomas during regional hyperthermia: Correlation with response and direct thermometry. Cancer 2006; 107: 1373-82.
28. Bruggmoser G et al. Guideline for the clinical application, documentation and analysis of clinical studies for regional deep hyperthermia: Quality management in regional deep hyperthermia. Strahlenther Onkol 2012; 188 (Suppl 2): 198-211.
29. Gellermann J et al. Methods and potentials of magnetic resonance imaging for monitoring radiofrequency hyperthermia in a hybrid system. Int J Hyperthermia 2005; 21: 497-513.
30. Reed NS et al. Phase III randomised study to evaluate the role of adjuvant pelvic radiotherapy in the treatment of uterine sarcomas stages I and II: An European Organisation for Research and Treatment of Cancer Gynaecological Cancer Group study (protocol 55874). Eur J Cancer 2008; 44: 808-18.

PD Dr. med. Johanna Gellermann
Universitätsklinik für Radioonkologie
Hoppe-Seyler-Str. 3
72076 Tübingen