Bildgebende Verfahren zur Verlaufsbeurteilung der Systemtherapie bei Weichteilsarkomen
Klaus Heißner, Hans-Georg Kopp, Clemens Hinterleitner, Klaus-Peter Kreißelmeier, Marius Horger
Sarkome sind seltene Tumoren mesenchymalen Ursprungs. Sie machen ca. 1% aller malignen Erkrankungen im Erwachsenenalter aus. Mehr als 50 histologische Subtypen sind beschrieben. Die vollständige Resektion gegebenenfalls im Rahmen eines multimodalen Therapieansatzes mit Chemo- und/oder Strahlentherapie ist die einzige kurative Therapieoption. Die hohe Rate an Fernmetastasen nach primärer R0-Resektion bei einigen Entitäten weist auf das Vorliegen präoperativ nicht detektierter Mikrometastasen und damit eine unzureichende Sensitivität der durchgeführten Bildgebung hin. Eine Chemotherapie in der rezidivierten und/oder metastasierten Situation erfolgt in aller Regel in primär palliativer Intention. Die Effektivität ist (mit Ausnahme der gastrointestinalen Stromatumoren [GIST]) unbefriedigend. Dies unterstreicht den Stellenwert einer adäquaten Bildgebung sowohl zur Therapieplanung und Abschätzung der Prognose zum Zeitpunkt der Erstdiagnose als auch zur Verlaufsbeurteilung, um eine ineffektive Therapie frühzeitig abzubrechen.
Während in den letzten Dekaden eine Veränderung der Tumorgröße als wichtigster Parameter unter der Therapie mit zytotoxischen Medikamenten betrachtet wurde, veränderten sich das therapeutische Vorgehen und damit auch die Anforderungen an die Bildgebung in den letzten Jahren. Mit Ausnahme von GIST werden Weichteilsarkome initial zumeist Anthrazyklin-basiert behandelt. Doxorubicin (ggf. mit Ifosfamid kombiniert) gilt als Standardtherapie in der ersten Behandlungslinie [1, 2]. Hierunter gilt die Beurteilung des Therapieansprechens nach RECIST-Kriterien als etabliert (RECIST 1.1, Response Evaluation Criteria in Solid Tumors, [3]). Ab der zweiten Therapielinie sind in Deutschland sowohl Trabectedin als auch Pazopanib zugelassen. Beide Wirkstoffe besitzen im Vergleich zu den klassischen Zytostatika neuartige Wirkmechanismen. Trabectedin bindet an die „minor groove“ der Tumorzell-DNA und verursacht funktionelle Störungen der Interaktion mit DNA-Bindeproteinen, Transkriptionsfaktoren und DNA-Reparaturmechanismen [4]. Pazopanib ist für die Systemtherapie nicht-adipozytischer adulter Weichteilsarkome zugelassen und wirkt als pharmakologisch wenig spezifischer Tyrosinkinaseinhibitor vor allem anti-angiogenetisch [5]. Klinisch liegen die Stärken beider Substanzen in der Möglichkeit einer Krankheitsstabilisierung im Sinne einer mittelfristigen Chronifizierung der Erkrankung.
Die klassische Erfolgsbeurteilung mit der Bestimmung der Tumorgröße stellt sich unter dem Einsatz neuerer antineoplastischer Medikamente immer mehr als unzureichend heraus [6]. Sie machen den Einsatz neuer Messverfahren und die Etablierung neuer Messtechniken, von Surrogat-Parametern, Biomarkern u. v. a. notwendig. Da jedoch in absehbarer Zeit kein verlässlicher Biomarker etabliert werden wird, rücken die Verfahren der diagnostischen Radiologie immer weiter in den Mittelpunkt des wissenschaftlichen Interesses.
Etablierte radiologische Verfahren in der Diagnostik von Weichteilsarkomen
Computertomografie (CT) und Magnetresonanztomografie (MRT) sind die beiden fest etablierten diagnostischen Verfahren im Rahmen der Erstdiagnose und Erfolgsbeurteilung unter einer laufenden Chemotherapie von Weichteilsarkomen. Dabei hatte sich die unidimensionale oder bidimensionale Messung der Tumorgröße unter Verwendung der international standardisierten RECIST 1.1- oder WHO-Kriterien zur Beurteilung des Therapieansprechens über Jahrzehnte als Methode der Wahl etabliert.
Die Einführung von Imatinib als erster zielgerichteter Wirkstoff zur Therapie solider Tumoren (GIST) im Jahr 2002 deckte jedoch rasch Schwächen der radiologischen Beurteilbarkeit des Therapieansprechens auf. Häufig kommt es unter der Therapie mit Imatinib nicht zu einer Abnahme der messbaren Tumorgröße. Vielmehr werden das den Tumor umgebende Gewebe (Tumor-Environment), die Angioneogenese sowie intra- und extrazelluläre Tumor-promovierende Signalwege blockiert und idealerweise eine langfristige Wachstums-Inhibition erreicht. Das Ansprechen auf diese Art von Therapie präsentiert sich radiologisch sehr heterogen. So verändert sich nicht nur die Größe des Tumors, sondern auch dessen Struktur. Typischerweise nehmen die messbare Dichte und die Kontrastmittelaufnahme im Randbereich des Tumors sowie von intratumoral gelegenen Knoten ab. Möglicherweise reflektiert dieses Phänomen eine strukturelle Veränderung des Tumor-Gefäßnetzes im Sinne einer Rarefizierung oder auch Pseudonormalisierung von Tumorgefäßen [7]. Einige Tumoren zeigen ausschließlich eine Dichteabnahme ohne gleichzeitige Größenabnahme. Die Klassifikation nach RECIST erfasst diese Veränderungen nicht und unterschätzt dadurch regelhaft das Therapieansprechen.
Mit der aktuellen Entwicklung personalisierter Therapieansätze kommen immer mehr zielgerichtete Therapieverfahren auf den Markt. Die Gruppe der Weichteilsarkome nimmt hierbei eine Vorreiterstellung ein. In der Therapie der GIST kommen ausschließlich Tyrosinkinaseinhibitoren (TKI) zum Einsatz. Für die meisten anderen Entitäten sind Trabectedin und Pazopanib die einzigen beiden Neuzulassungen des letzten Jahrzehnts.
Neuere radiologische Verfahren in der Diagnostik von Weichteilsarkomen
Während sich der Einsatz der Positronen-Emissionstomografie (PET) in klinischen Studien bereits als hilfreich zur Beurteilung des Therapieansprechens und der Prognose herausgestellt hat, gibt es bis heute keine Zulassung durch den Gemeinsamen Bundesausschuss (GBA), sodass die Kosten nicht erstattet werden. Dementsprechend waren alternative Kriterien zur Beurteilung des Therapieansprechens gefragt. Hierzu gehören erweiterte Evaluationskriterien wie SACT (Size and Attenuation CT) und MASS (Morphology, Attenuation, Size and Structure [8, 9]). Die entscheidende Neuerung beider Verfahren ist die Einbeziehung einer posttherapeutisch verminderten Kontrastmittelaufnahme zur Beurteilung des Tumoransprechens. Sie hat sich als prädiktiv für das klinische Ansprechen herausgestellt.
Die SACT-Kriterien können frühzeitig Therapieversager identifizieren und sind prädiktiv für ein verlängertes progressionsfreies Überleben. Dennoch haben sich die Kriterien in der Routine vor allem aus zweierlei Gründen nicht durchgesetzt. Zum einen ist keine Beurteilung morphologischer oder struktureller Veränderungen von Metastasen vorgesehen. Zum anderen ist für eine dreidimensionale Volumenbestimmung eine eigene Software notwendig, welche weitere Kosten produziert und v. a. zeitintensive Rechenvorgänge benötigt.
Die MASS-Kriterien können zusätzlich zur üblichen Beurteilung einer kontrastmittelverstärkten CT angewendet werden. Sie erlauben eine exakte und Untersucher-unabhängige Beurteilung des Therapieansprechens von Tumoren unter anti-angiogenetischer Therapie und wurden insbesondere für die Beurteilung von Nierenzellkarzinomen entwickelt. Sie beziehen neben dem Auftreten neuer Metastasen und Größenveränderungen – analog den RECIST-Kriterien – zusätzlich morphologische und strukturelle Veränderungen sowie Veränderungen im Kontrastmittelverhalten der Tumoren ein.
Die auf dem Gebiet der Sarkome bislang entscheidende Weiterentwicklung ergibt sich jedoch aus der Arbeit einer amerikanischen Arbeitsgruppe. Haesun Choi (M. D. Anderson Cancer Center, Texas, USA) hat durch vergleichende Analysen von PET und CT Kriterien definiert, welche das Ansprechen auf die zielgerichtete Therapie mit Imatinib bei GIST besser abbilden [10, 11]. Diese berücksichtigen neben der Größe des Tumors auch die Dichtewerte sowie die Anzahl der im Tumor vorhandenen Gefäße. Damit ist die Größe des Tumors nicht mehr das alleinige Kriterium zur Beurteilung des Therapieansprechens unter TKI. Die mittels CT bestimmte Dichte des Tumorgewebes in Hounsfield-Einheiten (HU) wird zusätzlich berücksichtigt. Die Abnahme der Dichte ist Ausdruck von Nekrose, einer verminderten Vaskularisierung und verminderter Gefäßwand-Permeabilität [12]. Ein Therapieansprechen liegt bei einer Abnahme der Tumordichte um 15% oder einer Abnahme der Tumorgröße in einer Ebene um 10% vor. Tabelle 1 gibt einen vereinfachten Überblick der RECIST- im Vergleich zu den Choi-Kriterien.
Reicht die unidimensionale Beurteilung von GIST anhand der Größe aus?
Seit der Einführung von Imatinib 2002 ist diese Frage eindeutig mit „Nein“ zu beantworten. GIST werden bis dato ausschließlich mit TKI behandelt (s. Artikel „Gastrointestinale Stromatumoren: Diagnostik und Therapie“ in dieser Ausgabe). Die Tumorbiologie von GIST ist durch „gain of function“-Mutationen charakterisiert, welche zu einer dauernden Stimulation der Proliferation sowie zur Suppression von Apoptose führen. Die Wirkung der zugelassenen Wirkstoffe Imatinib, Sunitinib und Regorafenib ist primär zytostatisch und nicht zytotoxisch. In der Folge kommt es häufig kaum zu einer Größenreduktion des Tumors, sondern vielmehr zu einer Reduktion der Stoffwechselaktivität, die mittels FDG-PET quantifiziert werden kann [13, 14]. In einigen Fällen kann es als Ausdruck eines guten Therapieansprechens v. a. durch Einblutungen in den Tumor, intratumorale Nekrosen und myxoide Degenerationen sogar zu einer zeitweisen Größenzunahme (sogenannter „Pseudoprogress“) kommen [15]. Somit wird die Effektivität der Therapie mittels unidimensionaler (RECIST) oder bidimensionaler Größenbestimmung (WHO-Kriterien) meist unterschätzt bzw. falsch eingeschätzt.
Welche alternativen Kriterien erlauben die Beurteilung des Ansprechens?
GIST haben eine gesteigerte Stoffwechselaktivität. Diese kann meist mittels 18F-Fluorodeoxyglukose-Positronen-Emissiontomografie (FDG-PET) gemessen und quantifiziert werden. Dabei scheint die mittels „Standardized Uptake Value“ (SUV) gemessene Glykolyse signifikant mit der histopathologisch über die Anzahl der Mitosen bestimmten Proliferationsrate zu korrelieren [16]. Die FDG-PET verfügt darüber hinaus auch über prognostische Aussagekraft. So konnten Heinicke et al. nachweisen, dass eine Abnahme der mittleren SUV von 60% nach einwöchiger Imatinib-Therapie im Verlauf von Wochen in einer partiellen Remission nach RECIST resultiert [17]. Einschränkend muss jedoch angemerkt werden, dass eine nicht unerhebliche Anzahl an GIST keine relevant messbare Aktivität in der PET zeigt. So wiesen in einer von Choi et al. publizierten Studie die Tumoren von 36 aus 173 Patienten (21%) keine relevant erhöhte Stoffwechselaktivität auf [15]. Der Glukose-Metabolismus von GIST ist zudem sehr variabel, weswegen eine PET alleine nur eine limitierte Aussagekraft besitzt. Die Kombination mit CT ist essenziell, um möglichst alle Läsionen zu detektieren und anatomisch korrekt zuordnen zu können. Potenzielle Fehlerquellen, die zu falsch negativen Befunden führen, sollten somit durch die Hybridtechnologie (Kombination aus PET plus CT) verringert werden [13]. Nach Antoch et al. kann das Therapieansprechen von GIST nach der einmonatigen Therapie mit Imatinib mittels PET-CT zu 95% und nach drei und sechs Monaten zu 100% festgestellt werden [13].
Bei aller Euphorie über die Hybridtechnologie ist jedoch festzuhalten, dass es sich um ein teures und in Deutschland nicht zugelassenes Verfahren zur GIST-Diagnostik handelt. Somit kommen in Europa alternative radiologische Verfahren zur Beurteilung des Therapieansprechens zum Einsatz. Das mit Abstand am häufigsten verwendete Verfahren ist die kontrastmittelverstärkte CT mit moderner Gerätetechnologie und/oder subtilen Auswertungsverfahren.
Choi et al. beobachteten, dass bei 97% der Patienten mit einem mittels PET gemessenen guten metabolischen Ansprechen (Abnahme der SUVmax > 70%) gleichzeitig der Tumor entweder ≥ 10% an Größe oder ≥ 15% an Dichte abnahm [15]. Dies ist bemerkenswert, da nach RECIST erst ab einer Größenabnahme von 30% im längsten Diameter von einem partiellen Ansprechen (PR) gesprochen werden darf. Die Tumordichte wird hierbei über die Hounsfield-Einheiten (HU) an jeder radiologischen Arbeitsstation einfach bestimmt und hat sich als hervorragender unabhängiger Marker zur Beurteilung des Therapieansprechens von GIST unter Imatinib etabliert. Bei gutem Therapieansprechen kann eine Abnahme der HU von 25–30% erwartet werden. Bleiben die HU nach 4–8 Wochen stabil bzw. nehmen sie zu, muss von einem Therapieversagen ausgegangen werden [10,13].
Dudeck et al. haben bei Patienten mit progredienter Erkrankung unter Imatinib das Ansprechen in der zweiten Therapielinie unter Sunitinib nach den RECIST- und den Choi-Kriterien verglichen [18]. Nach drei Monaten haben nach den Choi-Kriterien signifikant mehr Patienten ein partielles Ansprechen als nach den RECIST-Kriterien (31% vs. 2%). Entsprechend mehr Patienten zeigen nach RECIST-Kriterien mindestens eine Krankheitsstabilisierung (70% vs. 41%). Die Arbeit bestätigt, dass auch unter der Therapie mit Sunitinib die Ansprechraten nach RECIST unterschätzt werden.
Welche technischen Neuerungen erlauben eine standardisierte Tumorbeurteilung nach den Choi-Kriterien?
Eine neue technische Entwicklung auf dem Gebiet der CT könnte die einfache Perfusions-CT zur Beurteilung der Tumordurchblutung ablösen: die Volumen-Perfusions-CT (VPCT, [19, 20]). Sie ermöglicht die kombinierte Auswertung morphologischer und funktioneller Parameter und ist damit äußerst attraktiv zur Beurteilung von GIST unter der Therapie mit Imatinib und anderen TKI. So können mit der VPCT Veränderungen der Dichte des Tumors in Abhängigkeit von der Zeit nach Kontrastmittelgabe bestimmt werden. Auf diese Weise kann das Therapieansprechen nach Choi-Kriterien rasch, effektiv und unabhängig vom Untersucher beurteilt werden. Klinisch am bedeutsamsten ist das Verfahren wohl besonders zum Ausschluss eines Pseudoprogresses, welcher ohne Analyse des Perfusionsverhaltens in der CT fälschlicherweise zum Therapieabbruch führen würde. Der Nutzen von VPCT für die Therapiebeurteilung (insbesondere Pseudostabilisierung, Pseudoresponse) von Weichteilsarkomen unter zielgerichteter Therapie muss jedoch noch evaluiert werden.
Ein weiterer Versuch, das Therapieansprechen von GIST auf eine TKI-Therapie besser als nach RECIST und Choi einschätzen zu können, basiert auf einer Publikation von Graser et al. [21]. Diese versuchten anhand einer dreidimensionalen Berechnung von Lebermetastasen bei Nierenzellkarzinomen das Therapieansprechen zu beurteilen. Den gleichen Ansatz verwendeten Schiavon et al. in einer 2012 publizierten Untersuchung an 84 GIST-Patienten [22]. Wir müssen jedoch kritisch feststellen, dass die Methode nur bei Patienten mit hepatischen Metastasen möglich ist. Zudem ist das Verfahren in der Routine nicht erprobt. Des Weiteren konnte gezeigt werden, dass die vorgeschlagene Analyse nicht in der Lage ist, die Prognose abzuschätzen [23]. Wir gehen davon aus, dass diese Methode in Zukunft keine Chance hat, sich in der Routine zu etablieren.
Unter dem Einsatz der „Dual Energy Technology“ wurden in einer Studie einer deutschen Arbeitsgruppe kürzlich neue Kriterien zur Beurteilung des Therapieansprechens von GIST unter TKI-Therapie publiziert [24]. Die Autoren postulieren, eine noch sensitivere Methode zur Detektion des Therapieansprechens im Vergleich zu RECIST und Choi gefunden zu haben. Die Daten sind interessant und sollten weiter evaluiert werden. Aufgrund der geringen Zahl von 19 Patienten ist aber bislang sicher nicht von einem repräsentativen Patientenkollektiv zu sprechen.
Da die Choi- Kriterien ausschließlich zur Beurteilung von CTs entwickelt wurden, müssen wir an dieser Stelle erwähnen, dass auch die MRT-Diagnostik unter Verwendung Diffusions-gewichteter Protokolle in der Lage ist, mit hoher Sensitivität und Spezifität Veränderungen der zellulären Integrität (Diffusion-Weighted Imaging) bzw. Perfusion in Tumoren zu detektieren. Dadurch ist es möglich, das Therapieansprechen von Tumoren auf eine TKI-Therapie, auch zu einem frühen Zeitpunkt nach der Therapieeinleitung, suffizient zu beurteilen [25, 26]. Nach unserem Wissen ist die Methode jedoch noch nicht für den Einsatz bei Weichteilsarkomen getestet worden.
Welche klinische Relevanz ergibt sich aus der Unterscheidung zwischen RECIST- und Choi-Kriterien?
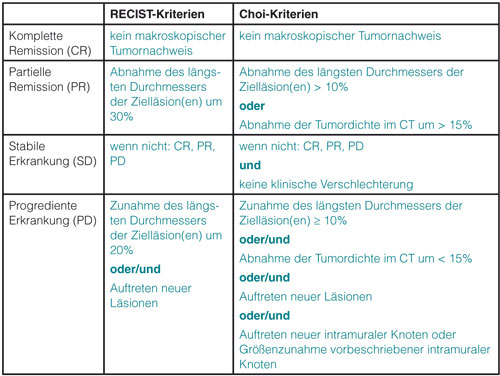
Die Beobachtung, dass die RECIST-Kriterien das Therapieansprechen auf TKI nicht korrekt abbilden, scheint gesichert. Diese Beobachtung ist von klinischer Relevanz: So werden nach Choi-Kriterien Patienten mit Pseudoprogress, Pseudostabilisierung bzw. Pseudoresponse identifiziert, bei denen nach RECIST-Kriterien die Therapie entweder fälslicherweise abgebrochen oder fälschlicherweise fortgeführt wird. Zur Prognoseabschätzung helfen die Kriterien nach Choi nach aktuellen Erkenntnissen jedoch nicht. Die Prognose ist für alle nicht progredienten Patienten ähnlich. Progressionsfreies Überleben und Gesamtüberleben von Patienten mit einer partiellen Remission oder einer stabilen Erkrankung unterscheiden sich nicht [18, 27]. Abb. 1 zeigt das Beispiel eines GIST-Patienten unter Therapie mit Regorafenib. Obwohl über Monate weder Veränderungen der Größe noch des Kontrastmittelverhaltens mittels MRT nachweisbar sind, konnte eine Langzeitstabilisierung der Erkrankung erreicht werden.
Bildgebende Verfahren unter der Therapie mit Trabectedin
Trabectedin ist seit 2007 zur Behandlung fortgeschrittener und/oder metastasierter Weichgewebssarkome nach Versagen einer Behandlung mit Anthrazyklinen und/oder Ifosfamid bzw. bei deren Unverträglichkeit zugelassen. Der Wirkmechanismus von Trabectedin ist einmalig und kann keiner bisher bekannten Substanzklasse zugeordnet werden. Durch die Bindung an die DNA wird der Zellzyklus gestört. Sowohl Transkription als auch DNA-Reparatur werden gehemmt. Die Hauptwirkung scheint zytostatisch, wobei auch Apoptose induziert wird [4]. Daneben wurden immunmodulatorische Wirkungen und die Hemmung der Angiogenese in der Tumorumgebung beschrieben [28].
Die Progressionsfreiheits-Rate unter Therapie mit Trabectedin beträgt nach sechs Monaten um 20% [29, 30]. Bemerkenswert sind jedoch teilweise lang anhaltende Krankheitsstabilisierungen v. a. bei den sogenannten L-Sarkomen (Leiomyosarkome, Liposarkome [31–34]). Zudem liegen Fallberichte von Patienten vor, bei denen nach einer stabilen Erkrankung nach RECIST-Kriterien erst im Verlauf von bis zu 42 Wochen eine partielle Remission mit einer entsprechenden Größenregredienz der Tumoren einsetzt [32, 33, 35, 36]. Payne et al. demonstrieren in ihrem kürzlich publizierten Fallbericht bei einem rezidivierten Leiomyosarkom des Uterus nach der Applikation von drei Zyklen Trabectedin (entspricht neun Wochen) einen mittels PET-CT dokumentierten Größenprogress von 13 auf 20 cm. Zeitgleich kam es jedoch auch zu einer zystischen Umwandlung des intratumoralen Gewebes und einem signifikanten Abfall der SUVmax. Anschließend folgte eine Krankheitsstabilisierung über zwölf Monate. Kasper et al. haben eine Fallsammlung von neun Patienten publiziert, die unter der laufenden Therapie mittels PET beobachtet wurden [37]. Der Abnahme der SUV um 40% folgte ein partielles Therapieansprechen nach RECIST. Patienten mit einer stabilen (SD) oder gar progredienten Erkrankung (PD) zeigten keine Dynamik in der SUV. Demnach könnte das PET alleine Patienten, die von der Therapie profitieren (SD) und diejenigen, die therapieresistent sind (PD), kaum voneinander unterscheiden.
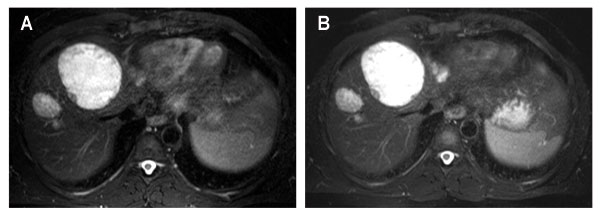
Das lang anhaltende und späte Therapieansprechen unter der Therapie mit Trabectedin zeigt Parallelen zu der Therapie mit TKI beim GIST (s. oben). Damit kann indirekt auf die Bedeutung der in vitro beobachteten Hemmung der Angiogenese durch den Wirkstoff geschlossen werden. Entsprechende Parallelen sind auch für die Erfolgsbeurteilung mittels CT zu beachten. Genau wie die TKI bei GIST scheint Trabectedin in einigen Fällen durch intratumorale Nekrosen und myxoide Degenerationen sogar zu einer Größenzunahme im Sinne eines Pseudoprogresses führen zu können. Dennoch ist die Erfolgsbeurteilung nach RECIST etablierter Standard, auch in klinischen Studien mit Trabectedin. Die Verwendung der Choi-Kriterien scheint ähnliche Ergebnisse wie bei den GIST unter der Therapie mit Imatinib zu liefern [38]. In der Studie von Grosso et al. ließ sich bei 29 von 38 Patienten ohne Progress unter der Therapie eine deutliche Abnahme der Dichtewerte als Ausdruck einer mittelfristigen Krankheitsstabilisierung nachweisen. Abb. 2 illustriert den Fall eines Patienten mit einem Liposarkom unter der Therapie mit Trabectedin. Bei der Beurteilung des Therapieansprechens tritt die absolute Größe des Tumors hinter den vollständigen Verlust der Kontrastmittelaufnahme zurück.
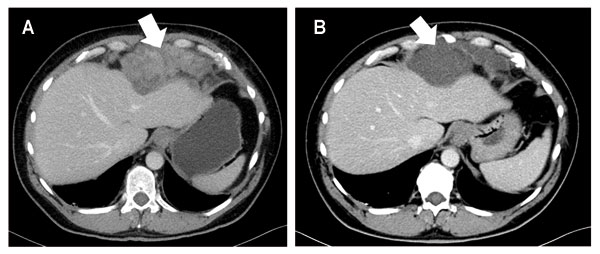
Ein frühzeitiges radiologisches Ansprechen im Sinne einer Dichteabnahme der Tumoren scheint – vergleichbar zu den Beobachtungen bei GIST unter Imatinib – auch unter der Therapie mit Trabectedin ein nachhaltiges Ansprechen im Sinne einer mittelfristigen Krankheitsstabilisierung vorherzusagen und lässt ein verzögertes Ansprechen im Sinne einer partiellen Remission nach RECIST erwarten. Die frühzeitige Beurteilung des Therapieansprechens ist in diesen Fällen nicht standardisiert und mit entsprechender Sorgfalt zu interpretieren. Im Zweifel sollte die Vorstellung an einem Sarkomzentrum zur radiomorphologischen Referenzbeurteilung erfolgen.
Bildgebende Verfahren unter der Therapie mit Pazopanib
Pazopanib ist ein Multi-Tyrosinkinaseinhibitor der zweiten Generation. Nachdem er in der PALETTE-Studie das mediane progressionsfreie Überleben von 1,6 Monaten unter Placebo auf 4,6 Monate signifikant verlängert hatte, erfolgte die Zulassung zur Behandlung von erwachsenen Patienten mit vorbehandeltem fortgeschrittenem Weichteilsarkom. Von der Zulassungsstudie und damit von der Zulassung ausgeschlossen waren adipozytische Sarkome, die typischen pädiatrischen Sarkome (Rhabdomyosarkome, Osteosarkom, Sarkome der Ewing-Familie), Chondrosarkome und seltene Entitäten wie Dermatofibrosarcoma protuberans, inflammatorischer myofibroblastischer Tumor, malignes Mesotheliom sowie gemischte mesodermale Tumoren des Uterus [39]. In der Zulassungsstudie war wie in den meisten aktuell laufenden Studien mit Pazopanib die Erfolgsbeurteilung nach RECIST vorgesehen.
Wir präsentieren hier den Fall einer Patientin aus unserer Klinik, die aufgrund eines intraabdominalen undifferenzierten Sarkoms eine Therapie mit täglich 800 mg Pazopanib (Standarddosis) erhält. Auch hier ergibt sich parallel zu den demonstrierten Fällen mit GIST unter Imatinib und myxoidem Liposarkom unter Trabectedin ein divergentes Ansprechen nach RECIST- und Choi-Kriterien (Abb. 3). Unter der Therapie eines undifferenzierten sarkomatoiden Tumors mit Pazopanib entstand als Ausdruck eines partiellen Ansprechens nicht eine Größenreduktion des Tumors, sondern ein vollständiger Verlust der Kontrastmittelaufnahme, assoziiert mit einer ausgeprägten Dichteabnahme des Tumors.
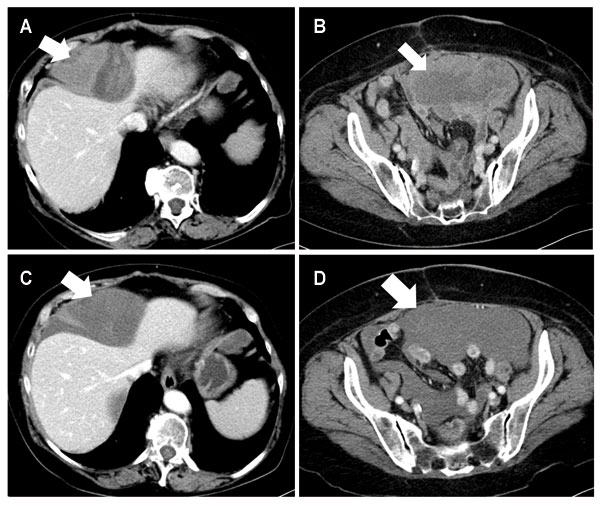
Damit können wir bei drei unterschiedlichen, aber zur Therapie bei Weichteilsarkomen zugelassenen Wirkstoffen zeigen, dass RECIST keine adäquate Einschätzung des Therapieansprechens erlaubt. Die Choi-Kriterien scheinen die Situation besser abzubilden; ihre prognostische Bedeutung bleibt jedoch im Einzelfall unklar.
Literatur
1. https://www.dgho-onkopedia.de/de/onkopedia/leitlinien/weichteilsarkome.
2. ESMO/European Sarcoma Network Working Group. Soft-tissue and visceral sarcomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2014; 25 (Suppl 3): iii102-iii112.
3. Eisenhauer EA et al. New response evaluation criteria in solid tumours: Revised RECIST guideline (version 1.1). Eur J Cancer 2009; 45: 228-47.
4. D'Incalci M, Galmarini CM. A review of trabectedin (ET-743): A unique mechanism of action. Mol Cancer Ther 2010; 9: 2157-63.
5. Gotink KJ, Verheul HM. Anti-angiogenic tyrosine kinase inhibitors: What is their mechanism of action? Angiogenesis 2010; 13: 1-14.
6. Choi H. Critical issues in response evaluation on computed tomography: Lessons from the gastrointestinal stromal tumor model. Curr Oncol Rep 2005; 7: 307-11.
7. Jain RK. Normalization of tumor vasculature: An emerging concept in antiangiogenic therapy. Science 2005; 307: 58-62.
8. Smith AD et al. Assessing tumor response and detecting recurrence in metastatic renal cell carcinoma on targeted therapy: Importance of size and attenuation on contrast-enhanced CT. AJR Am J Roentgenol 2010; 194: 157-65.
9. Smith AD et al. Morphology, Attenuation, Size, and Structure (MASS) criteria: Assessing response and predicting clinical outcome in metastatic renal cell carcinoma on antiangiogenic targeted therapy. AJR Am J Roentgenol 2010; 194: 1470-8.
10. Choi H et al. Correlation of computed tomography and positron emission tomography in patients with metastatic gastrointestinal stromal tumor treated at a single institution with imatinib mesylate: Proposal of new computed tomography response criteria. J Clin Oncol 2007; 25: 1753-9.
11. Choi H. Response evaluation of gastrointestinal stromal tumors. Oncologist 2008; 13 (Suppl 2): 4-7.
12. Kambadakone AR, Sahani DV. Body perfusion CT: Technique, clinical applications, and advances. Radiol Clin North Am 2009; 47: 161-78.
13. Antoch G et al. Comparison of PET, CT, and dual-modality PET/CT imaging for monitoring of imatinib (STI571) therapy in patients with gastrointestinal stromal tumors. J Nucl Med 2004; 45: 357-65.
14. Gayed I et al. The role of 18F-FDG PET in staging and early prediction of response to therapy of recurrent gastrointestinal stromal tumors. J Nucl Med 2004; 45: 17-21.
15. Choi H et al. CT evaluation of the response of gastrointestinal stromal tumors after imatinib mesylate treatment: A quantitative analysis correlated with FDG PET findings. AJR Am J Roentgenol 2004; 183: 1619-28.
16. Otomi Y et al. Relationship between FDG uptake and the pathological risk category in gastrointestinal stromal tumors. J Med Invest 2010; 57: 270-4.
17. Heinicke T et al. Very early detection of response to imatinib mesylate therapy of gastrointestinal stromal tumours using 18fluoro-deoxyglucose-positron emission tomography. Anticancer Res 2005; 25: 4591-4.
18. Dudeck O et al. Comparison of RECIST and Choi criteria for computed tomographic response evaluation in patients with advanced gastrointestinal stromal tumor treated with sunitinib. Ann Oncol 2011; 22: 1828-33.
19. Horger M et al. [Advantages of volume perfusion CT for evaluating the response of solid tumors to treatment with sunitinib]. Rofo 2013; 185: 595-602.
20. Betz M et al. The benefit of using CT-perfusion imaging for reliable response monitoring in patients with gastrointestinal stromal tumor (GIST) undergoing treatment with novel targeted agents. Acta Radiol 2013; 54: 711-21.
21. Graser A et al. [Volumetry of metastases from renal cell carcinoma: Comparison with the RECIST criteria]. Radiologe 2008; 48: 850-6.
22. Schiavon G, Ruggiero A. Tumor volume as an alternative response measurement for imatinib-treated GIST patients. PLoS One 2012; 7: e48372.
23. Schramm N et al. Tumor response and clinical outcome in metastatic gastrointestinal stromal tumors under sunitinib therapy: Comparison of RECIST, Choi and volumetric criteria. Eur J Radiol 2013; 82: 951-8.
24. Meyer M et al. CT-based response assessment of advanced gastrointestinal stromal tumor: Dual energy CT provides a more predictive imaging biomarker of clinical benefit than RECIST or Choi criteria. Eur J Radiol 2013; 82: 923-8.
25. Morgan B et al. A simple, reproducible method for monitoring the treatment of tumours using dynamic contrast-enhanced MR imaging. Br J Cancer 2006; 94: 1420-7.
26. Horger M et al. Early MRI response monitoring of patients with advanced hepatocellular carcinoma under treatment with the multikinase inhibitor sorafenib. BMC Cancer 2009; 9: 208.
27. Le Cesne A et al. Absence of progression as assessed by response evaluation criteria in solid tumors predicts survival in advanced GI stromal tumors treated with imatinib mesylate: The Intergroup EORTC-ISG-AGITG phase III trial. J Clin Oncol 2009; 27: 3969-74.
28. Germano G et al. Role of macrophage targeting in the antitumor activity of trabectedin. Cancer Cell 2013; 23: 249-62.
29. Yovine A et al. Phase II study of ecteinascidin-743 in advanced pretreated soft-tissue sarcoma patients. J Clin Oncol 2004; 22: 890-9.
30. Le Cesne A et al. Phase II study of ET-743 in advanced soft-tissue sarcomas: A European Organisation for the Research and Treatment of Cancer (EORTC) Soft Tissue and Bone Sarcoma Group trial. J Clin Oncol 2005; 23: 576-84.
31. Garcia-Carbonero R et al. Phase II and pharmacokinetic study of ecteinascidin 743 in patients with progressive sarcomas of soft tissues refractory to chemotherapy. J Clin Oncol 2004; 22: 1480-90.
32. Sanfilippo R et al. Trabectedin in advanced uterine leiomyosarcomas: A retrospective case series analysis from two reference centers. Gynecol Oncol 2011; 123: 553-6.
33. Payne MJ et al. Trabectedin in advanced high-grade uterine leiomyosarcoma: A case report illustrating the value of (18)FDG-PET-CT in assessing treatment response. Case Rep Oncol 2014; 7: 132-8.
34. Turpin A et al. Tumor calcification: A new response pattern of myxoid liposarcoma to trabectedin. Case Rep Oncol 2014; 7: 204-9.
35. Hollebecque A et al. Inadequacy of size-based response criteria to assess the efficacy of trabectedin among metastatic sarcoma patients. Invest New Drugs 2010; 28: 529-30.
36. Monk BJ et al. A phase II evaluation of trabectedin in the treatment of advanced, persistent, or recurrent uterine leiomyosarcoma: A Gynecologic Oncology Group study. Gynecol Oncol 2012; 124: 48-52.
37. Kasper B et al. The use of positron emission tomography in soft-tissue sarcoma patients under therapy with trabectedin. Mar Drugs 2009; 7: 331-40.
38. Grosso F et al. Efficacy of trabectedin (ecteinascidin-743) in advanced pretreated myxoid liposarcomas: A retrospective study. Lancet Oncol 2007; 8: 595-602.
39. van der Graaf WT et al. Pazopanib for metastatic soft-tissue sarcoma (PALETTE): A randomised, double-blind, placebo-controlled phase 3 trial. Lancet 2012; 379: 1879-86.

Dr. Med. Klaus Heißner
Zentrum für Weichteilsarkome,
GIST und Knochentumoren
Medizinische Universitätsklinik II
Südwestdeutsches Tumorzentrum
Comprehensive Cancer Center (CCC) Tübingen

