Die Notwendigkeit klinischer Studien ist unbestritten, aber die Umsetzung in den Prüfzentren bringt manches Problem mit sich. Eine Herausforderung, die gemeinhin wenig im Zentrum der Aufmerksamkeit steht, ist das Verwaltungsmanagement von Studien in den Studienzentren.
Das Wissen in der Medizin vermehrt sich rasant. Einen wesentlichen Beitrag zur Verbesserung der therapeutischen Möglichkeiten leistet die Arzneimittel- und Medizinprodukteforschung. In den letzten zehn Jahren gingen gut 10.000 Anträge auf Genehmigung einer klinischen Arzneimittelstudie beim Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM) ein, knapp 2.200 beim Paul Ehrlich Institut (PEI). Zwar ist die Zahl der Anträge seit einigen Jahren rückläufig, doch gilt Deutschland mit über 7.000 Prüfzentren immer noch als zweitwichtigster Forschungsstandort nach den USA.
Onkologische Studien
Ein großer Teil der Studien wird im Auftrag der pharmazeutischen Industrie durchgeführt, deren Projekte sich primär auf Krebstherapien beziehen. Ihr Anteil ist in den letzten zehn Jahren von weniger als 20% auf 33% gestiegen. Je nach Indikation, benötigter Fallzahl und Prävalenz nehmen laut Auskunft des Verbands der forschenden Arzneimittelhersteller (vfa) bis zu 100 Zentren an einer Studie teil, unter Umständen auch mehr. Schwerpunkt-Regionen der klinischen Forschung sind Berlin, Frankfurt, München, Hamburg, Heidelberg, Essen, Hannover und Dresden sowie Köln und Mainz. Der Anteil der Arztpraxen an Prüfzentren ist in den vfa-Statistiken nicht quantifiziert, doch ist davon auszugehen, dass deren Bedeutung entsprechend ihrer Leistungsfähigkeit bei der Behandlung und Nachsorge der Krebspatienten weiter wachsen wird. Nach einer Studie im Auftrag der Deutschen Gesellschaft für Hämatologie und Medizinische Onkologie (DGHO) stieg die Zahl der Vertragsärzte mit Schwerpunktbezeichnung Hämatologie und Onkologie von 2005 bis 2011 kontinuierlich an. 2011 verfügten 1.758 ambulant tätige Ärzte über eine Zusatz-Weiterbildung „Medikamentöse Tumortherapie“ – gegenüber 1.409 Krankenhausärzten [1].
Für viele Krankenhäuser und Arztpraxen ist die Teilnahme an einer klinischen Studie attraktiv. Sie ermöglicht einen frühen Zugang zu innovativen Therapien, wodurch sich das Behandlungsspektrum für die Patienten erweitert, und bietet Ärzten außerhalb von Universitätskliniken die Chance, wissenschaftlich zu arbeiten. Der Mehraufwand wird honoriert, was Folgeprojekten zugutekommen kann. Auch nach der Zulassung eines Arzneimittels ist Forschung erforderlich, zum Beispiel um das Therapieschema weiterzuentwickeln. Bei Investigator Initiated Trials (IIT) erfolgt die Finanzierung über Projektmittel, die die Wissenschaftler bei Ministerien oder forschungsfördernden Institutionen eingeworben haben. Kaum erforscht sind jedoch die Rahmenbedingungen, unter denen die Studien in den Zentren umgesetzt werden und ob die damit verbundenen Kosten über das Auftragsvolumen gedeckt sind. Letzteres setzt voraus, dass der Aufwand für eine Studie systematisch erfasst wird.
Die Verwaltung von Studien
Zu Beginn einer Arzneimittelstudie steht die Feasibility-Prüfung, in der der Sponsor geeignete Prüfzentren auswählt. Ein Hauptkriterium ist die Anzahl der in Aussicht gestellten Probanden mit der entsprechenden Indikation. Des Weiteren dürften Vorerfahrungen mit den Prüfzentren Einfluss auf die Entscheidung nehmen. Hier fließt ein, ob die vorhandene Forschungsinfrastruktur erwarten lässt, dass das Zentrum den Qualitätsanforderungen an eine Studie gerecht werden kann. Ferner ist das Renommee der Ärzte relevant. Ausschlaggebend ist, ob ein Zentrum Potenzial hat, zur Meinungsbildung beizutragen. Prof. Dr. Hoda Tawfik, Vorstand der MagForce, beschreibt dies wie folgt: „Ärzte haben die Therapiehoheit, das bedeutet, dass sie bei der Entwicklung neuer Therapien involviert werden müssen. Sie müssen ihre Expertise und ihre Bedenken mit einbringen und eine innovative neue Therapie aktiv mittragen. Ohne die Involvierung dieser führenden Meinungsbildner lässt sich keine neue Therapie etablieren [2].“ Probleme entstehen, wenn die Kommunikation zwischen Prüfzentrum und Sponsor auf unterschiedlichen Annahmen basiert oder sich die Schätzungen nicht realisieren lassen, sei es, weil die Ein- und Ausschlusskriterien eng gefasst sind oder die Zahl der möglichen Probanden geringer ist als vermutet.
Die verwaltungstechnische Abwicklung einer klinischen Studie hat bislang erst wenig Beachtung gefunden. Nicht selten treffen David und Goliath aufeinander. Das Prüfzentrum erledigt die Abwicklung einer Studie neben seinen Kernaufgaben in der Patientenversorgung. Das Pharmaunternehmen bzw. die beauftragte Clinical Research Organisation (CRO) verfügt hingegen über personelle und sachliche Ressourcen, die ein professionelles Management der Projektverläufe erlauben. Einen fundierten Einblick in die beiden Seiten der klinischen Forschung gab Sandra Albrecht, Beraterin für Prüfzentren, auf dem Study Nurse Meeting beim Kongress der Deutschen Hautkrebsgesellschaft 2014 (12. ADO-Jahrestagung, s. Abb. 1).
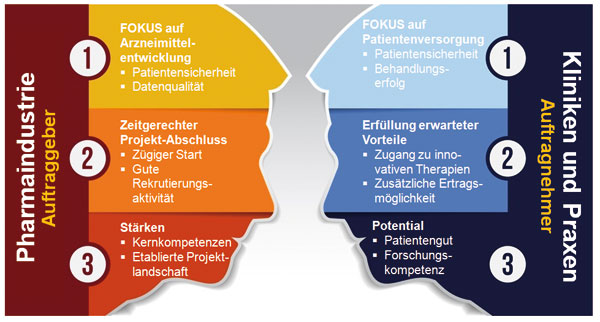
In den Prüfzentren obliegt die Studienverwaltung in der Regel der Study Nurse. In größeren Prüfzentren sind zudem Studienkoordinatoren tätig. Die Rahmenbedingungen ihrer Arbeit sind selten attraktiv. Sofern die Zentren zusätzliches Personal einstellen, sind die Arbeitsverträge üblicherweise für die Dauer einer Studie befristet. Die Verwaltungsdaten werden via Excel-Tabellen erfasst. Strukturierte Fortbildungsprogramme für das Verwaltungsmanagement einer klinischen Studie sind rar. Lediglich die Teilnahme an einer Schulung zur Good Clinical Practice (GCP) ist etabliert. Die Pflicht zur Einhaltung der GCP-Richtlinien ist gesetzlich verankert und liegt in der Verantwortung der Prüfärzte.
„Ob eine Studie kostendeckend durchgeführt werden kann, ist den meisten Zentren unbekannt“, sagt Beraterin Albrecht, die teils im Auftrag der Pharmaindustrie, teils im Auftrag der Prüfzentren tätig wird. Aus betriebswirtschaftlicher Sicht wäre es erforderlich, den Ressourcenbedarf für Dritte nachvollziehbar zu quantifizieren. Zudem müssen die Prozesse sowohl an der Schnittstelle zum Sponsor als auch an den innerbetrieblichen Schnittstellen so organisiert sein, dass sie einen reibungslosen Ablauf einer Studie ermöglichen. Albrecht hebt in ihrem Vortrag die Notwendigkeit von Standard Operating Procedures (SOP) hervor, um Fehler durch vorausschauendes Handeln vermeiden zu können. Sie plädiert für ein Qualitätsmanagement-System, in dem die wichtigsten Prozesse verschriftlicht sein müssen. Die Grundsätze der guten klinischen Praxis sehen vor, dass Systeme und Maßnahmen eingeführt werden sollten, die die Qualität jedes Aspektes der klinischen Forschung gewährleisten [3]. Welche SOP für die pharmazeutischen Unternehmen, respektive die CRO, relevant sind, stellt die folgende Übersicht dar:
„Während Pharmahersteller verpflichtet sind, ein QM-System zu haben, finden wir in den Kliniken für den Bereich der klinischen Forschung noch keinen flächendeckenden Einsatz oder überhaupt eine vergleichbare Definition, was mindestens vorhanden sein sollte“, sagt Albrecht. Doch selbst wenn ein Krankenhaus oder eine Arztpraxis über alle notwendigen Voraussetzungen verfügt, um als geeignetes Prüfzentrum wahrgenommen zu werden, bedeutet dies nicht, dass es jeder Anfrage nachkommt. Albrecht weiter: „Das Prüfzentrum entscheidet unter anderem danach, ob ein wissenschaftliches Interesse vorliegt und ob sich das Vorhaben in die bestehenden Prozesse integrieren lässt.“ Wenn die Entscheidung für eine Studie gefällt ist, gilt es, diese erfolgreich umzusetzen, gleich ob IIT oder Auftragsstudie. Das bedeutet, genügend Patienten einzuschließen und deren Krankheitsverläufe unter der Studienmedikation bzw. in der Kontrollgruppe systematisch über den gesamten Zeitraum der Studie zu verfolgen.
Dr. Adelheid Weßling
Literatur
1. DGHO (Hrsg.): Herausforderung demografischer Wandel. Bestandsaufnahme und künftige Anforderungen an die onkologische Versorgung, Gesundheitspolitische Schriftenreihe der DGHO Band 1, Berlin 2013.
2. Goingpublic.de Das Kapitalmarktportal: Vergangenheitsbewältigung bei MagForce, Interview mit Prof. Dr. Tawfik von MagForce auf der 16. Münchener Kapitalmarktkonferenz 2013 www.goingpublic.de/vergangenheitsbewaeltigung-bei-magforce/.
3. Leitlinie zur guten klinischen Praxis, Abschnitt 2.13, ICH E6/GCP-Leitlinie 1996, Stand 2002.
4. Schnurr B et al. Qualitätssicherung in der klinischen Prüfung. Pharm Ind 2004; 66: 1086-9.
24. Deutscher Hautkrebskongress (ADO-Jahrestagung), 11.-13. September 2014, Frankfurt/Main.

