Liquid Biopsy: Zählung und Charakterisierung zirkulierender Tumorzellen im Blut*
Hochempfindliche Analyseverfahren erlauben die Untersuchung zirkulierender Tumorzellen in Blutproben. Diese Liquid Biopsy gewinnt zunehmend an Bedeutung, denn sie ist nicht-invasiv und erlaubt Aussagen über die Entstehung von Metastasen sowie das Ansprechen auf eine antimetastatische Therapie. Die analytische Reproduzierbarkeit ist allerdings für quantitative Aussagen noch unbefriedigend, deshalb liegt ihre Domäne in qualitativen Aussagen, etwa über das Auftreten neuer Mutationen, die im Primärtumor nicht gefunden wurden.
Erstmals beschrieben wurden zirkulierende Tumorzellen 1869 durch den australischen Arzt Thomas Ashworth, der in Blut aus der Beinvene eines Krebspatienten Zellen mit großen Kernen fand, die offenbar mit denen im Primärtumor verwandt waren. Ashworth ahnte damals bereits, dass er etwas Wegweisendes entdeckt haben könnte – zu einer Zeit, als viele Ärzte Krebs noch für einen eigenständigen Parasiten hielten. Er schrieb, die von ihm entdeckten Zellen könnten „Licht auf die Entstehung multipler Tumoren in ein und derselben Person werfen“.
Wir wissen heute, dass zirkulierende Tumorzellen (CTC = circulating tumour cells) in Blut und Lymphe tatsächlich der Ausgangspunkt jener Metastasen sind, an denen die meisten Krebspatienten sterben. Dass das nach wie vor nur spärliche klinische Konsequenzen für die onkologische Diagnostik und Therapie hat, liegt in erster Linie an der verschwindend geringen Zahl von Tumorzellen im Blut: Eine einzige CTC pro Milliliter wird bereits als prognostisch ungünstiges Zeichen gewertet, und diese eine Zelle zirkuliert im Blut gemeinsam mit Millionen von Leukozyten und Milliarden von Erythrozyten. Als Richtwert bei metastasierenden Karzinomen gilt ein Verhältnis von CTC zu allen anderen kernhaltigen Zellen im peripheren Blut von 1:106 bis 1:107.
Suche nach „Nadel im Heuhaufen“
Man kann die Suche nach der „Nadel im Heuhaufen“ auf zwei verschiedenen Wegen betreiben: durch Anreicherung der gesuchten Tumorzellen oder durch Entfernung der unerwünschten Blutzellen, etwa durch Ausfällung von Leuko- und Erythrozyten (RossetteSep-Test). Beide Methoden erhöhen den CTC-Anteil so weit, dass er nicht im Grundrauschen der Nachweisverfahren wie Durchflusszytometrie oder Genotypisierung untergeht. Allerdings schwanken die Ausbeuten der verschiedenen Techniken zwischen etwa 10% und 90%, sodass die Interpretation quantitativer Resultate mit Vorsicht und Sachkenntnis erfolgen muss. Eine kritische Bewertung auch seit langem etablierter Tests findet sich in zwei aktuellen Reviews [1, 2].
Die Liquid Biopsy liefert als wichtigstes Ergebnis die Zahl der CTCs pro ml Blut. Sie hilft, das Ausmaß des Primärtumors und die Metastasierungsneigung abzuschätzen. Aus den oben genannten Gründen sind relative Änderungen allerdings aussagekräftiger als absolute Zahlen: Ein Verschwinden der CTC nach Operation oder medikamentöser Behandlung kann als Therapieerfolg gewertet werden, ein Anstieg im Verlauf der Erkrankung kann eine Verschlechterung anzeigen und Anlass sein, die Therapiestrategie zu ändern.
Methodische Validierung erforderlich
Eine weitere Charakterisierung der CTCs mit molekulargenetischen, immunchemischen und mikroskopischen Verfahren vertieft nicht nur das Verständnis der Tumorbiologie, sondern gibt auch Hinweise auf das Vorhandensein therapeutisch wichtiger Oberflächenmarker wie etwa HER2. Für einige häufige Malignome wie etwa Mamma-, Kolon-, Lungen- oder Prostatakarzinome liegen erste Studien vor, die die klinische Relevanz des Nachweises und der Charakterisierung von CTCs belegen (Übersicht s. in [3]).
Eine klinische Validierung zum Einsatz bei der Risikostratifizierung oder beim Monitoring von Medikamenten bei einer bestimmten Tumorart erfordert große Patientenzahlen, also in der Regel multizentrische Studien. Allein zum Mammakarzinom laufen am Nationalen Centrum für Tumorerkrankungen (NCT) in Heidelberg derzeit 13 klinische Evaluationen von zirkulierenden und disseminierten Tumorzellen aus Blut und Knochenmark (CTC, DTC), um den Nutzen dieser Methoden für Diagnostik und Therapieoptimierung zu prüfen.
Bereits 2004 erteilte die US-amerikanische Food and Drug Administration (FDA) dem CellSearch-Test zur Zellzählung und Verlaufsvorhersage beim metastasierten Brustkrebs die Zulassung, 2007/2008 wurde sie auf Darm- und Prostatakrebs ausgeweitet. Gründe für die zögerliche Durchsetzung in Deutschland sind mangelnde Standardisierung (Kontrollmaterialien, Ringversuche) sowie eingeschränkte bis fehlende Abrechnungsmöglichkeiten. Die gesetzliche Krankenversicherung übernimmt die Kosten für die CTC-Analyse derzeit noch nicht, aber im Rahmen von Studien ist eine Erstattung möglich. Ob die medizinische Aussage den Selbstzahler-Preis von derzeit 460 € rechtfertigt, müssen Arzt und Patient(in) allerdings sorgfältig abwägen: Wenn in einer 7,5-ml-Probe fünf oder mehr Tumorzellen gefunden werden, verringert sich das progressionsfreie Intervall beim metastasierten Mammakarzinom im Median von 7,0 auf 2,7 Monate und die Gesamtüberlebenszeit von 18 auf zehn Monate [1].
Epithelial-mesenchymale Transition
Das Anreicherungsverfahren von CellSearch und anderen etablierten Kits basiert auf der immunologischen Erkennung des Oberflächenmarkers EpCAM (Epithelial Cell Adhesion Molecule), kombiniert mit einer Antikörpermixtur gegen intrazelluläre Cytokeratine, insbesondere CK 8, 18 und 19. Für die Isolierung von Karzinomzellen, deren molekulare Ausstattung derjenigen des Primärtumors ähnlich ist, eignet sich dieser Cocktail gegen epitheliale Marker prinzipiell gut, doch um in die Blutbahn zu gelangen und dort zu überleben, müssen die CTC eine epithelial-mesenchymale Transition (EMT) durchlaufen mit bedeutenden Änderungen der Genexpression und Zellmorphologie (Abb.): Die von den Anreicherungsverfahren erkannten Adhäsionsmoleküle und Cytokeratine nehmen ab, und andere Marker, etwa Vimentin und Matrix-Metallo-Proteasen steigen an. Durch diese Umwandlung des Phänotyps können folglich potenziell interessante CTC übersehen werden.
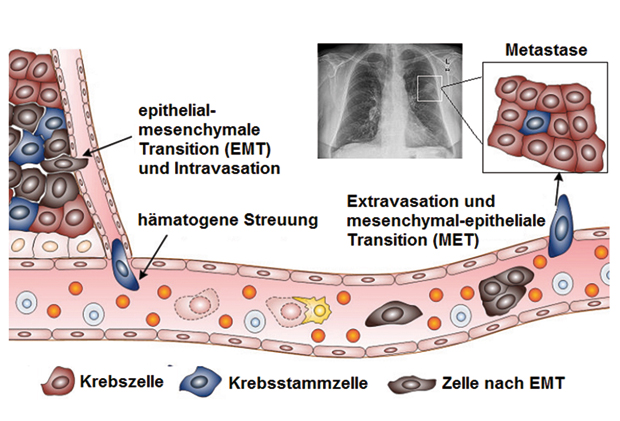
Abhilfe schaffen Methoden, die zusätzlich EMT-typische Marker erfassen oder physikalische Tumorzell-Eigenschaften wie Größe, Dichte, Plastizität und elektrische Polarisierbarkeit nutzen. Große Hoffnungen setzt man auf Mikrofluidik-Chips, die im Durchflussverfahren (continuous flow) betrieben werden und verschiedene an- und abreichernde Trennverfahren kombinieren [4]. Mit ihnen lassen sich hohe Ausbeuten an intakten Tumorzellen erzielen, die dann weiter biochemisch und pharmakologisch charakterisiert werden können.
Können nur Tumorstammzellen erfolgreich metastasieren?
Offenbar fördert Sauerstoffmangel im Primärtumor über die Aktivierung des Hypoxie-induzierbaren Faktors (HIF) die Auswanderungsbereitschaft einzelner Zellen. Zudem macht die oben beschriebene EMT die „Auswanderer“ aggressiver und versetzt sie in die Lage, die endotheliale Barriere der angrenzenden Tumorgefäße zu durchbrechen. Die in der Blutbahn zirkulierenden Tumorzellen sind allerdings den Angriffen des Immunsystems ausgesetzt, sodass 99,9% innerhalb von 24 Stunden absterben (sog. Anoikis).
Von den überlebenden 0,1% hat nur etwa jede zehnte das Potenzial, die Gefäßwand in umgekehrter Richtung erneut zu durchdringen, sich in einen epithelialen Krebszelltyp zurückzuverwandeln (Abb.) und in fremder Umgebung anzusiedeln. Um zu diesen erfolgreichen 0,01% zu gehören, müssen die Tumorzellen neben den mesenchymalen Merkmalen offenbar auch noch Stammzelleigenschaften haben. Die Entwicklung von CTC-Tests wird dadurch zusätzlich erschwert, denn der ohnehin schon extrem geringe Anteil von Krebszellen im Blutverringert sich dadurch womöglich nochmals um einige Zehnerpotenzen.
Die CTC-Analyse ist für sich allein genommen wenig aussagekräftig. Findet man erhöhte Werte, ist die parallele Untersuchung von Geweben aus Primärtumoren und Metastasen mit histopathologischen und molekularbiologischen Verfahren unabdingbar. Deshalb erfordert die Liquid Biopsy noch stärkere Interdisziplinarität zwischen Klinikern, Pathologen und Molekulardiagnostikern in der Behandlung onkologischer Patienten als bisher.
*Dieser Artikel ist ein gekürztes Update der Titelgeschichte „Auf der Suche nach den schwarzen Schafen“ aus Trillium Diagnostik 2013; 11(3): 140-143.
Literatur
1. Millner L et al. Circulating tumor cells: A review of present methods and the need to identify heterogeneous phenotypes. Ann Clin Lab Sci 2013; 43: 295-304.
2. Esmaeilsabzali H et al. Detection and isolation of circulating tumor cells: Principles and methods. Biotechnol Adv 2013; dx.doi.org/10.1016/j.biotechadv.2013.08.016.
3. YapTA et al. Circulating tumor cells: A multifunctional biomarker. Clin Cancer Res 2014; 20: 2553-68.
4. Wong IY et al. Collective and individual migration following the epithelial-mesenchymal transition. Nat Mat 2014; Aug 17 [prepub ahead of print, DOI: 10.1038/nmat4062.

Prof. Dr. Georg Hoffmann, Herausgeber
Trillium GmbH
Jesenwanger Str. 42 b, 82284 Grafrath
Georg.hoffmann[at]trillium[dot]de

