Erhaltungstherapie beim nicht-kleinzelligen Lungenkarzinom
Der Fall
Bei der Patientin (Jahrgang 1944) wurde im November 2008 im Alter von 64 Jahren erstmals ein Lungentumor entdeckt, der histologisch als nicht-kleinzelliges Lungenkarzinom (NSCLC) – und zwar als Adenokarzinom mit einem bronchoalveolären Wachstumsmuster – charakterisiert wurde. Das Staging ergab ein Stadium cT4N0cM1a, d. h. einen separaten Tumor in der kontralateralen Lunge. Der Tumor war positiv für eine Überexpression von TTF1 (Thyroid Transcription Factor 1 (Immunhistochemie)) und für KRAS-Mutationen und negativ für EGFR-Mutationen ebenso wie für eine AML4-ALK-Translokation.
Verlauf
Von Dezember 2008 bis März 2009 hatte die Patientin an der randomisierten Phase-II-Studie INNOVATIONS teilgenommen (Erlotinib/Bevacizumab vs. Cisplatin/Gemcitabin in der Erstlinientherapie des Nicht-Plattenepithel-NSCLC). Sie war in den Arm mit der Erlotinib/Bevacizumab-Therapie randomisiert worden, unter der sie allerdings progredient gewesen war. Als sie daraufhin in unsere Klinik zur Weiterbehandlung kam, lag ihr Karnofsky-Performancestatus bei 70, d. h. sie war zur Selbstversorgung, nicht aber zu normaler körperlicher Aktivität und Arbeit fähig. Der Body Mass Index lag bei einer Größe von 161 cm und einem Körpergewicht von 64 kg im oberen Normalbereich (24,7). Die Kreatinin-Clearance war bei einem Serum-Kreatinin-Wert von 0,55 mg/dl mit 104 ml/min (nach Cockroft-Gault) normal. Am 20. Mai 2009 rief die Patientin wegen starker Schmerzen und einer „schrecklichen“ Nacht an. 40 Tropfen Tramadol brachten Besserung, allerdings gefolgt von Übelkeit. Diese wurde erfolgreich mit Metoclopramid behandelt, und da sie zuvor keine Chemotherapie erhalten hatte, war die Behandlung mit Cisplatin/Pemetrexed, die am 27. Mai mit dem ersten Zyklus begonnen wurde, definitionsgemäß eine Erstlinien-Chemotherapie. Am 9. Juni gab die Patientin an, sich sehr wohl zu befinden und „so gut wie keine Nebenwirkungen“ zu verspüren. Geringe Übelkeit am 1. Juli besserte sich wieder mit Metoclopramid, Beschwerden in der Speiseröhre reagierten gut auf Hydrotalcit. Übrig blieb lediglich ein metallischer Geschmack im Mund. Am 21. Juli konnte in der Computertomografie ein Tumorregress nachgewiesen werden, sodass gemäß der S3-Leitlinie [1] eine Fortführung der Therapie über sechs Zyklen indiziert war. Abb. 1 zeigt das CT vom 20.9.2009.
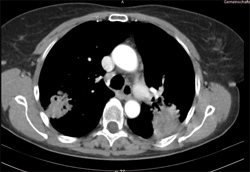
Die Patientin war danach beschwerdefrei und wünschte eine Fortsetzung der Therapie. Laut Leitlinie ist im Anschluss an die Erstlinien-Chemotherapie eine Erhaltungstherapie mit Pemetrexed oder Erlotinib möglich. Da sie auf die Initialtherapie mit Erlotinib/Bevacizumab nicht, auf Cisplatin/Pemetrexed aber sehr gut angesprochen hatte, wurde daher mit der Patientin eine Pemetrexed-Monotherapie vereinbart, die sie ab dem 7. Oktober 2009 erhielt. Eine CT-Kontrolle am 3. November zeigte einen weiteren Tumorregress, und unter der Fortsetzung der Erhaltungstherapie besserte sich schrittweise auch der Allgemeinzustand: Im Januar 2010 lag der Karnofsky-Index bei 80, d. h. normale Aktivität war mit Anstrengung möglich bei weiterhin bestehender Symptomatik und einem Körpergewicht von nunmehr 70,4 kg. Im Mai 2010 war der Karnofsky-Index auf 90 angestiegen (d. h. Fähigkeit zu normaler Aktivität, kaum oder nur geringe Symptome).
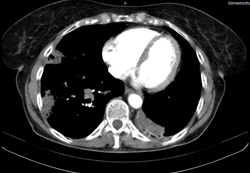
Am 9. August 2011, also beinahe zwei Jahre nach Beginn, wurde der
32. Zyklus Pemetrexed verabreicht. Die Kreatinin-Clearance war nun allerdings auf 45 ml/min gesunken, bei einem Serum-Kreatinin-Wert von 1,34 mg/dl. Der letzte Zyklus Pemetrexed wurde nach mehr als vier Jahren am 24. Oktober 2013 gegeben; vier Monate vorher hatte sich im CT eine anhaltend gute Rückbildung gezeigt (Abb. 2). Der Karnofsky-Index lag nun wieder bei 60, die Patientin benötigte einige Hilfestellung, war aber in den meisten Bereichen selbständig. Als Ko-Therapie hatte sie während des gesamten Zeitraums lediglich eine Atemtherapie mit Krankengymnastik zur Kontrolle von Husten, Atemnot etc. erhalten sowie – da wir in einem anthroposophisch ausgerichteten Zentrum arbeiten – eine Misteltherapie. Die Patientin wurde mehrfach im Rahmen von pneumonischen Infekten stationär behandelt, ansonsten war sie stabil in befriedigendem Allgemeinzustand und lebte und versorgte sich allein zu Hause. Im Frühjahr 2014 kam es zu einem Progress, der eine erneute Therapie als Drittlinientherapie (Docetaxel) notwendig machte.
Diskussion
Patienten mit einem fortgeschrittenen Stadium (IIIB oder IV) eines NSCLC profitieren von einer First-line-Chemotherapie, die meist als Doublette gegeben wird, mit einer medianen Überlebensverlängerung von etwa zwei Monaten und einer klinisch relevanten Reduktion der führenden Symptome – das zeigte bereits in den 1990er-Jahren eine Metaanalyse von 52 randomisierten Studien [2]. Eine Platin-Komponente in der Chemotherapie war dabei obligat, ob die zweite Substanz ein Taxan oder Gemcitabin war, spielte keine Rolle [3]. Etwas später allerdings zeigte sich dann, dass bei Nicht-Plattenepithelkarzinomen der Antimetabolit Pemetrexed dem Gemcitabin als Partner des Platinsalzes mit einer hochsignifikanten Verlängerung des Gesamtüberlebens von 10,4 auf 11,8 Monate überlegen ist [4]. Das war die Basis für den Einsatz von Cisplatin/Pemetrexed bei unserer Patientin, die vorher keine Chemotherapie erhalten hatte, sondern im Rahmen einer klinischen Studie auf Erlotinib/Bevacizumab nicht angesprochen hatte.
Nach Ende einer solchen Erstlinientherapie stellt sich grundsätzlich die Frage, ob man einen Progress abwartet und dann eine Zweitlinientherapie gibt. Hier sind bei nicht mit Pemetrexed vorbehandelten Patienten Docetaxel und Pemetrexed hinsichtlich des Überlebensvorteil gleichwertig [5, 6]. Eine Alternative bei Patienten, die nach vier Zyklen Chemotherapie nicht progredient waren, ist eine Erhaltungstherapie mit Pemetrexed, entweder als „Switch“-Erhaltung nach nicht Pemetrexed-haltiger Chemotherapie oder als Fortführung nach Pemetrexed-haltiger Erstlinienbehandlung (z. B. [7]). Letzteres hat in der PARAMOUNT-Studie progressionsfreies und Gesamtüberleben gegenüber einer rein palliativen Therapie signifikant verlängert [8] und war in allen untersuchten Subgruppen gleich wirksam [9].
Die persönliche Erfahrung zeigt, dass großzellige Karzinome und Tumoren mit bronchoalveolärem Wachstumsmuster besonders gut auf dieses Erhaltungstherapie ansprechen. Diese Erfahrung bestärkte uns darin, dem Wunsch unserer Patientin nach einer Fortführung der Therapie nach Ende der Cisplatin/Pemetrexed-Behandlung nachzukommen. Das Ergebnis übertraf unsere Erwartungen bei Weitem und zeigt, dass die in klinischen Studien erzielten Medianwerte in Einzelfällen weit übertroffen werden können: In der PARAMOUNT-Studie hatten die Patienten median 7,9 Zyklen Pemetrexed erhalten und hatten median 3,9 Monate lang progressionsfrei und insgesamt 13,9 Monate lang überlebt [8]. Unsere Patientin hatte 47 Zyklen Pemetrexed bekommen und war darunter vom 20.05.09-24.10.2013 jahrelang progressionsfrei gewesen.
Fazit
Die beschriebene Kasuistik zeigt, dass auch in Zeiten der zielgerichteten Therapien klassische Zytostatika noch längst nicht ausgedient haben. Die Patientin mit Nicht-Plattenepithelkarzinom der Lunge mit bronchoalveolärem Wachstum, die unter einer Kombination aus EGF-Rezeptor-Inhibitor und anti-angiogenetischem Antikörper progredient gewesen war, sprach auf die Kombination aus Cisplatin und Pemetrexed bereits nach zwei Zyklen an, sodass diese Therapie leitliniengemäß über die vollen sechs Zyklen fortgeführt werden konnte – bei sehr guter Verträglichkeit. Dieses gute Ansprechen, die hervorragende Verträglichkeit und die vorteilhafte Histologie erleichterte auch die Entscheidung für die Fortführung der Pemetrexed-Behandlung als Erhaltungstherapie, die durch das Ergebnis in vollem Umfang gerechtfertigt wurde.
Literatur
1. www.dgho-onkopedia.de/de/
onkopedia/leitlinien/lungenkarzinom-nicht-kleinzellig-
nsclc#zweitlinientherapie
2. Stewart LA et al. Br Med J 1995; 311: 899-909.
3. Schiller JH et al. N Engl J Med 2002; 346: 92-9.
4. Scagliotti GV et al. J Clin Oncol 2008;
26: 3543-51.
5. Shepherd FA et al. J Clin Oncol 2000;
18: 2095-103.
6. Hanna N et al. J Clin Oncol 2004; 22: 1589-97.
7. Socinski MA et al. Chest 2013;
143 (Suppl 5): e341S-68S.
8. Paz-Ares LG et al. J Clin Oncol 2013;
31: 2895-902.
9. Reck M et al. J Thorac Oncol 2014; 9: 205-13.
Burkhard Matthes
Facharzt für Innere Medizin
mit Schwerpunkt Onkologie
MVZ Havelhöhe
Kladower Damm 221
14089 Berlin
praxis-matthes[at]email[dot]de

