Was erwartet uns in der nächsten WHO-Klassifikation?
Konsensuskonferenz der Internationalen Gesellschaft für Uropathologie (ISUP) zu Nieren-Neoplasien
Das Nierenzellkarzinom macht etwa 2% aller menschlichen Malignome aus und gehört mit weltweit etwa 190.000 Neuerkrankungen pro Jahr zu den eher seltenen Tumorerkrankungen. Obwohl bereits vor über 200 Jahren der erste Fall von „Nierenkrebs“ beschrieben wurde, gab es erst in den letzten 30 Jahren entscheidende Fortschritte in unserem Verständnis des breiten Spektrums dieser Erkrankung. In der 1981 erschienenen Ausgabe der WHO-Klassifikation der Nierentumoren wurden lediglich 9 verschiedene Entitäten beschrieben, während die letzte 2004 erschienene Ausgabe bereits 50 Entitäten umfasst [1].
Das zunehmende Verständnis der molekularen Veränderungen der Nieren-Neoplasien führt zu einer Differenzierung immer weiterer neuer Typen mit Alleinstellungsmerkmalen, welche die Definition als neue Entitäten rechtfertigen. Parallel dazu beschäftigt man sich seit langer Zeit in Studien mit möglichen prognostischen und prädiktiven Parametern.
Die Internationale Gesellschaft für Uropathologie (ISUP) ist das internationale Expertengremium, das seit seiner Gründung vor über 20 Jahren die diagnostischen Standards für urologische Tumoren und Tumoren des männlichen Genitaltraktes formuliert. Dazu wurden seit 1998 vier Konsensuskonferenzen abgehalten. Die letzte fand 2012 in Vancouver statt und beschäftigte sich mit allen Aspekten der Pathologie maligner Nierenerkrankungen des Erwachsenen. Die Ergebnisse dieser Konferenz wurden im Oktober 2013 im American Journal of Surgical Pathology veröffentlicht und sind Grundlage der nächsten Ausgabe der WHO-Klassifikation urogenitaler Tumoren.
Vier Arbeitsgruppen beschäftigten sich mit den folgenden vier Kernthemen:
1. Klassifikation [2]
2. Grading und andere Prognose-
faktoren [3]
3. Handling und Staging [4]
4. Diagnostische und prognostische Bio-
marker [5].
Klassifikation
Neu definierte Entitäten
Es wurden fünf neue Entitäten definiert (s. Tabelle 1):

Klarzelliges (tubulo-)papilläres Nierenzellkarzinom
Das klarzellige (tubulo-)papilläre Nierenzellkarzinom macht ca. 1% aller Nierenzellkarzinome aus und ist damit der häufigste der neu beschriebenen Typen. Er wurde primär bei Patienten mit Nierenerkrankungen im endstadium beschrieben, der weitaus größte Teil der Fälle tritt jedoch sporadisch auf. Das Präsentationsalter ist ähnlich dem der bekannten RCC-Typen (mittleres Alter 60 Jahre), und es zeigt eine in etwa ausgewogene Geschlechterverteilung.
Typischerweise sind diese Tumoren gut umschrieben, z. T. bekapselt, und treten unizentrisch und unilateral auf. Multifokalität und Bilateralität sind selten. Der größte in der Literatur beschriebene Tumor maß 6 cm.
Histologisch zeigen sie ein teils tubuläres/azinäres, zystisches und/oder papilläres Baumuster (vgl. Abb. 1). Die neoplastischen Zellen haben ein helles Zytoplasma und per definitionem einen niedrigen Kerngrad (Grad 1 oder 2). Typischerweise sind die kleinen, uniformen Zellkerne nicht basal, sondern apikal ausgerichtet.
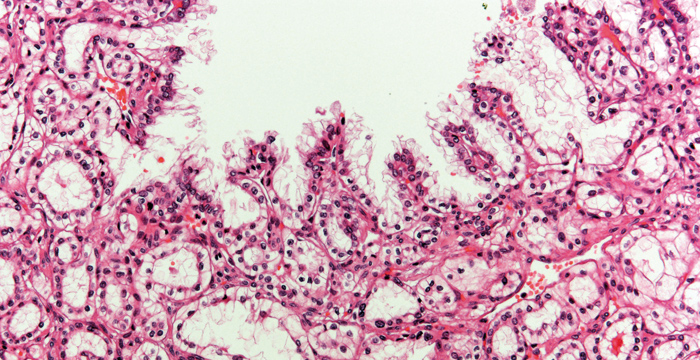
Das immunhistochemische Expressionsprofil ist sehr typisch für diesen Tumor: Die Färbung gegen CK7 fällt in nahezu 100% der Zellen stark positiv aus. Weiterhin exprimieren die Zellen membranös CA-IX, wobei charakteristisch ist, dass die luminale Zellgrenze ausgespart bleibt („cup-shaped“). Die Färbungen gegen CD 10, Racemase (AMACR) und RCC sind meistens negativ (vgl. Abb. 2). Somit lassen sich die klarzelligen (tubulo-)papillären Karzinome gut von klarzelligen und papillären Nierenzellkarzinomen abgrenzen. Auch molekularpathologisch liegen die für die beiden letztgenannten Tumoren typischen Veränderungen wie eine VHL-Gen-Mutation oder Trisomien der Chromosomen 7 und 17 nicht vor.
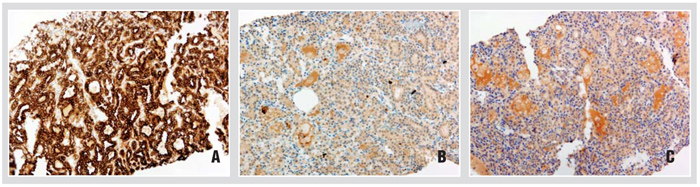
Die Anzahl der Fälle mit einem längeren klinischen Follow-up ist sehr klein, jedoch wurde hier noch kein Fall mit einer Metastasierung beschrieben, sodass es sich wahrscheinlich um Neoplasien mit indolentem klinischem Verlauf handelt.
Tubulozystisches Nierenzellkarzinom
Die Definition dieser Neoplasie beruht auf dem Konzept eines „low-grade“-Sammelrohrkarzinoms in der Literatur. Bereits 1956 wurde in einem Textbuch von Masson ein Tumor mit dieser Morphologie beschrieben und als „Bellini-Epitheliom“ bezeichnet. In den letzten Jahren wurden drei größere Serien publiziert, die die Basis für eine Beschreibung als eigene Entität darstellen. Das mittlere Patientenalter liegt bei 60 Jahren; auffällig ist die starke Prädominanz des männlichen Geschlechts mit einer Verteilung männlich:weiblich von ≥ 7:1.
Tubulozystische Nierenzellkarzinome werden in der Regel in einem niedrigen Tumorstadium entdeckt und sind gut umschrieben, z. T. auch bekapselt. In der Bildgebung imponieren sie meistens als komplexe Zysten (häufig Typ 3 oder 4 in der Klassifikation nach Bosniak). Dazu passt die makroskopisch schwammige Schnittfläche und die Mikroarchitektur mit einer Kombination aus kleinen, mittelgroßen oder zystisch dilatierten größeren Tubuli. Diese werden ausgekleidet von einem Epithel mit eosinophilem Zytoplasma und atypischen Zellkernen mit prominenten Nukleoli (Kerngrad 3), die häufig knopfförmig in die Lumina vorragen. Das Stroma ist meistens zellarm und fibrosiert, gelegentlich mit wenigen Entzündungszellen.
Immunhistochemisch zeigen die Tumorzellen eine positive Färbung für CD 10 und Racemase, für CK8, CK18 und 19 und gelegentlich für CK7. Weniger als die Hälfte der Fälle ist positiv für PAX2 und CA-IX.
Auf molekularer Ebene zeigen die tubulozystischen Nierenzellkarzinome eher Ähnlichkeiten mit den papillären RCC als mit den Sammelrohrkarzinomen.
Der größte Anteil dieser Karzinome (> 90%) zeigt ein indolentes Verhalten, wobei die diagnostischen Kriterien streng eingehalten werden sollten: tubulozystische Abschnitte in ansonsten typischen papillären Karzinomen oder Sammelrohrkarzinomen fallen nicht unter diese Entität. Es wurden einzelne Fälle mit Rezidiv und Metastasen in pelvinen Lymphknoten, Leber und Knochen beschrieben, sodass eine Tumornachsorge angezeigt ist.
Aquired Cystic Disease-assoziiertes Nierenzellkarzinom
Das Aquired Cystic Disease-assoziierte Nierenzellkarzinom ist der häufigste Nierenzellkarzinom-Typ in Endstadiumsnieren, im Speziellen bei erworbenen zystischen Nierenerkrankungen. Es ist meistens ein radiologischer Zufallsbefund im Rahmen des Follow-up bei fortgeschrittenen chronischen Nierenerkrankungen. In einigen Publikationen wird eine Assoziation zur Langzeitdialyse (> 10 Jahre) beschrieben. Der Tumor tritt in > 50% der Fälle multifokal und in > 20% der Fälle bilateral auf und stellt sich häufig als solider tumoröser Herd in Bezug zu einer Zystenwand dar.
Histologisch weist das Karzinom eine azinäre, zystische, papilläre oder solide Architektur auf und kann zumindest abschnittsweise an ein papilläres Nierenzellkarzinom vom Typ II erinnern. Charakteristisch sind hier jedoch ein siebartiges/kribriformes Baumuster und der intratumoröse Nachweis von Oxalat-Kristallen.
Immunhistochemisch wird eine diffuse Positivität in der Färbung gegen Racemase bei sehr unterschiedlichen Reaktionsmustern der übrigen RCC-typischen Marker beschrieben, aber es gibt kein typisches immunhistochemisches Expressionsprofil.
Die Prognose dieses Karzinoms ist zumeist gut, da es häufig früh im Rahmen des regelmäßigen Follow-up bei Patienten mit chronischen Nierenerkrankungen diagnostiziert wird. Es ist aber in diesem Setting im Vergleich zu anderen auftretenden Karzinom-Typen das aggressivste.
Nierenzellkarzinom mit Translokationen der MiT-Familie von Transkriptionsfaktoren (einschließlich t(6;11)-Translokation (TFEB))
Neben dem bereits bekannten Nierenzellkarzinom mit Xp11.2-Translokation (TFE3), wurde jetzt ein neues Translokations-Karzinom beschrieben: Hier liegt eine t(6;11)(p21;q12)-Translokation vor, die zu einer Alpha-TFEB-Gen-Fusion führt, die immunhistochemisch oder mittels FISH nachgewiesen werden kann. Die Patienten sind typischerweise im jungen Erwachsenenalter (mittleres Alter 28,5 Jahre).
Neben einer charakteristischen biphasischen Morphologie ist bei diesem Tumor eine immunhistochemische Positivität für melanozytäre Marker wie HMB-45 und Melan-A typisch, während die Färbungen für epitheliale Marker wie Pan-Cytokeratin negativ oder allenfalls fokal positiv ausfallen. Die renale Differenzierung kann mit einer (nahezu immer positiven) immunhistochemischen Färbereaktion gegen PAX8 gesichert werden.
Von den bislang 30 beschriebenen Fällen wiesen drei Metastasen auf und führten zum Tod der Patienten.
Nierenzellkarzinom bei hereditärem Leiomyomatose-/RCC-Syndrom (HLRCC)
Das Nierenzellkarzinom bei hereditärem Leiomyomatose-/RCC-Syndrom ist keine „neue“ Entität im eigentlichen Sinne. Es wird in der momentan noch gültigen WHO-Klassifikation von 2004 unter der Rubrik der hereditären Nierenzellkarzinome geführt und stellt sich morphologisch als papilläres Nierenzellkarzinom vom Typ 2 dar.
Im Gegensatz zu den meisten anderen papillären Nierenzellkarzinomen tritt es aber typischerweise solitär und unilateral auf, zeigt ein ungewöhnlich aggressives Verhalten und eine spezifische Genmutation, sodass eine Einordnung als eigene Entität gerechtfertigt erscheint.
Bei dem autosomal-dominant vererbten HLRCC-Syndrom liegt eine Keimbahnmutation im Fumarat-Hydratase Gen auf Chromosom 1q42 vor. Diese führt bei den Betroffenen zu kutanen und uterinen Leiomyomen und Nierenzellkarzinomen. Die uterinen Leiomyome sind häufig schwer beherrschbar, sodass bei ca. 50% der Frauen eine Hysterektomie noch vor dem 30. Lebensjahr notwendig ist.
Der Nachweis der Genmutation bei Verdacht auf das Syndrom ist entscheidend für das weitere Patienten-Management und das Follow-up von Familienmitgliedern. Beispielsweise werden hier bereits bei kleinen Nierentumoren (< 3 cm) sehr engmaschige Kontrollen erfolgen und die Indikation zu einer Operation wesentlich früher gestellt werden müssen, als das bei Patienten mit anderen hereditären RCC-Syndromen üblich ist.
Die Prognose ist jedoch aufgrund des aggressiven Tumorverhaltens schlecht. Der größte Teil der untersuchten Patienten präsentierte sich bereits mit fortgeschrittenen Stadien und starb an dieser Erkrankung.
Wichtigste Neuerungen bzw. Modifikationen bei bereits bekannten Entitäten
Multilokulär-zystisches Nierenzellkarzinom/Multilokulär-zystische Nierenneoplasie mit niedrig-malignem Potenzial
Auf das multilokulär-zystische Nierenzellkarzinom entfallen ca. 4% der klarzelligen Nierenzellkarzinome. Die Definitionskriterien sind streng: Die WHO-Klassifikation beschreibt hier einen gut umschriebenen Tumor, der ausschließlich aus Zysten unterschiedlichen Durchmessers besteht. Diese werden ausgekleidet durch Zellen mit hellzelligem Zytoplasma und kleinen uniformen Zellkernen, die sich herdförmig auch in den Zysten-Septen finden (vgl. Abb. 3). Solide Tumoranteile dürfen per definitionem nicht vorliegen.
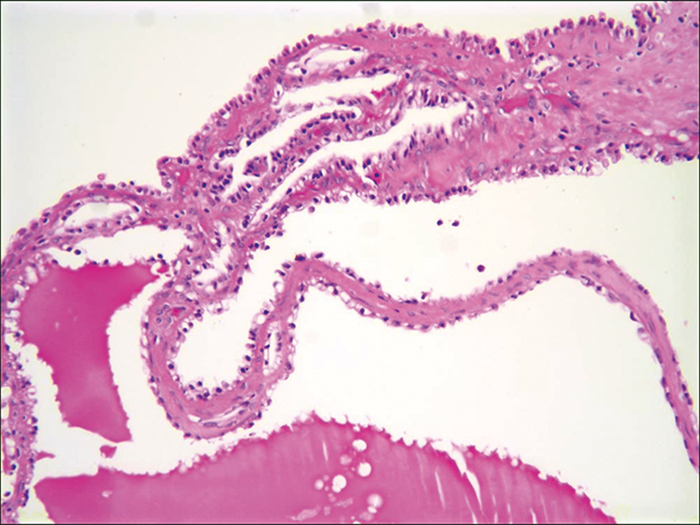
Zahlreiche Publikationen mit > 200 Patienten und einer Nachbeobachtungszeit von mehr als fünf Jahren zeigten keinerlei Rezidive oder Metastasierungen, sodass in der Konsensuskonferenz beschlossen wurde, bei diesen Neoplasien den Begriff „Karzinom“ zu vermeiden und sie in Zukunft als „multilokulär-zystische Nierenneoplasie mit niedrig-malignem Potenzial“ zu bezeichnen.
Wichtige Differenzialdiagnosen sind das klarzellige Nierenzellkarzinom mit extensiven zystischen Veränderungen oder klarzellige RCCs mit extensiven zystischen Nekrosen, die nicht unter dieser Entität eingeordnet werden dürfen, da sie potenziell ein aggressives Verhalten zeigen können.
Unklar ist bisher, wie verfahren werden soll, wenn knotige Hyalinose-Herde in einem ansonsten nur zystischen Tumor gesehen werden, da diese auch regressiv veränderte Herde eines ansonsten konventionellen klarzelligen RCC darstellen könnten. Weiterhin unklar bleibt zum momentanen Zeitpunkt auch, ob für die Diagnose einer derartigen Neoplasie eine vollständige Einbettung des Tumors notwendig ist, und ob die Neoplasie gegradet werden sollte.
Sammelrohrkarzinome (Ductus Bellini-Karzinome)
In der Konsensuskonferenz wurden die bereits zum größten Teil in der WHO-Klassifikation von 2004 genannten Kriterien für die Diagnose eines Sammelrohrkarzinomes bestätigt. Der Tumor sollte folgende Charakteristika aufweisen: 1. Medulläre Lage zumindest eines Teils der Läsion; 2. Prädominantes tubuläres Baumuster; 3. Infiltratives Wachstum; 4. Stroma-Desmoplasie;
5. Hoher Kerngrad (vgl. Abb 4).
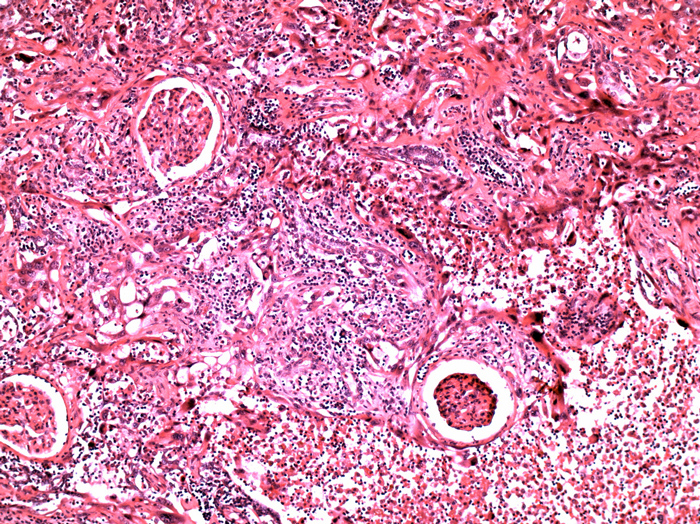
Genauer definiert wurden die Tumoren, die zu > 95% die Charakteristika eines Sammelrohrkarzinomes aufweisen, aber auch fokal ein Urothelkarzinom zeigen. Diese sollen in Zukunft als „Urothelkarzinome mit prominenter glandulärer Differenzierung“ bezeichnet werden. Weiterhin sollen weitgehend undifferenzierte Karzinome, die zumindest herdförmig die Kriterien für ein Sammelrohrkarzinom erfüllen, als Sammelrohrkarzinome und nicht als nicht klassifizierbare Karzinome eingeordnet werden.
Da Sammelrohrkarzinome generell „high-grade“-Tumoren darstellen, sollte auf ein Grading verzichtet werden.
Epitheloides Angiomyolipom
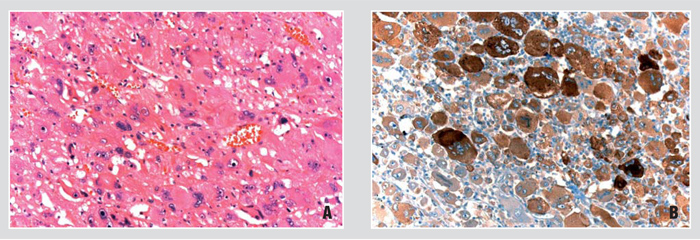
Epitheloide Angiomyolipome (vgl. Abb 5) stellen potenziell maligne mesenchymale Neoplasien der Niere dar, die zu den PEComen gehören und eng mit den klassischen triphasischen Angiomyolipomen verwandt sind. Bei mehr als der Hälfte der Patienten liegt eine Tuberöse Sklerose vor. Etwa ein Drittel der Läsionen metastasiert, wobei es bisher keine sicheren pathologischen Parameter gibt, die mit dem klinischen Verhalten zu korrelieren sind.
In der WHO-Klassifikation von 2004 werden als mögliche histomorphologische Hinweise auf ein malignes Verhalten Nekrosen, hohe mitotische Aktivität, Kernanaplasie und eine extrarenale Ausbreitung angegeben. In zwei aktuelleren (allerdings retrospektiven) Studien werden als mögliche Zusatzkriterien eine Tumorgröße > 7cm, Veneneinbruch, ein Karzinom-artiges Wachstumsmuster, atypische Mitosen und ein Prozentsatz der epitheloiden Zellen von ≥ 70% genannt. Prospektive Studien dazu stehen allerdings noch aus.
Es ist zu erwarten, dass es bei epitheloiden Angiomyolipomen in Zukunft anhand publizierter Daten eine Risikostratifizierung für ein malignes Verhalten in „low“, „intermediate“ und „high risk“ geben wird.
Grading und andere Prognosefaktoren
Grading
adings von Nierenzellkarzinomen reichen bis in das Jahr 1932 zurück, wo das erste Mal ein Zusammenhang zwischen Tumordifferenzierung und Patienten-Outcome beschrieben wird. In den folgenden Jahrzehnten wurden die histopathologischen Parameter für das Grading immer weiter präzisiert und verfeinert und unterschiedliche Grading-Systeme in der Literatur diskutiert.
In der klinischen Praxis durchgesetzt hat sich schließlich das auf früheren Publikationen aufgebaute Grading-System nach Fuhrman et al. von 1982 [6]. Dieses definiert die ersten drei Differenzierungsgrade G1 bis G3 anhand nukleärer Kriterien (Kerndurchmesser und Prominenz der Nukleoli) und den vierten Differenzierungsgrad G4 anhand des Vorliegens einer Kernpleomorphie. Der Gesamtgrad richtet sich bei heterogenen Tumoren nach dem geringsten Differenzierungsgrad. In den untersuchten Serien machen jedoch Patienten mit Grad 2- und Grad 3-Tumoren über 75% der Studienpopulation aus und zeigen einen vergleichbaren Verlauf, sodass dieses Grading nicht zu einer ausreichenden Diskriminierung führt. Weiterhin wurde in den Studiengruppen nicht nach RCC-Subtypen unterschieden.
In Kenntnis dieser Einschränkungen und des zunehmenden Wissens über die einzelnen Subtypen sowie der Definition immer neuer, seltener Typen wird die prognostische Signifikanz des ursprünglichen Fuhrman-Gradings immer mehr in Frage gestellt. Obwohl der Kerndurchmesser objektiv messbar ist, waren die Kriterien wie Prominenz der Nukleoli oder der nukleären Pleomorphie bislang eher subjektiv und nicht genau definiert. Außerdem fehlte eine Gewichtung der Einzelkriterien untereinander.
In aktuellen Studien hat sich herauskristallisiert, dass Grading-Systeme, die allein auf der Prominenz der Nukleoli beruhen, für papilläre und klarzellige Nierenzellkarzinome eine weit bessere Assoziation zum Patienten-Outcome zeigen als das ursprüngliche Fuhrman-Grading.
Aus diesem Grund wurde bei der Konsensuskonferenz ein neues Grading-System, das ISUP-Grading-System, vorgeschlagen [3]:
G1:
bei 400-facher Vergrößerung Nukleoli klein oder nicht sichtbar
G2:
bei 400-facher Vergrößerung Nukleoli klar sichtbar, bei 100-facher Vergrößerung jedoch nur klein oder nicht sichtbar
G3:
Nukleoli bei 100-facher Vergrößerung klar sichtbar
G4:
starke nukleäre Pleomorphie, sarkomatoide oder rhabdoide Differenzierung, Tumor-Riesenzellen
Dieses Grading-System soll für klarzellige und papilläre Nierenzellkarzinome angewendet werden. Aufgrund der tumortypischen Kernatypien bei chromophoben Nierenzellkarzinomen sollen diese in Zukunft nicht mehr gegradet werden.
Sarkomatoide und rhabdoide
Differenzierung
Eine sarkomatoide oder rhabdoide Differenzierung kann als Form der Dedifferenzierung in nahezu allen Nierenzellkarzinom-Typen vorkommen und stellt eine klonale Progression in einen hochmalignen, biologisch aggressiven Tumor dar.
Eine sarkomatoide Differenzierung liegt dann vor, wenn es in einem ansonsten epithelial differenzierten Tumor Areale gibt, die aus atypischen Spindelzellen oder anderweitig sarkomatös differenzierten Zellen bestehen. Zumeist liegt das histomorphologische Bild eines Fibrosarkoms oder eines pleomorphen undifferenzierten Sarkoms vor. Die karzinomatösen und sarkomatösen Areale können hierbei durchmischt oder scharf getrennt sein.
Bei einer rhabdoiden Differenzierung imitieren die dedifferenzierten Tumorzellen Rhabdomyoblasten eines Rhabdomyosarkoms oder die Zellen eines renalen Rhabdoid-Tumors des Kindesalters. Hierbei liegt keine echte skelettmuskuläre Differenzierung vor, was sich in immunhistochemischen Färbungen beweisen lässt, die ein identisches Expressionsprofil der rhabdoiden Zellen und der Karzinomzellen (Positivität für Pan-Cytokeratin, EMA und Vimentin) zeigen.
Diese Tumoren zeigen ein hochaggressives Verhalten, werden meist in hohem Tumorstadium entdeckt und haben dann häufig schon metastasiert.
Im pathologischen Befundbericht sollte eine sarkomatoide und rhabdoide Differenzierung aus diesem Grund unbedingt angegeben werden, wobei laut Konsensuskonferenz keine prozentuale Angabe notwendig ist. Weiterhin sollte der zugrundeliegende Tumortyp angegeben werden, da evtl. Metastasen möglicherweise eine ausschließlich epitheliale Differenzierung haben. Tumoren mit ausschließlich sarkomatoidem oder rhabdoidem Bild werden als undifferenzierte Grad-4-Karzinome mit sarkomatoider/rhabdoider Morphologie bezeichnet.
Tumornekrose und mikrovaskuläre Invasion
Tumornekrosen werden bei Nierenzellkarzinomen sehr häufig gesehen, im Speziellen beim klarzelligen und papillären Subtyp. Verschiedene Mechanismen wie eine für das Tumorwachstum nicht mehr ausreichende Gefäßversorgung, immunologische Prozesse und ein vaskuläres Remodelling werden für die Entstehung verantwortlich gemacht.
Eine prognostische Bedeutung der Tumornekrose wird in der Literatur seit 1974 diskutiert, mit z. T. sehr unterschiedlichen und widersprüchlichen Ergebnissen, in Abhängigkeit vom Tumortyp und von der Definition der Nekrose (makroskopische und/oder mikroskopische Abschätzung).
Aktueller Konsens besteht darüber, dass die Tumornekrose einen Prognosefaktor für das krankheitsspezifische Überleben beim klarzelligen Nierenzellkarzinom darstellt und daher im pathologischen Befundbericht prozentual angegeben werden sollte. Dabei sollte die prozentuale Abschätzung sowohl makroskopisch als auch nur mikroskopisch sichtbare Nekrose-Areale umfassen. Die Bedeutung für die anderen Tumortypen ist bislang noch nicht sicher herausgearbeitet.
Die mikrovaskuläre Tumorinvasion, definiert als Tumorgewebe innerhalb mikroskopisch kleiner Blutgefäße innerhalb des Tumors oder der Tumorkapsel, stellt bislang keinen sicheren prognostischen Faktor dar. Daher ist eine Angabe im Befundbericht nicht obligat, auch die UICC-Klassifikation wird dadurch nicht beeinflusst.
Handling und Staging
Nach extensiver Literaturrecherche der verantwortlichen Arbeitsgruppe wurden auch die Richtlinien und Empfehlungen zur Bearbeitung kompletter Nephrektomie-Präparate und Nieren-Teilresektate durch den Pathologen neu überdacht und der aktuellen Studienlage angepasst [4].
Pro cm Tumor sollte ein Block eingebettet werden mit einem Minimum von drei Blöcken und entsprechender Modifikation bei Spezialfällen. Die Länge
eines Tumorthrombus in der Nierenvene oder der Vena cava zählt nicht zur Gesamttumorgröße. Bei multiplen Tumoren in einem Resektat sollten mindestens die fünf größten zugeschnitten werden, wenn nicht die kleineren eine divergente Makromorphologie aufweisen.
Zur für das Staging hochrelevanten Beurteilung einer Invasion des perirenalen und peripelvinen Fettgewebes sollten senkrechte Schnitte in den Übergangsbereich Tumor/Fettgewebe gelegt und hier mehrere Blöcke entnommen werden. Bei eindeutiger Makroskopie ist aber ein einziger Block zur histologischen Bestätigung ausreichend. Hierbei stellt im Speziellen die Infiltration des peripelvinen (bzw. Sinus-)Fettgewebes einen kritischen Faktor dar, da hier die die Niere versorgenden Blut- und Lymphgefäße verlaufen. In neueren Studien wurde festgestellt, dass > 90% der klarzelligen Nierenzellkarzinome mit einer Größe von ≥ 7cm bereits das Sinus-Fettgewebe infiltrieren [7]. Eine weitere Studie zeigt, dass häufig vor allem auch bei kleineren Tumoren eine Infiltration des Sinus-Fettgewebes übersehen und der Tumor somit fälschlicherweise in ein niedrigeres Stadium eingruppiert wird: Thompson et al. untersuchten Feuchtgewebe von 33 Patienten mit pT1-Nierenzellkarzinomen, die an ihrer Erkrankung verstorben waren [8]. Dabei zeigten nachträgliche Gewebsentnahmen eine Infiltration des Sinus-Fettgewebes in 14 Fällen (42%). Weiterhin gibt es Daten, wonach eine Infiltration des Sinus-Fettgewebes mit einer schlechteren Prognose einhergeht als die Infiltration des perirenalen Weichgewebes. In der Konsensuskonferenz wurde daher die Empfehlung formuliert, bei unklarer Makroskopie mindestens drei Blöcke aus diesem Bereich zu entnehmen.
Der Gefäßabsetzungsrand bei Vorhandensein eines Tumorthrombus ist nur dann als positiv (R1) zu werten, wenn histologisch eindeutig wandadhärentes Tumorgewebe zu erkennen ist.
Wenn separat Gewebe mit der Bezeichnung „Vena cava-Thrombus“ übersandt wird, sollten hieraus mindestens zwei Blöcke entnommen und gezielt nach Gefäßwandanteilen gesucht werden: Eine Infiltration der Wand der Vena cava verändert das Tumorstadium selbst bei einem Tumorthrombus, der unterhalb des Zwerchfells endet, von pT3b auf pT3c mit entsprechend schlechterer Prognose.
Eine der signifikantesten Änderungen der aktuellsten UICC-Klassifikation im Vergleich zur Fassung von 2002 betraf das Staging bei Infiltration der Nebenniere: Das Stadium wurde von vormals pT3a auf pT4 angehoben, was auf Daten beruht, die hier eine signifikant schlechtere Prognose zeigen. Bei Infiltration der Nebenniere durch ein Nierenzellkarzinom ist es entscheidend, festzustellen, ob es sich hier um eine kontinuierliche Infiltration (pT4) oder aber um eine Metastase (pM1) handelt, was bereits durch den Zuschnitt bzw. gezielte Gewebsentnahme gewährleistet werden kann.
Uneinigkeiten bestanden bisher auch bezüglich des Ausmaßes der Lymphknotensuche bei kompletten Nephrektomie-Präparaten. Eine aktuelle Studie von Mehta et al., in der das Hilus-Fettgewebe der Nephrektomie-Präparate von 861 Erwachsenen untersucht wurde, konnte zeigen, dass bereits makroskopisch/palpatorisch auffällige Lymphknoten in 80% der Fälle Metastasen zeigten [9]. Mikroskopisch wurden nur in 25% der Fälle hiläre Lymphknoten gefunden, die alle tumorfrei waren. Somit erscheint ein Palpieren und Lamellieren des hilären Fettgewebes ausreichend, die Suche nach „okkulten“ Lymphknoten nicht sinnvoll.
Diagnostische und prognostische Biomarker
Die Rolle von Biomarkern beim Nierenzellkarzinom ist umfangreich. Mit ihrer Hilfe ist eine exakte Artdiagnose, ein besseres Verständnis der His-togenese und die Definition neuer Entitäten möglich; sie umfasst aber auch das noch experimentelle Gebiet prädiktiver und prognostischer Parameter [5].
Immunhistochemie
In der Routinediagnostik spielt von den verschiedenen Verfahren dabei die Immunhistochemie die größte Rolle. Obwohl die Diagnose und Subtypisierung eines Nierenzellkarzinoms in den meisten Fällen nach sorgfältiger Aufarbeitung am HE-Schnitt möglich ist, gibt es Situationen, in denen immunhistochemische Untersuchungen sinnvoll und notwendig sind, z. B. bei ungewöhnlicher Tumormorphologie oder undifferenzierten Karzinomen, zur Abgrenzung gutartiger Tumoren und der seltenen Möglichkeit von Metastasen anderweitig lokalisierter Primärtumoren in der Niere. Fernmetastasen eines Nierenzellkarzinoms bedürfen der immunhistochemischen Absicherung, und auch die Tumor-Subtypisierung an nur wenig Material wie einer Stanzbiopsie, bei der man sich nicht auf architektonische Kriterien stützen kann, stellt eine wichtige Indikation dar.
Zum Antikörperspektrum, das für die genaue Artdiagnose eines Nierenzellkarzinoms sinnvoll ist, existiert reichlich Literatur. Die häufigsten in unterschiedlicher Kombination verwendeten Antikörper zur Differenzierung niereneigener Tumoren zeigt Tabelle 2.
Es gibt aber keinen Konsens über ein bestimmtes Marker-Panel. Wichtig ist hier für jedes individuelle Labor, bei den dort zur Verfügung stehenden immunhistochemischen Markern ein möglichst hohes Niveau der Färbequalität zu erreichen, ihre Sensitivität und Spezifität zu kennen und sie dann in sinnvoller Kombination für eine bestimmte Fragestellung einzusetzen.
Konsens herrscht dagegen darüber, dass PAX 2 und PAX 8 die hilfreichsten Marker zur Feststellung einer renalen Differenzierung bzw. bei Metastasen eines Tumorursprungs aus der Niere sind.
Prognosemarker
Prognostische Biomarker für das Nierenzellkarzinom haben, obwohl dieses Gebiet von großem Interesse ist und umfassend beforscht wird, bislang noch keinen Eingang in die Routinediagnostik gefunden. Es gibt jedoch dank der wissenschaftlichen Arbeit zahlreicher Zentren und Institutionen, u. a. des Cancer Genome Atlas und des International Cancer Genome Consortium, vielversprechende Ansätze. Eine relativ neue Entdeckung dabei ist das Polybromo-1-Gen (PBRM1), das nach dem VHL-Gen am zweithäufigsten mutierte Gen beim Nierenzellkarzinom. Vor Kurzem konnte gezeigt werden, dass der Verlust des PBRM1-Protein-Expressionsprodukts BAF 180 mit fortgeschrittenem Tumorstadium und schlechterem Outcome assoziiert ist.
Zytogenetik und molekulare Tests
Die verschiedenen Nierenzellkarzinom-Subtypen weisen charakteristische chromosomale Veränderungen auf. Während das klarzellige RCC Aberrationen auf Chromosom 3p (am häufigsten eine VHL-Gen-Mutation) zeigt, sind beim papillären RCC zahlreiche Aberrationen zu beobachten, am häufigsten Trisomien der Chromosomen 7 und 17. Das chromophobe RCC weist bekanntermaßen eine Fülle numerischer Verluste von Chromosom 1, 2, 6, 10 und 17 auf und beim Sammelrohrkarzinom beobachtet man zahlreiche numerische und strukturelle Aberrationen, die u. a. die Chromosomen 1, X oder Y betreffen. Für diagnostische Zwecke oder als prognostische Marker spielen diese Veränderungen jedoch in der klinischen Praxis bisher zumeist keine Rolle.
Bei Verdacht auf eines der seltenen Translokations-Karzinome (s. o.) bei jungen Patienten < 30 Jahre und/oder suggestiver Tumormorphologie sollte jedoch entweder immunhistochemisch oder mittels FISH ein Nachweis von TFE3 bzw. TFEB angestrebt werden.
Prädiktive Marker
Unter prädiktiven Markern versteht man Marker, die Voraussagen erlauben, ob ein Karzinom auf eine bestimmte Therapie ansprechen wird oder nicht.
Obwohl in den letzten Jahren immer neue medikamentöse Therapien für Nierenzellkarzinome, speziell im metastasierten Stadium, entwickelt werden, gibt es derzeit noch keine prädiktiven Biomarker, die in der klinischen Praxis für Stratifizierung und Therapieplanung eine Rolle spielen. Validierungsstudien hierzu stehen noch aus.
Zusammenfassung
Durch das zunehmende Verständnis molekularer Veränderungen und Mechanismen beim Nierenzellkarzinom wurden in den letzten Jahren zahlreiche neue Entitäten definiert, die eine typische Morphologie und charakteristische Chromosomen-Aberrationen sowie zum Teil auch einen typischen Verlauf zeigen. Auch in der zu erwartenden neuen WHO-Klassifikation für urogenitale Tumoren werden wieder fünf neue Subtypen aufgeführt sein.
Nach wie vor sind die für die Prognose entscheidenden Faktoren der Tumortyp, der Tumorgrad und das Stadium. Zur exakten Einordnung ist sowohl große Präzision beim Zuschnitt des OP-Präparates als auch bei der mikroskopischen Diagnostik notwendig. Hierzu sind die Methoden und Standards bei der Konsensuskonferenz der ISUP wieder überarbeitet und neue Empfehlungen ausgesprochen worden.
Trotz bereits langer Forschungs- und Entwicklungsbemühungen gibt es jedoch bislang noch keine für die Praxis relevanten prognostischen und prädiktiven Biomarker.
Literatur
1. WHO-Classification of Tumours: Tumours of the Urinary System and Male Genital Organs, IARC Press, Lyon, 2004
2. Srigley JR et al. The International Society of Urological Pathology (ISUP) Vancouver classification of renal neoplasia. Am J Surg Pathol 2013; 37: 1469-89.
3. Delahunt B et al. The International Society of Urological Pathology (ISUP) grading system for renal cell carcinoma and other prognostic parameters. Am J Surg Pathol 2013; 37: 1490-504.
4. Trpkov K et al. Handling and staging of renal cell carcinoma. The International Society of Urological Pathology (ISUP) conference recommendations. Am J Surg Pathol 2013; 37: 1505-17.
5. Hoon Tan P et al. Renal tumors. Diagnostic and prognostic biomarkers. Am J Surg Pathol 2013; 37: 1518-31.
6. Fuhrman SA et al. Prognostic significance of morphologic parameters in renal cell carcinoma. Am J Surg Pathol 1982; 6: 655-63.
7. Bonsib SM. T2 clear cell renal cell carcinoma is a rare entity: A study of 120 clear cell renal cell carcinomas. J Urol 2005; 174:1199-1202; discussion 1202.
8. Thompson RH et al. Patients with pT1 renal cell carcinoma who die from disease after nephrectomy may have unrecognized renal sinus fat invasion. Am J Surg Pathol 2007; 31: 1089-1093.
9. Mehta V et al. Renal lymph nodes for tumor staging: Appraisal of 861 nephrectomies with examination of hilar fat. Arch Pathol Lab Med 2013; 137: 1584-90.

Dr. med. Sabine Siegert
Pathologie München-Nord
Ernst-Platz-Straße 2
80992 München

