Endosonografische Feinnadelpunktion in der klinischen Diagnostik
Axel Wellmann, Stephan Hollerbach
Die endosonografische Feinnadelpunktion in Kombination mit multimodalen, zytohistologischen Methoden erweitert die Möglichkeiten der klinischen Diagnostik sehr. Ein großer Vorteil für Patienten mit Krebsverdacht ist unter anderem das minimal-invasive Vorgehen.
Wie viele andere, auch nicht-medizinische Prozesse ist auch die klinische Diagnostik ständig im Wandel. Ein Merkmal dabei ist das Ziel, so schonend wie möglich vorzugehen und trotzdem ohne Verzögerung eine belastbare therapeutische und prognostische Aussage für die Patienten zu liefern. Insbesondere vor dem Hintergrund limitierter Budgets werden die Verfahren zunehmend auch unter ökonomischen Aspekten beurteilt. Ein immer wichtiger werdendes Verfahren in diesem Bereich, das diese Anforderungen berücksichtigt, ist die interventionelle Endosonografie (EUS).
Die EUS wurde in den letzten 20 Jahren vor allem in Ländern mit hohem medizinischem Standard von einem experimentellen Werkzeug und einer „Nischenmethode“ zu einem „filigranen“ Routineverfahren der Diagnostik und neuerdings zunehmend auch des Stagings und der Therapie entwickelt. Die endosonografisch gesteuerte Feinnadelpunktion (EUS-FNP) hat auch Eingang in nationale und internationale Leitlinien gefunden, z. B. in die S3-Leitlinien für Magen- und Rektumkarzinome.
Mit der EUS-FNP ist der hochspezialisierte, interventionelle Internist heute in der Lage, einerseits die zugänglichen Hohlorgane zu erreichen. Andererseits kann er über diese dann auch noch benachbarte, vielfach mit anderen Verfahren kaum zu erreichende Regionen (mit Ausnahme großer Anteile des Dünndarms und Kolons) untersuchen und auch dort Proben gewinnen.
Moderne, verbesserte Geräte sind heute mit sehr wendigen Longitudinal-Scannern ausgestattet, bei denen die hochauflösende Sonografie mit der Endoskopie verknüpft wird (Abb. 1). Das ermöglicht es, selbst sehr kleine Läsionen im und um den Gastrointestinaltrakt (auch bronchial) mithilfe einer risikoarmen Feinnadelpunktion unter direkter EUS-Sicht darzustellen und zu punktieren.

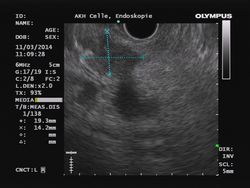
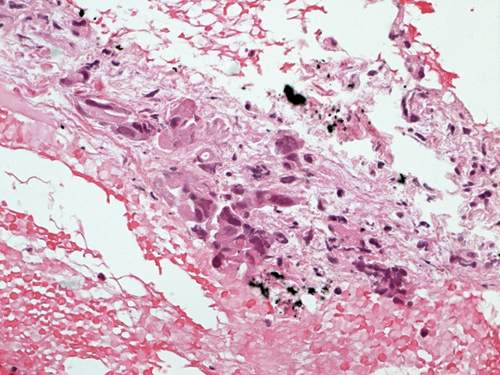
Die Indikationsbreite ist mittlerweile recht ausgedehnt. So lassen sich mit der EUS-FNP auch sonst schwer erreichbare gastrointestinale Wandprozesse und extraintestinale, aber benachbarte Befunde aller Art wie Zysten, Lymphknoten, Pankreas (Abb. 2), Mediastinum etc. gezielt bei sehr niedriger Komplikationsrate untersuchen [1-4].
Die Endosonografie ist eine lern- und trainingsaufwendige Methode und stark von den Fähigkeiten des Untersuchers abhängig [5, 6]. Die dabei notwendigen, komplexen technischen und kognitiven Fähigkeiten gehen weit über das hinaus, was für diagnostische Standard-Endoskopie ausreicht. Die Ergebnisse der EUS–FNP-Diagnostik hängen daher entscheidend vom Ausbildungs- und Erfahrungsgrad des Untersuchers ab. Es gibt folgerichtig immer wieder Ansätze von nationalen und internationalen Fachgesellschaften, die Expertise in EUS-FNP von bloßen Untersuchungszahlen (mit und ohne Supervision) abhängig zu machen – die aber bisher nie ausreichend validiert werden konnten. Ähnliche Empfehlungen finden sich bei mehreren Fachgesellschaften, z. B. der ESGE [7]. Die EUS-FNP erreicht beim erfahrenen Arzt nach einer anfänglich meist „flachen“ und längeren Lernkurve eine mittlere Sensitivität von 85–95%. Der Einfluss der Untersuchungsergebnisse auf weitere Diagnostik- und Behandlungsalgorithmen ist vielfach nachgewiesen und in der Praxis täglich sichtbar.
Die EUS-FNP bringt bei spezialisierten Zentren mit viel Erfahrung in den meisten Fällen genügend hochwertiges Zell- und Gewebematerial, um daran nach zyto-histomorphologischer Erstbefundung zusätzliche unterstützende pathologische Untersuchungsverfahren zur Dignitätssicherung und Typisierung anzuschließen.
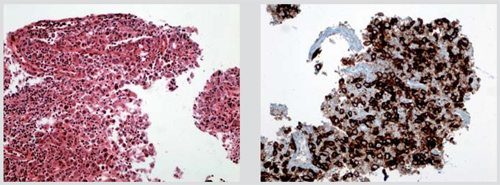
Der Einfluss dieser minimalinvasiven Methoden auf die weitere klinische Diagnostik und auf therapeutische Verfahren bei den Patienten ist vielfach immens. Bei konsequentem Einsatz und einer guten Zusammenarbeit von Endoskopikern mit Pathologen und Radiologen ist es in sehr vielen Fällen sogar möglich, auf Staging-Operationen zu verzichten [8]. Trotzdem kann damit insbesondere an Zellblock-Präparaten eine hochwertige pathologische und molekularbiologische Klassifizierung sowie eine klare Diagnosestellung krankhafter Läsionen prätherapeutisch erreicht werden. Beispiele dafür sind zahlreiche Tumorerkrankungen, insbesondere Lymphknoten-Metastasen gastrointestinaler und pulmonaler Tumoren und maligne Lymphome (klassische Hodgkin-Lymphome und Non-Hodgkin-Lymphome, Abb. 3, [9]).
Standardisierte Befundung
Da unter dem Primat, in Praxis und Klinik heute möglichst wenig invasiv vorzugehen, vielfach sehr kleine Zellmengen gewonnen werden (oft weit unter 1.000 Zellen), sind die Anforderungen an die Erfahrung des Pathologen und eine detaillierte Kommunikation der beteiligten Kollegen sehr hoch. Dennoch können durch einen komplexen Algorithmus mit Nutzung weiterer Techniken wie Immunzytohistochemie, DNS-Zytometrie und molekularer Techniken wie PCR, FISH (Fluoreszenz-in-situ-Hybridisierung) und Sequenzierung klare, verlässliche und relevante Aussagen gemacht werden.
Die zytohistologische Diagnostik erfolgt routinemäßig zunächst über morphologische Veränderungen an May-Grünwald-Giemsa (MGG)- oder an Papanicolaou-(Pap)-gefärbten Präparaten, oder mittels Hämatoxylin-Eosin-Färbung an Mikrobiopsien, die regelmäßig durch die EUS gewonnen werden. Die Befundung geschieht standardisiert nach einer von den Deutschen Gesellschaften für Pathologie und für Zytologie erarbeiteten Nomenklatur für die extragenitale Zytologie.
Vor einer Diagnose im Klartext, welche „Preferred Terms“ und Codes der ICD-O-M verwenden sollte, erfolgt eine Beurteilung der Wahrscheinlichkeit, dass bösartige Zellen vorliegen. Diese beträgt für die Kategorie „negativ“ 0%, für „zweifelhaft“ etwa 30%, für „dringender Verdacht“ etwa 70% und für „sicher positiv“ 100%. Die Kategorie „unzureichend“ wird vergeben, wenn nur nekrotische, autolytische oder osmotisch geschädigte beziehungsweise gar keine Zellen aus der punktierten Raumforderung vorliegen, an welchen keine zytohistologische Diagnose möglich ist.
Insbesondere bei der Differenzierung von malignen versus nicht-malignen Zell- und Gewebeveränderungen unter anderen am FNP-Präparat kommen zur Verbesserung der Diagnostik immunzytochemische, DNS-zytometrische und FISH-Analysen zum Einsatz. Durch interaktive Messung der optischen Dichten von infrage-stehenden Zellkernen lassen sich die DNS-Verteilung der fraglichen Zellpopulation und möglicherweise eine Aneuploidie ermitteln.
Da DNS-Aneuploidie in Tumorzellen (in 91,4% der FNPs aus Pankreaskarzinomen, generell aber nicht in reaktiven Veränderungen des Organs) vorkommt, lassen sich mit diesem Nachweis bösartige Tumorzellen sicherer erkennen, auch wenn Malignität zytomorphologisch nicht zweifelsfrei zu sichern ist.
Ist die Dignität erst einmal geklärt, kann eine differenzialdiagnostische Analyse des Zellmaterials mithilfe zusätzlicher immunzytochemischer Analysen erfolgen. Hiermit lassen sich die meisten Primärtumoren spezifisch klassifizieren (Abb. 3).
Perspektive Proteom-Analyse
Perspektive Proteom-Analyse
Es ist oft sehr schwierig, alle differenzialdiagnostisch relevanten Antikörper an den geringen Zellmengen anzuwenden, ein Problem, das sehr mit der Sensitivität, aber auch Spezifität der Untersuchung interferieren kann. Daher gibt es Entwicklungen, Proteine auf anderen Wegen zu analysieren.
Eine Möglichkeit scheint die
MALDI-TOF-Imaging-Technologie (matrix assisted laser desorption ionization time of flight mass spectrometry) zu sein [10, 14]. Sie beruht auf der Ionisierung von Molekülen wie zum Beispiel Peptiden oder Proteinen. Das zu untersuchende Material wird auf einem Probenträger aufgetragen und anschließend mit kristallisierender Matrix bedeckt. Die Proben werden mit Laser „beschossen“. Die so ionisierten Proteine und Peptide fliegen im elektrischen Feld durch ein Hochvakuum der Messeinheit. Mit dem Auftreffen der Proteine auf den Detektor wird deren Flugzeit bestimmt („Time-of-flight“-Analyse). Je größer das Molekül, desto länger seine Flugzeit. Die Größe der Moleküle kann grafisch in Form eines Massenspektrums des untersuchten Materials dargestellt werden.
Eine wesentliche Innovation der Imaging-Technologie gegenüber der herkömmlichen MALDI-TOF-MS besteht darin, dass mit ihr direkt ganze Gewebsverbände und nicht nur Zell-Lysate untersucht werden können. Nach der Analyse sind die Gewebe noch so intakt, dass sie mit Standardfärbungen der Pathologie gefärbt und mikroskopisch beurteilt werden können. Dadurch können Informationen der Proteinzusammensetzung oder gewebstypische Veränderungen direkt ortsspezifisch abgebildet und mit der konventionellen Histologie sogar an demselben Schnittpräparat verglichen werden.
Diese Technik ermöglicht die Analyse des Proteoms an sehr kleinen Zellmengen (weniger als 10 pmol) oder auch zellarmen/-freien Punktionsflüssigkeiten z. B. von zystischen Läsionen [15].
Verschiedene Publikationen [11-13] zeigen, dass sich damit diagnostisch und prognostisch relevante Massensignaturen erzeugen lassen. Mit den neuesten MALDI TOF/TOF-tandem-MS-Instrumenten kann man grundsätzlich auch Zielmoleküle direkt identifizieren, sodass sich die Option bietet, die Ergebnisse dieser komplexen Plattform auf die weiter verbreitete Immunhistochemie zu übertragen [15]. Zwar ist derzeit eine breite klinische Routineapplikation noch nicht absehbar, doch hat die Technologie sehr großes Potenzial, mittelfristig zum Instrument der pathologischen Diagnostik und Prognose zu werden
Literatur
1. Wiersema MJ et al. Endosonography-guided fine needle aspiration biopsy: diagnostic accuracy and complication assessment. Gastroenterology 1997; 112: 1087-95.
2. Allescher H et al. Performance, patient acceptance, appropriateness of indications and potential influence on outcome of EUS: A prospective study in 397 consecutive patients. Gastrointestinal Endoscopy 1999; 50: 737-45.
3. Wiersema MJ et al. Evaluation of mediastinal lymphadenopathy with endoscopic US-guided fine-needle aspiration biopsy. Radiology 2001; 219: 252-7.
4. Ainsworth AP et al. Clinical impact of endoscopic ultrasonography at a county hospital. Endoscopy 2002; 34: 447-50.
5. Südhoff T et al. Clinical utility of EUS-FNA in upper gastrointestinal and mediastinal disease. Dtsch Med Wochenschr 2004; 129: 2227-32.
6. Hollerbach S, Burmester E. Interventionelle Endosonografie (EUS/EUS-FNP) in Diagnostik und Therapie. In: Riemann JF, Fischbach W, Galle P, Mössner J. Gastroenterologie, Kap. 3.6., 285-304. Thieme, New York, Stuttgart 2008.
7. Polkowski M et al. Learning, techniques, and complications of endoscopic ultrasound (EUS)-guided sampling in gastroenterology: European Society of Gastrointestinal Endoscopy (ESGE) Technical Guideline. Endoscopy 2012; 44: 190-206.
8. Hollerbach S, Wellmann A. Interventionelle Endosonographie: Sichere Tumordiagnosen sind auch ohne Staging-Operationen möglich. Dtsch Ärztebl 2010; 107: A2390/B2070/C2032.
9. Hollerbach S et al. EUS-geführte Feinnadelbiopsie (EUS-FNP): Wie gelingen gute Biopsien? Submitted, Juni 2014.
10. Seeley EH, Caprioli RM. MALDI imaging mass spectrometry of human tissue: Method challenges and clinical perspectives. Trends Biotechnol. 2011; 29: 136-43.
11. Grüner, B.M et al. MALDI imaging mass spectrometry for in situ proteomic analysis of preneoplastic lesions in pancreatic cancer. PLoS One 2012; 7: e39424.
12. Taguchi F et al. Mass spectrometry to classify non-small-cell lung cancer patients for clinical outcome after treatment with epidermal growth factor receptor tyrosine kinase inhibitors: A multicohort cross-institutional study. J Natl Cancer Inst 2007; 99: 838–46.
13. Amann JM et al. Selective profiling of proteins in lung cancer cells from fine-needle aspirates by matrix-assisted laser desorption ionization time-of-flight mass spectrometry. Clin Cancer Res 2006; 12: 5142–50.
14. Giusti L et al. Fine-needle aspiration for proteomic study of tumour tissues. Proteomics Clin Appl 2011; 1-2: 24-9.
15. W. S. C Cho. Introduction: emerging technologies for cancer biomarker discovery. In: Hayat MA (ed): Methods of Cancer Diagnosis, Therapy and Prognosis, Vol 7. Springer, Heidelberg, New York 2010

Prof. Dr. med. Axel Wellmann
Pathologisches Institut Celle
Wittinger Straße 14
29223 Celle

