Sowohl beim metastasierten Nierenzellkarzinom (mRCC) als auch bei metastasierten gastrointestinalen Stromatumoren (mGIST) haben Tyrosinkinase-Inhibitoren (TKI) in Studien überzeugt. Bei mRCC haben Sunitinib (Sutent®) und Axitinib (Inlyta®) die höchsten Empfehlungsgrade in den jeweiligen Leitlinien, bei mGIST ist Sunitinib etabliert nach Imatinib-Versagen.
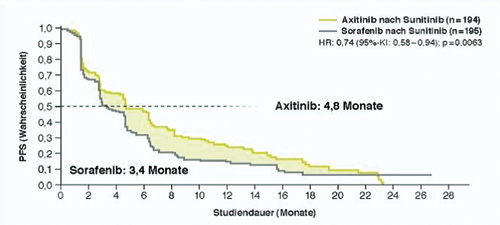
Laut aktueller ESMO-Leitlinie [1] ist Sunitinib ein Standard in der Erstlinientherapie des mRCC und hat den höchsten Empfehlungsgrad IA, so Gerald H. Mickisch, Bremen. Sunitinib habe in mehreren Studien besser abgeschnitten als andere TKI. Das mediane progressionsfreie Überleben (PFS) mit Sunitinib als Erstlinientherapie beträgt etwa elf Monate [2]. „Der Start mit Sunitinib als stärkster Substanz schafft einen Therapievorsprung“, so Mickisch. "Was zu Beginn verpasst wird, kann in späteren Therapielinien nicht mehr aufgeholt werden“ [3]. Für das weitere Vorgehen nach erneutem Progress gebe es ebenfalls gute Daten, die den Einsatz von Axitinib nahelegen. In der AXIS-Studie verlängerte eine Zweitlinientherapie mit Axitinib signifikant das PFS im Vergleich zu Sorafenib, und zwar nach Vorbehandlung sowohl mit Sunitinib (4,8 vs. 3,4 Monate; s. Abb.) als auch mit Zytokinen [4].
Zur Frage der optimalen Sequenz wurden beim diesjährigen ASCO-GU-Symposium in Orlando die Ergebnisse der SWITCH-Studie vorgestellt, die der Frage der Therapiesequenz beim mRCC nachging: Sorafenib gefolgt von Sunitinib oder vice versa [5]. Die auf Überlegenheit (Start mit Sorafenib) angelegte Studie verfehlte ihr Studienziel: Beide Sequenzen waren bezüglich des primären Endpunktes (PFS bis zum ersten Event in der Zweitlinie) statistisch vergleichbar, auch im Gesamtüberleben gab es keine Unterschiede. Das PFS während der Erstlinientherapie (sekundärer Endpunkt) war mit der Sequenz Sunitinib/Sorafenib tendenziell länger (median 8,5 vs. 5,9 Monate). Lediglich für die Gruppe der über 65-Jährigen konnte im Rahmen einer Subgruppenanalyse ein Vorteil für eine bestimmte Sequenz – nämlich Sorafenib gefolgt von Sunitinib – gezeigt werden [6].
Weiterbehandeln oder wechseln?
Bei Patienten mit GIST sind Mutationen im KIT- und im PDGF-Rezeptor ursächlich am Tumorgeschehen beteiligt und haben Einfluss auf Prognose und Therapieansprechen, wie Sebastian Bauer, Essen, erläuterte. Sunitinib ist bei GIST die einzige zugelassene Therapieoption bei Resistenz oder Unverträglichkeit gegenüber Imatinib. In der Phase-III-Zulassungsstudie verlängerte Sunitinib signifikant die Zeit bis zum erneuten Progress im Vergleich zu Placebo (27 vs. 6 Wochen), auch das Gesamtüberleben konnte signifikant verlängert werden [7].
mGIST-Patienten werden in Abhängigkeit vom KIT-Mutationsstatus individuell behandelt. Zur Frage, ob im Falle einer Progression während der Erstlinientherapie zunächst die Imatinib-Dosis erhöht werden sollte oder die Patienten eher von einer Umstellung auf Sunitinib profitieren, gab es bisher keine validen Daten. Crossover-Analysen zeigten jedoch, dass Patienten mit Exon-11-Mutation mehr Benefit haben, wenn sie von Imatinib (400 mg/d) auf Sunitinib wechseln. Dies hat sich in einer bei der ASCO-Jahrestagung 2014 vorgestellten retrospektiven Analyse bestätigt [8]: 123 GIST-Patienten mit Exon-11-Mutation, die eine Resistenz auf Imatinib (400 mg/d) entwickelt hatten, hatten entweder weiter Imatinib (800 mg/Tag) erhalten oder auf eine Therapie mit Sunitinib gewechselt. Patienten im Sunitinib-Arm waren doppelt so lange progressionsfrei wie Patienten unter Imatinib-Therapie (10,0 vs. 5,0 Monate, p = 0,012). Das Gesamtüberleben war in beiden Gruppen vergleichbar (58 vs. 62 Monate).
Diese Daten lassen laut Bauer darauf schließen, dass Patienten mit Exon-11-Mutation und Imatinib-Resistenz früh auf Sunitinib wechseln sollten. Bei den selteneren anderen Mutationen werde in der Regel zunächst die Dosis von Imatinib heraufgesetzt. Bei erneutem Progress nach Imatinib und Sunitinib steht als weitere Option Regorafenib zur Verfügung.
Dr. Beate Grübler
Literatur
1. Escudier B et al. Ann Oncol 2012; 23 (Suppl 7): vii65-vii71.
2. Motzer RJ et al. J Clin Oncol 2009; 27: 3584-90.
3. Motzer RJ et al. J Clin Oncol 2013; 31 (15S): 285s (ASCO 2013, Abstract #4504.
4. Rini BI et al. Lancet 2011; 378: 1931-9.
5. Michel MS et al. J Clin Oncol 2014; 32 (4S) (ASCO-GU 2013, Abstract #393).
6.Goebell P et al. J Clin Oncol 2014; 32 (15S): 312s (ASCO 2014, Abstract #4567).
7. Demetri GD et al. Lancet 2006; 368: 1329-68.
8.Vincenci B et al. J Clin Oncol 2014; 32 (15S): 671s (ASCO 2014, Abstract #10515).
Pressegespräch „ASCO 2014 kompakt: Therapie-Update zum metastasierten Nierenzellkarzinom (mRCC) und zu metastasierten Gastrointestinalen Stromatumoren (mGIST) am 25. Juni 2014 in Berlin. Veranstalter: Pfizer Oncology.

