Die Beobachtungsstudie BRAWO zum Einsatz des mTOR-Inhibitors Everolimus (Afinitor®) beim fortgeschrittenen, Hormonrezeptor-positiven, HER2-negativen Mammakarzinom, in die letztlich etwa 3.000 Patientinnen eingeschlossen werden sollen, zeigt in einer ersten Interimsanalyse, dass Everolimus zunehmend häufiger in der Erst- und Zweitlinie gegeben wird. Das geht zugleich mit weniger Nebenwirkungen einher, als wenn der Inhibitor in späteren Therapielinien verordnet würde.
Die AGO-Leitlinie Mammakarzinom empfiehlt seit 2013 mit dem höchsten Empfehlungsgrad die Gabe von Everolimus in Kombination mit Exemestan bei Patientinnen mit Hormonrezeptor-positivem (HR+), HER2-negativem Mammakarzinom in der Erst- und Zweitlinientherapie [1]. Grundlage dafür waren die Ergebnisse der Phase-III-Studie BOLERO-2: In der finalen 18-Monats-Analyse hatte sich die mediane progressionsfreie Überlebenszeit (PFS) gegenüber der Vergleichsgruppe mit Placebo plus Exemestan beinahe verdreifacht (11,0 vs. 4,1 Monate; Hazard Ratio 0,38; 95%-Konfidenzintervall 0,31–0,48; p < 0,0001, [2]). Besonders gut hatten in einer retrospektiven Subgruppenanalyse die Patientinnen abgeschnitten, die Everolimus in der Erstlinie erhalten hatten (15,2 vs. 4,2 Monate; HR 0,32; 95%-KI 0,18–0,57, [3]).
Dass sich der möglichst frühe Einsatz von Everolimus auch in der Routineversorgung des fortgeschrittenen, HR-positiven, HER2-negativen Mammakarzinoms zunehmend durchsetzt, zeigt eine Interimsanalyse der multizentrischen deutschen Beobachtungsstudie BRAWO, die Diana Lüftner, Berlin, beim ASCO-Kongress in Chicago vorstellte [4]. Eingeschlossen wurden bisher 866 Patientinnen; bei einem Vergleich der ersten 200 mit den zuletzt eingeschlossenen 200 Patientinnen nahm der Anteil derjenigen, die Everolimus plus Exemestan in der Erst- und Zweitlinie erhielten, von zu Beginn 53,5% auf zuletzt 70% zu. Bezogen auf sämtliche 866 Patientinnen erhielten 28,8% Everolimus plus Exemestan in der Erst-, 30,3% in der Zweitlinie.
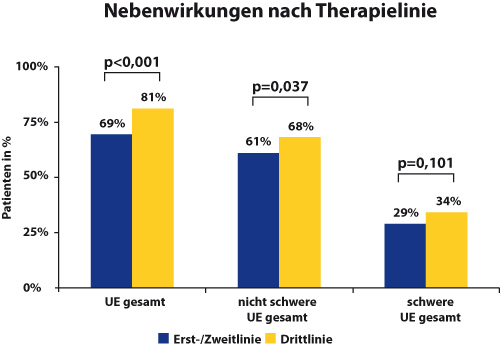
Je früher Everolimus gegeben wird, desto besser ist auch die Verträglichkeit: Klinisch relevante Nebenwirkungen waren mit 68,7% deutlich seltener in der Erst- oder Zweitlinie als in späteren Therapielinien (81,4%; Abb.). Die häufigste Nebenwirkung von Everolimus in der BOLERO-2-Studie war eine Stomatitis (bei 59% aller Patientinnen, bei 30% vom Grad ≥ 2, [2]. In der BRAWO-Studie waren es mit 34,1% insgesamt und 15,6% mit Grad ≥ 2 deutlich weniger, so Frau Lüftner [4]. Tendenziell waren auch hier Anteil und Schweregrad geringer, wenn Everolimus in der Erst- oder Zweitlinie gegeben wurde. Der Grund dafür könnte sein, dass fast alle Studienärzte eine aktive Prophylaxe der Stomatitis betrieben: 87,2% gaben den Teilnehmerinnen Empfehlungen zur Prävention (sanfte Zahnpflege, Vermeidung stark gewürzter Speisen, Spülungen mit Tee, kühlende Maßnahmen, Vermeiden von peroxid- oder alkoholhaltigen Mundwässern). Eine manifeste Stomatitis wurde meist mit nicht-medikamentösen Mundspülungen, Kühlung oder medikamentös (lokal oder systemisch) therapiert. Hatte die Stomatitis in BOLERO-2 sechs Wochen nach Therapiestart ein Häufigkeits-Plateau erreicht [5], veränderte sich die Intensität dieser Nebenwirkung in der BRAWO-Studie zwischen Monat eins und drei kaum mehr [4].
Erkenntnisse aus dem Praxisalltag
Nachdem BOLERO-2 die hohe Wirksamkeit von Everolimus plus Exemestan unter den Bedingungen einer Phase-III-Studie bewiesen hat, liefert die nicht-interventionelle BRAWO-Studie nun Erkenntnisse aus dem routinemäßigen Einsatz von Everolimus in der Praxis. So sind die Patientinnen in BRAWO im Median vier Jahre älter als in BOLERO-2 [2, 4], und nur 46,8% von ihnen hatten bei Einschluss einen ECOG-Status von 0 gegenüber 60% in der BOLERO-2-Kohorte. Eine zweite Interimsanalyse wird für das laufende Jahr, die Rekrutierung bis Ende 2015 und die endgültige Dokumentation für Ende 2016 erwartet.
jfg
Literatur:
1. www.ago-online.de/fileadmin/downloads/leitlinien/mamma/maerz2014/de/2014D_19_Endokrine_und_ziel-gerichtete_Therapie_metastasiertes_Mammakarzinom.pdf. Zuletzt aufgerufen am 28.05.2014.
2. Yardley DA et al. Adv Ther 2013; 30: 870-84.
3. Beck JT et al.. Breast Cancer Res Treat 2014;143: 459–67.
4. Lueftner D et al. J Clin Oncol 2014; 32 (15S): 24s (ASCO 2014; Abstract #578).
5. Rugo HS et al. Ann Oncol 2014; 25: 808-15.
Annual Meeting of the American Society of Clinical Oncology (ASCO), 30.5-3.6.2014 in Chicago.

