Am 21. März 2014 erfolgte in der EU die Zulassung einer neuen subkutanen Applikationsform des Anti-CD20-Antikörpers Rituximab (MabThera® SC) für Patienten mit follikulärem Lymphom (FL) und diffus-großzelligem B-Zell-Lymphom (DLBCL). Die Therapie wird durch den veränderten Zugangsweg für Ärzte und medizinisches Fachpersonal und vor allem auch für den Patienten erheblich vereinfacht: Bei gleicher Wirksamkeit und Verträglichkeit kann der Antikörper, der bisher über Stunden infundiert werden musste, nun innerhalb weniger Minuten gegeben werden.
Seit der Erstzulassung 1997 haben weltweit fast drei Millionen Patienten Rituximab erhalten, das die Therapie von Non-Hodgkin-Lymphomen erheblich verbessert hat. Nach der EU-weiten Zulassung der neuen Applikationsform kann Rituximab in der Erstlinien- und Erhaltungstherapie des FL und der Erstlinientherapie des DLBCL nun auch subkutan injiziert werden. Die Injektion unter die Haut dauert nur wenige Minuten, verglichen mit mehreren Stunden bei der bisherigen intravenösen Infusion und wird dadurch ermöglicht, dass die subkutane Darreichungsform das gentechnisch hergestellte Enzym Hyaluronidase enthält. Der Antikörper lässt sich nämlich nicht beliebig stark konzentrieren, sodass relativ große Flüssigkeitsvolumina unter die Haut appliziert werden müssen. Hyaluronidase macht das möglich durch eine (rasch reversible) Auflockerung des Binde- und Fettgewebes.
Die SABRINA-Studie
Die Zulassungserweiterung basiert auf den Ergebnissen der internationalen, randomisierten Phase-III-Studie SABRINA [1], in der 530 Patienten mit neu diagnostiziertem, therapiebedürftigem FL zusätzlich zu einer CHOP- oder CVP-Chemotherapie mit Rituximab behandelt wurden. Die erste Gabe des Antikörpers erfolgte aus Sicherheitsgründen intravenös (das wird auch künftig in der Praxis so sein), für die weitere Therapie wurden die Patienten randomisiert, ihn entweder intravenös in einer Dosierung von 375 mg/m2 oder subkutan in einer Fixdosis von 1.400 mg zu erhalten. Patienten, die auf die acht Zyklen der Induktionstherapie ansprachen, erhielten anschließend die für das follikuläre Lymphom als Standard geltende Erhaltungstherapie über insgesamt zwei Jahre mit einer Antikörper-Dosis alle zwei Monate, die ebenfalls randomisiert subkutan oder intravenös verabreicht wurde.
Die Stage-1-Analyse, in die 127 Patienten eingingen, zeigte, dass der primäre Endpunkt der Nicht-Unterlegenheit der subkutanen Gabe erreicht wurde. Die tiefsten Serumkonzentrationen (ctrough) lagen unter subkutanem Rituximab sogar etwas höher als unter dem i. v. gegebenen Antikörper. In einer explorativen Wirksamkeitsanalyse zeigte sich ein mindestens vergleichbares Therapieansprechen mit 90,5% Remissionen unter subkutanem im Vergleich zu 84,4% unter intravenösem Rituximab. Auch die Verträglichkeit beider Applikationsformen war vergleichbar – bis auf die infusionsbezogenen Reaktionen, die nur unter i. v. Rituximab auftraten. Nach der subkutanen Gabe wurden nur vorübergehende lokale Hautrötungen an der Injektionsstelle beobachtet.
Für die zweite Stufe der Studie war der primäre Endpunkt die Gesamtansprechrate. Die ersten Ergebnisse dazu stellte Andrew Davies, Southampton, bei der Jahrestagung der European Hematology Association (EHA) in Mailand vor [2]: Auch hier war das subkutane Rituximab mit 83,4% vs. 84,4% – bei 32,7% vs. 31,7% kompletten Remissionen – nicht unterlegen. Bei der Sicherheit ergaben sich hier keine neuen Signale; injektionsbedingte Reaktionen waren unter der subkutanen Gabe häufiger (47% vs. 33%), aber überwiegend vom Grad 1 oder 2.
Patienten bevorzugen Rituximab SC
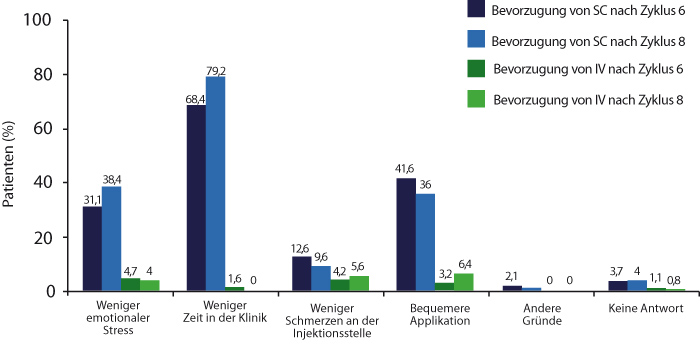
In der PrefMab-Studie wurden 433 Patienten mit FL oder DLBCL mit einer Induktionstherapie aus acht Zyklen Rituximab und Chemotherapie behandelt. In einem Crossover-Design erhielten sie dabei randomisiert zuerst eine
i. v.-Infusion, dann drei Dosen subkutan und die vier restlichen Dosen Rituximab i. v. oder aber zuerst vier Dosen i. v. und die vier letzten Dosen subkutan. In 190 bisher auswertbaren Präferenz-Fragebogen nach dem sechsten Zyklus, so Mathias Rummel, Gießen, bevorzugten 83% der Patienten die subkutane und nur 8% die intravenöse Gabe; in 125 Fragebögen nach dem achten Zyklus war das Verhältnis mit 86% vs. 9% vergleichbar [3]. Der wichtigste Grund dafür, dass die Patienten subkutanes Rituximab bevorzugten, war die geringere Verweildauer in der Klinik, gefolgt von weniger emotionalem Stress und der bequemeren Applikation.
Von der einfachen und raschen Gabe profitieren sowohl die Patienten, als auch die Ärzte und Pflegekräfte. „Die nun zugelassene subkutane Darreichungsform verbessert die Lymphom-Therapie weiter. Wir ermöglichen Patienten damit mehr therapiefreie Zeit – ohne Abstriche bei Wirksamkeit und Sicherheit. Die subkutane Gabe von Rituximab bedeutet damit einen Schritt hin zu mehr Lebensqualität in der Behandlung von follikulärem und diffus-großzelligem B-Zell-Lymphom“, so Dr. Ingo Schwaner, Prüfarzt in der Zulassungsstudie SABRINA und niedergelassener Hämatologe und Onkologe in Berlin. Im Vergleich zu der im Mittel ungefähr 2½-stündigen Infusionsdauer bei intravenöser Gabe ist die schnellere, lediglich fünf bis sieben Minuten dauernde subkutane Applikation ein wesentlicher Vorteil – auch für das medizinische Personal: Neben der Verkürzung der Therapiedauer wirkt sich aus, dass Rituximab subkutan als Fixdosis von 1.400 mg gegeben wird, sodass die Berechnung der Dosis anhand der Körperoberfläche entfällt.
jfg
Literatur:
1. Davies A et al. Lancet Oncol. 2014; 15: 343-52.
2. Davies A et al, Haematologica 2014; 99 (s1): 225 (EHA
2014, Abstract #S652).
3. Rummel MJ et al. Haematologica 2014; 99 (s1): 152-3
(EHA 2014, Abstract #P467).Launch-Pressekonferenz „Im Fokus: MabThera SC erhält die EU-Zulassung“ am 20 Mai 2014 in Berlin, veranstaltet von Roche Pharma, Grenzach-Wyhlen.
19th Congress of the European Hematology Association (EHA) vom 12.-15. Juni 2014 in Mailand.

