ASCO 2014 – Urologische Tumoren
Die Therapie urologischer Tumoren hat in den letzten Jahren im Großen und Ganzen gute Fortschritte gemacht – das lässt sich schon daran ablesen, dass urologische Themen es immer wieder in die Plenarsitzung der Jahrestagung der American Society of Clinical Oncology (ASCO) geschafft haben, wo jeweils die vier oder fünf wichtigsten onkologischen Studien des Jahres diskutiert werden. Auch in diesem Jahr gehörte eine Phase-III-Studie dazu, in deren Folge sich die Erstlinientherapie des metastasierten Prostatakarzinoms ändern dürfte: Androgendeprivation und Chemotherapie sollten zumindest bei Patienten mit ausgedehnter Metastasenlast nicht mehr sequenziell, sondern von Anfang an gemeinsam gegeben werden. Auch zu Nieren- und Blasentumoren gab es interessante Resultate, und nicht zuletzt zeigte sich, dass ein starker Trend in der Onkologie auch vor der Urologie nicht haltmacht: Moderne Immuntherapien mit „Checkpoint“-Inhibitoren machen in frühen klinischen Studien Hoffnung auf mehr Langzeitremissionen bei Nieren- und Blasenkarzinomen.
Für Patienten mit neu diagnostiziertem metastasiertem Prostatakarzinom ist bisher, was systemische Erstlinienbehandlungen angeht, eine Androgendeprivations-Therapie (ADT) der Standard. Erst wenn sich eine Hormonresistenz („Kastrationsresistenz“) entwickelt, gilt bislang eine Chemotherapie mit Docetaxel in Kombination mit Prednison als indiziert, die gegenüber einer Mitoxantron-Behandlung das Überleben um median 2,4 Monate verlängert hat [1]. Die Idee, die Chemotherapie gleich von Beginn an in Kombination mit der Hormontherapie einzusetzen, wurde nun von der US-amerikanischen Eastern Cooperative Oncology Group (ECOG, [2]) überprüft. Theoretisch gab es Argumente für und gegen diese Strategie, so Christopher Sweeney, Boston: Einerseits ist zwar vorstellbar, dass der frühe Angriff auf Tumorzell-Klone, die hormonunabhängig werden, mittels Chemotherapie zu einer längeren Remissionsdauer führt. Außerdem gibt es Patienten, die beim Auftreten der Kastrationsresistenz bereits zu gebrechlich sind, um noch eine Chemotherapie zu tolerieren. Auf der anderen Seite könnte die Hormondeprivation den Zellzyklus von Tumorzellen arretieren und diese damit unempfindlich gegenüber der zytotoxischen Behandlung machen. Im Übrigen sprechen manche Patienten sehr lange auf die Hormontherapie an und benötigen nie eine Chemotherapie. Eine große, randomisierte Phase-III-Studie war daher nötig, um diese Frage zu klären, und die ersten Ergebnisse sind so beeindruckend, dass das ASCO-Programmkomitee Sweeneys Präsentation für die Plenarsitzung in Chicago auswählte:
Insgesamt 790 Patienten mit neu diagnostiziertem hormonsensiblem und metastasiertem Prostatakarzinom begannen mit einer Androgendeprivation, und die Hälfte von ihnen erhielt höchsten vier Monate danach zusätzlich sechs Zyklen Docetaxel (75 mg/m2 alle drei Wochen ohne Prednison). Primärer Endpunkt war das Gesamtüberleben; angestrebt wurde eine signifikante Verlängerung des Medianwerts. Die Studie benötigte über sechs Jahre, um dieses Patientenkollektiv zu rekrutieren. Stratifiziert wurden die Patienten unter anderem anhand ihrer Metastasenlast: „High volume“ bedeutete das Vorliegen von viszeralen Metastasen und/oder mindestens vier Knochenfiliae, davon mindestens eine außerhalb von Becken und Wirbelsäule.
Das Ergebnis nach median 29 Monaten Nachbeobachtung fiel beeindruckend eindeutig aus: 137 Patienten waren in der Kontrollgruppe verstorben, aber nur 104 in der experimentellen Gruppe. Die Patienten im Kontrollarm hatten median 44 Monate lang überlebt, die im Docetaxel-Arm hingegen 57,6 Monate. Im Log-rank-Test ergab sich eine Hazard Ratio von 0,61, d. h. eine Reduktion des Mortalitätsrisikos um 39% (p = 0,0003). In Subgruppen betrachtet, zeigt sich ein wirklicher Vorteil derzeit nur bei den Patienten mit „High volume“-Metastasierung: Hier betrug der Überlebensunterschied 49,2 vs. 32,2 Monate mit einer Hazard Ratio von 0,60 (p = 0,0006), bei den Patienten mit weniger starker Metastasierung waren die medianen Überlebenszeiten in beiden Armen noch nicht erreicht, die Hazard Ratio liegt auch bei 0,63, aber der Unterschied ist (noch?) nicht signifikant (p = 0,1398).
Von der Docetaxel-Zugabe schienen alle untersuchten Subgruppen (Alter, Metastasenlast, Ethnie, Gleason-Score, vorangegangene Lokaltherapie, Länge der Hormontherapie, Skelettkomplikationen) zu profitieren, wenn auch bei teilweise kleinen Gruppengrößen der Unterschied nicht immer signifikant ausfiel. Auch bei den sekundären Endpunkten (Halten eines PSA-Werts von < 0,2 ng/ml nach sechs und zwölf Monaten, mediane Zeit bis zum Auftreten einer Kastrationsresistenz und klinischer Progression) schnitt die Chemotherapie-Gruppe hochsignifikant besser ab (für alle Endpunkte p < 0,0001).
Dass die Behandlung gut verträglich war, erkennt man schon daran, dass 87,5% der Patienten im Docetaxel-Arm alle sechs Zyklen erhielten, 74% ohne Dosismodifikationen. Hauptnebenwirkung von Docetaxel waren Neutropenien, die aber nur bei 6% der Patienten vom Grad 3 oder 4 waren. Neuropathien wurden selten beobachtet.
Es steht damit außer Zweifel, so der Diskutant Michael Morris, New York, dass die Gabe von Docetaxel beim metastasierten Prostatakarzinom von Anfang an zusammen mit der Androgendeprivation bei Patienten mit ausgedehnter Metastasierung, wie sie in dieser Studie definiert war, einen beträchtlichen Überlebensvorteil gegenüber der verzögerten Gabe erst nach Entwicklung einer Kastrationsresistenz bringt. Bei Patienten mit weniger ausgedehnter Tumorlast sind die Verhältnisse noch nicht so eindeutig; hier muss man die weitere Entwicklung der Daten abwarten.
Ausgedehntere Metastasierung = kürzeres Überleben
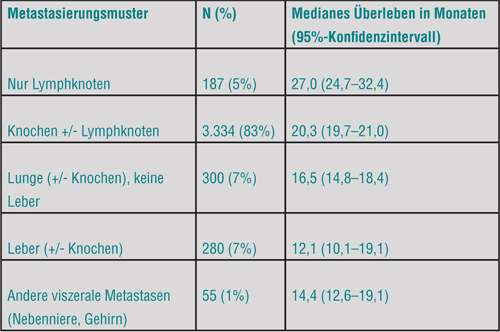
Dass die Prognose von Männern mit kastrationsresistentem Prostatakarzinom von der Lokalisation ihrer Fernmetastasen abhängt, wird seit geraumer Zeit vermutet, aber die entsprechenden Daten stammten bisher lediglich aus kleinen Kollektiven. In einer großen Metaanalyse werteten Susan Halabi, Durham, und Kollegen deshalb die Daten von 3.993 Patienten mit kastrationsresistenten Tumoren aus, die in fünf Phase-III-Studien in Arme mit Docetaxel-basierter Chemotherapie randomisiert worden waren [5]. Die Patienten wurden nach der Metastasierungslast stratifiziert, und das Ergebnis war eindrucksvoll, wenn auch nicht gänzlich unerwartet: Patienten mit Lungenmetastasen hatten ein um 30% höheres Mortalitätsrisiko als diejenigen ohne jegliche viszerale Metastasen (Hazard Ratio 1,3; p < 0,001). Für Patienten mit Leberfiliae wiederum war das Risiko um weitere 40% höher als bei denen mit Metastasen nur in der Lunge (HR 1,4; p < 0,001). Die medianen Überlebenszeiten für die einzelnen Kategorien sind in Tabelle 1 aufgeführt.
Androgenrezeptor-Blocker vor Chemotherapie hochwirksam
trationsresistentem Prostatakarzinom (mCRPC) gibt es eine Reihe von therapeutischen Optionen: Neben einer Chemotherapie mit zum Beispiel Docetaxel stehen mittlerweile auch Inhibitoren sowohl der Androgen-Synthese (Abirateronacetat) als auch des Androgen-Rezeptors (Enzalutamid) zur Verfügung. Enzalutamid ist bisher zugelassen bei Progression während oder nach Docetaxel; in der PREVAIL-Studie wurde der Einsatz bei Patienten getestet, die nach Androgendeprivations-Therapie progredient gewesen waren [3]. 872 dieser Patienten hatten randomisiert Enzalutamid erhalten, 845 Placebo.
Schon die mediane Behandlungsdauer von 16,6 vs. 4,6 Monaten deutet darauf hin, dass der Rezeptorblocker deutlich wirksamer war, weshalb das Data Monitoring Committee die Studie auch nach der ersten Interimsanalyse beendete, wie Andrew Armstrong, Durham, berichtete: Das nach radiologischen Kriterien bestimmte progressionsfreie Überleben betrug in der Placebo-Gruppe median 3,9 Monate, unter Enzalutamid war der Medianwert noch nicht erreicht (Hazard Ratio 0,186; p < 0,0001). Auch beim Gesamtüberleben war der Rezeptorblocker mit median 32,4 vs. 30,2 Monaten bzw. Überlebensraten nach 18 Monaten von 82% vs. 73% hochsignifikant überlegen (HR 0,706; p < 0,0001). 70% der Patienten in der Placebo-, aber nur 40% derer in der Enzalutamid-Gruppe benötigten bislang eine weitere Therapie. Die mediane Zeit bis zum Einsatz einer Chemotherapie wurde durch Enzalutamid um beinahe eineinhalb Jahre verlängert (28 vs. 10,8 Monate; HR 0,349; p < 0,0001). Auch das PSA-Ansprechen war unter dem Androgenrezeptor-Inhibitor wesentlich stärker, ebenso die Verzögerung der Zeit bis zu einer erneuten PSA-Progression (median 11,2 vs. 2,8 Monate; HR 0,169; p < 0,0001). Viszerale Metastasen sprachen auf Enzalutamid zu 59% an, unter Placebo nur zu 5%, die Zeit bis zum Auftreten von Skelettkomplikationen war ebenfalls hochsignifikant verlängert (HR 0,718; p < 0,0001).
Die Lebensqualität wurde durch die Rezeptorblockade in allen Bereichen signifikant stärker verbessert als durch Placebo, und die Enzalutamid-Behandlung war gut verträglich mit nur wenigen Grad-3/4-Nebenwirkungen, darunter vor allem ein Hypertonus bei 6,8% der Patienten. Die Zugabe von Enzalutamid bei Beginnen einer Krankheitsprogression unter Androgendeprivation kann diesen Patienten also einen klinisch relevanten Nutzen bescheren, so Armstrong.
Androgen-Synthese und –Rezeptor blockieren
Viel hilft viel – nach diesem Prinzip sollte die duale Androgenblockade mit Rezeptor- und Syntheseinhibitor noch effektiver sein. Überprüft wurde diese Hypothese in einer Phase-I-Studie, in der Enzalutamid bei Patienten mit kastrationsresistentem Prostatakarzinom mit Abirateronacetat kombiniert wurde [4]. Die pharmakodynamischen Messungen zeigten, dass es keine klinisch relevanten Interaktionen zwischen beiden Medikamenten gab, so Eleni Efstathiou, Athen. Elf der 60 Patienten brachen die Therapie innerhalb von vier Monaten wegen einer Progression ab; das wurde als primäre Resistenz bewertet und wirkte sich hochsignifikant auf das Gesamtüberleben aus (p = 0,0002). Adaptive oder Feedback-Mechanismen, wie sie mit den beiden Einzelsubstanzen beobachtet werden, traten unter der Kombination nicht auf. Die differenzielle Expression verschiedener Splice-Varianten des Androgenrezeptors, wie sie immunhistochemisch bestimmt werden kann, scheint geeignet, eine primäre Resistenz vorherzusagen und könnte sich Efstathiou zufolge als Biomarker eignen: Damit könnte man gezielt Patienten auswählen, die einen Nutzen von einer Therapie mit Androgeninhibitoren haben.
Nicht-klarzelliges Nierenzellkarzinom: Everolimus nicht überlegen
Dass das Nierenzellkarzinom eine große Vielfalt von histologischen Subtypen umfasst, hat zuletzt die neue WHO-Klassifikation in Erinnerung gerufen (s. Artikel S. 78). In den meisten Therapiestudien ist in erster Linie der häufigste Subtyp, das klarzellige Karzinom vertreten. Ob die getesteten Therapien bei anderen Typen wirklich wirksam sind, ist nicht immer ganz klar, auch wenn solche Tumoren im Patientenkollektiv vertreten waren wie zum Beispiel in der Zulassungsstudie für Temsirolimus [6]. Für Sunitinib gibt es widersprüchliche Daten, in einer einarmigen Phase-II-Studie mit metastasiertem nicht-klarzelligem Nierenkarzinom wurde eine Ansprechrate von 5% und eine mediane progressionsfreie Überlebenszeit von 2,7 Monaten gesehen [7].
Ziel einer randomisierten Phase-II-Studie, die Nizar Tannir, Houston, beim ASCO-Kongress vorstellte, war deshalb der Vergleich der mTOR-Inhibition in Form von Everolimus mit der Inhibition des VEGF-Rezeptors durch Sunitinib in der Erstlinientherapie von nicht-klarzelligen Nierenzellkarzinomen [8]. Die zu testende Hypothese war, dass Everolimus die progressionsfreie Überlebenszeit von zwölf Wochen unter Sunitinib auf mindestens 20 Wochen verlängern würde.
De facto war bei den 68 auswertbaren Patienten dann allerdings Sunitinib mit 6,1 vs. 4,1 Monaten numerisch überlegen, auch wenn dieses Ergebnis keine statistische Signifikanz erreichte (p = 0,6). In der Sunitinib-Gruppe hatten 24, in der Everolimus-Gruppe 20 Patienten im Rahmen eines Crossover-Designs die jeweils andere Substanz als Zweitlinientherapie erhalten: Das progressionsfreie Überleben fiel hier mit 2,8 vs. 1,8 Monaten zugunsten von Everolimus aus (p = 0,6), aber beim Gesamtüberleben war wiederum Sunitinib überlegen – wenngleich nicht signifikant mit 16,2 vs. 14,9 Monaten (p = 0,18). Chromophobe Nierenzellkarzinome zeigten mit beiden Medikamenten besseres Ansprechen und längeres progressionsfreies sowie Gesamtüberleben (Everolimus 25,1, Sunitinib 31,6 Monate) als die übrigen Histologien. Das Data Safety and Monitoring Board empfahl bereits nach der zweiten Interimsanalyse, die Rekrutierung weiterer Patienten in die Studie einzustellen. Everolimus, so Tannir, kann als Erstlinientherapie des nicht-klarzelligen Nierenzellkarzinoms demnach nicht empfohlen werden.
Adjuvante Therapie des Blasenkarzinoms überlegen
Patienten mit muskelinvasivem Blasenkarzinom (pT3 oder T4 oder mit Lymphknotenmetastasen) haben auch nach radikaler Zystektomie eine schlechte Prognose: Nach fünf Jahren lebt nur mehr ungefähr die Hälfte von ihnen, vermutlich weil häufig bereits bei Diagnose eine systemische (Mikro-)Metastasierung vorliegt. Wenn die Metastasierung manifest wird, ist eine Cisplatin-haltige Chemotherapie die gängige Erstlinienbehandlung. Ob es den Patienten einen Nutzen bringt, diese Chemotherapie vorzuziehen und sie in einem adjuvanten Setting sofort nach der radikalen Operation einzusetzen, war auch nach einer 2005 erschienenen Metaanalyse [9] nicht klar. Die Fragestellung sollte deshalb in einer 2002 begonnenen, groß angelegten randomisierten Intergroup-Studie der EORTC (European Organization for Research and Treatment of Cancer) noch einmal untersucht werden, deren Ergebnisse seit Langem mit Interesse erwartet werden [10]. Die auf ursprünglich 1.344 und nach einem Amendment auf 660 Patienten geplante Studie musste trotz positiver Signale des unabhängigen Data Monitoring Committee wegen schleppender Rekrutierung nach Einschluss von 284 Patienten geschlossen werden, wie Cora Sternberg, Rom, in Chicago mitteilte. Zur Auswahl stand eine von drei Platin-basierten Chemotherapien (Gemcitabin/Cisplatin, MVAC [Methotrexat, Vinblastin, Doxorubicin, Cisplatin] in normaler oder Hochdosis); sie wurde im adjuvanten Arm innerhalb von 90 Tagen nach der Zystektomie mit vier Zyklen, im Kontrollarm beim Auftreten eines Rezidivs mit sechs Zyklen gegeben. Die Patienten wurden mindestens fünf Jahre nachbeobachtet.
Beim sekundären Endpunkt progressionsfreies Überleben war die adjuvante Chemotherapie deutlich überlegen, so Frau Sternberg, mit median 2,9 vs. 0,9 Jahren bzw. einer progressionsfreien 5-Jahres-Überlebensrate von 46,8% vs. 29,5% (Hazard Ratio 0,52; p < 0,0001). Beim primären Endpunkt Gesamtüberleben war die Überlegenheit zwar numerisch ebenfalls eindeutig sichtbar, aber sie fiel, vermutlich aufgrund der geringen Patientenzahl, statistisch nicht signifikant aus: 6,8 vs. 4,6 Jahre oder 53,6% bzw. 47,7% überlebende Patienten nach fünf Jahren (HR 0,78; p = 0,13). Eine exploratorische Analyse suggeriert, dass der Überlebensvorteil vor allem für nodal negative Patienten relevant sein könnte. Grad-3/4-Toxizitäten im adjuvanten Arm umfassten Myelosuppression (26%), Neutropenie (38%) und Thrombozytopenie (28%); ein Patient verstarb hier aufgrund solcher Nebenwirkungen.
Diese bisher größte Adjuvanz-Studie zum muskelinvasiven Blasenkarzinom, so Frau Sternberg, zeigt immerhin eine 22%-ige Reduktion des Mortalitätsrisikos, auch wenn diese nicht signifikant ausfällt. Ein Grund dafür dürfte sein, dass nicht einmal halb so viele Patienten wie ursprünglich geplant in die Studie eingeschlossen worden waren. Dringend erforderlich sei zunächst eine Wiederholung der Metaanalyse von 2005 unter Einschluss dieser Daten, die dann vielleicht endlich definitive Aussagen zum Nutzen dieser Therapie gestatten könnte.
Immuntherapien bei Blasen- und Nierenzellkarzinom
Immuntherapien, insbesondere solche mit „Checkpoint“-Inhibitoren, genießen nicht nur, aber auch bei ASCO-Kongressen derzeit besondere Aufmerksamkeit. Immun-„Checkpoints“ sind Kontrollmechanismen, mit denen die Aktivität von Immunzellen gebremst wird, um beispielsweise Autoimmunreaktionen zu verhindern. Weniger erwünscht sind diese immunologischen „Bremsen“, wenn es um die Bekämpfung von Tumorzellen durch das Immunsystem geht. Ein tieferes molekulares Verständnis einiger zugrundeliegender Mechanismen hat in den letzten Jahren die Entwicklung neuartiger Medikamente ermöglicht, mit denen sich zum Beispiel T-Lymphozyten aktivieren lassen. Am weitesten fortgeschritten sind diese Bemühungen derzeit beim malignen Melanom, aber auch bei Lungen- und urologischen Tumoren gibt es ermutigende Resultate.
Zwei Mechanismen stehen derzeit im Fokus des Interesses: Das „Checkpoint“-Molekül CTLA-4 (Cytotoxic T-Lymphozyte Antigen 4) wird durch den beim metastasierten Melanom bereits zugelassenen monoklonalen Antikörper Ipilimumab blockiert, der rund 20% dieser Patienten ein Langzeitüberleben zu ermöglichen scheint. Der zweite Mechanismus beruht auf zwei Molekülen, die auf der T-Zelle (PD-1, „Programmed Death 1“) bzw. auf Tumorzellen (PD-L1, „PD-Ligand 1“) exprimiert werden. Bindet PD-L1 an PD-1, so wird die Anti-Tumor-Wirkung der betreffenden T-Zelle dadurch blockiert. Inhibitoren sowohl von PD-1 als auch von PD-L1 befinden sich derzeit in der klinischen Entwicklung – mit teilweise aufsehenerregenden Resultaten, von denen einige auch bei urologischen Tumoren gewonnen und beim ASCO-Kongress vorgestellt wurden.
PD-1-Inhibition beim Nierenzellkarzinom
Für den PD-1-Antikörper Nivolumab hatte eine Phase-I-Studie beim vorbehandelten metastasierten Nierenzellkarzinom bereits ein vielversprechendes Signal ergeben [11]; in einer Phase-II-Studie, die Robert Motzer, New York, in Chicago vorstellte [12], wurden 168 Patienten, die sämtlich bereits anti-angiogenetische Therapien erhalten hatten, mit drei verschiedenen Dosen Nivolumab behandelt. Es zeigte sich zwar keine Dosisabhängigkeit beim Ansprechen, aber von 35 Respondern konnten 19 ihr Ansprechen für mehr als zwölf Monate (bis zu über 20 Monate) halten, so Motzer. Die medianen Überlebenszeiten von 18,2, 25,5 und 24,7 Monaten für die drei Dosiskohorten übertreffen alles, was in dieser Indikation bisher in Phase-III-Studien gesehen wurde, sodass jetzt eine Phase-III-Studie geplant ist, in der Nivolumab direkt mit Everolimus verglichen werden soll.
In einer Phase-I-Studie wurde Nivolumab bei ebenfalls vorbehandelten Patienten mit Nierenzellkarzinom in Kombination mit entweder Sunitinib oder Pazopanib getestet [13]. Die Ansprechraten von rund 50% lagen höher als sie mit den entsprechenden Monotherapien zu erwarten gewesen wären. Allerdings traten auch renale und hepatische Nebenwirkungen häufiger auf als erwartet, so Asim Amin, Charlotte, sodass die weitere Entwicklung solcher Kombinationen mit Vorsicht zu gestalten sein wird.
In einer weiteren Phase-I-Studie wurde Nivolumab bei 46 Patienten, die an neu diagnostiziertem oder vorbehandeltem Nierenzellkarzinom litten, mit dem CTLA-4-Antikörper Ipilimumab kombiniert. Abhängig von der Ipilimumab-Dosierung sprachen 43% bzw. 48% der Patienten an, das mediane progressionsfreie Überleben lag bei 36,6 bzw. 38,3 Monaten, so Hans Hammers, Baltimore [14]. Von den Patienten, die nach sechs Wochen angesprochen hatten, konnten rund 80% diese Remissionen langfristig halten, bei 33% bzw. 45% von ihnen war dies sogar trotz des Absetzens der Therapie der Fall. Eine Phase-III-Studie mit dieser Kombination ist nun geplant.
PD-L1-Inhibitor beim Blasenkarzinom
Der Antikörper MPDL3280A gegen PD-L1 wurde in einer Phase-I-Studie bei bisher 67 Patienten mit metastasiertem urothelialem Blasenkarzinom geprüft [15]. Die Ansprechraten von bis zu 50% waren höher, wenn sich im Tumor PD-L1 nachweisen ließ, so Thomas Powles, London, aber auch bei PD-L1-negativen Tumoren wurden Remissionen gefunden. Bei 16 von 17 Respondern halten sie noch an.
Diese Studien sind sicherlich erst der Anfang, wie auch die Entwicklung beim malignen Melanom zeigt. Die Entwicklungen der nahen Zukunft darf man mit Spannung erwarten.
Literatur
1. Tannock IF et al. N Engl J Med 2004; 351: 1502-12.
2. Sweeney C et al. J Clin Oncol 2014; 32 (15S): 3s (ASCO 2014, Abstract #LBA2).
3. Armstrong AJ et al. J Clin Oncol 2014; 32 (15S): 324s (ASCO 2014, Abstract #5007).
4. Efstathiou E et al. J Clin Oncol 2014; 32 (15S): 323s (ASCO 2014, Abstract #5000).
5. Halabi S et al. J Clin Oncol 2014; 32 (15S): 323s (ASCO 2014, Abstract #5002).
6. Hudes G et al. N Engl J Med 2007; 356: 2271-81.
7. Tannir NM et al. Eur Urol 2012; 62: 1013-9.
8. Tannir NM et al. J Clin Oncol 2014; 32 (15S): 297s (ASCO 2014, Abstract #4505).
9. Advanced Bladder Cancer (ABC) Metaanalysis Collaboration. Eur Urol 2005; 48: 189-99.
10. Sternberg C et al. J Clin Oncol 2014; 32 (15S): 296s (ASCO 2014, Abstract #4500).
11. Topalian SL et al. N Engl J Med 2012; 366: 2443-54.
12. Motzer RJ et al. J Clin Oncol 2014; 32 (15S): 325s (ASCO 2014, Abstract #5009).
13. Amin A et al. J Clin Oncol 2014; 32 (15S): 325s (ASCO 2014, Abstract #5010).
14. Hammers H et al. J Clin Oncol 2014; 32 (15S): 297s (ASCO 2014, Abstract #4504).
15. Powles T et al. J Clin Oncol 2014; 32 (15S): 325s (ASCO 2014, Abstract #5011).

Prof. Dr. med. Jürgen E. Gschwend
Direktor der Urologischen Klinik
und Poliklinik Klinikum rechts der Isar
der Technischen Universität München
Ismaninger Strasse 22
81675 München

