ASCO 2014 – Neues zu Lungentumoren
Die Therapie vor allem von nicht-kleinzelligen Lungentumoren hat in den letzten zehn Jahren große Fortschritte gemacht – in erster Linie durch die bessere Erforschung onkogener Signaltransduktions-Mechanismen, die in die Entwicklung zielgerichteter Therapeutika mündete. Die Situation ist aber weit davon entfernt, zufriedenstellend zu sein: Es ist in der Regel früher oder später eine Resistenzentwicklung gegen zielgerichtete Substanzen wie Tyrosinkinaseinhibitoren zu beobachten, und die Therapieoptionen etwa für Plattenepithelkarzinome haben nicht die gleichen Fortschritte gemacht wie die für Adenokarzinome. Das Problem der sog. akquirierten Resistenz wird derzeit vor allem durch die Entwicklung immer neuer Inhibitoren vor allem für den EGF-Rezeptor oder für angiogenetische Wirkprinzipien angegangen. Dazu gab es bei der Jahrestagung der American Society of Clinical Oncology (ASCO) in Chicago eine Reihe von interessanten Studienergebnissen. Einige dieser neuen Substanzen wirken nun sogar bei dem bisherigen „Stiefkind“, dem Plattenepithelkarzinom. Moderne Immuntherapien haben den großen Vorteil, dass sich gegen sie kaum Resistenzen entwickeln. Sie sind am weitesten in der Dermatoonkologie fortgeschritten, haben aber bei diesem Kongress auch bei Lungentumoren erste vielversprechende Ergebnisse gezeitigt. Außerdem gab es interessante Beiträge zum kleinzelligen Lungenkarzinom sowie für lokal fortgeschrittene Lungentumoren.
Lokal fortgeschrittene, inoperable nicht-kleinzellige Lungenkarzinome im Stadium III werden derzeit mit gleichzeitiger Chemoradiotherapie in kurativer Intention behandelt. Eine anschließende Konsolidierung mittels Chemotherapie schien in einer Phase-II-Studie vielversprechend [1], der Nutzen konnte aber in zwei Phase-III-Studien nicht bestätigt werden [2, 3]. In einer weiteren großen Phase-III-Studie erhielten deshalb 437 Patienten nach definitiver Chemoradiotherapie randomisiert entweder drei weitere dreiwöchige Zyklen Docetaxel/Cisplatin (jeweils 35 mg/m2 an den Tagen 1 und 8) oder wurden nur beobachtet [4]. Nach median 50,7 Monaten unterschieden sich die beiden Arme weder beim primären Endpunkt progressionsfreies Überleben (9,1 vs. 8,1 Monate, Hazard Ratio 0,906; p = 0,39) noch beim Gesamtüberleben (21,8 vs. 20,6 Monate; HR 0,911; p = 0,49). Bis auf Weiteres, so Keunchil Park, Seoul, bleibt die Chemoradiotherapie damit die Behandlung der Wahl beim inoperablen Stadium-III-NSCLC. Die konsolidierende Chemotherapie nach definitiver Radiochemotherapie kann somit keinesfalls als Standard angesehen werden. Ob Subgruppen dennoch profitieren könnten, sollte weiter analysiert werden.
Zweitlinientherapie des NSCLC: Erfolg mit Anti-Angiogenese
Anti-angiogenetische Therapiestrategien sind auch beim nicht-kleinzelligen Lungenkarzinom (NSCLC) bereits in Gebrauch, allerdings ist der gegen den vaskulären endothelialen Wachstumsfaktor (VEGF) gerichtete Antikörper Bevacizumab nur für Nicht-Plattenepithelkarzinome in der First-line zugelassen. Gegen einen Rezeptor für VEGF richtet sich der monoklonale Antikörper Ramucirumab, der in der Phase-III-Studie REVEL bei mit Platin vorbehandelten Patienten mit NSCLC jeder Histologie das Überleben signifikant verlängern konnte:
Die Zweitlinientherapie des NSCLC wird derzeit noch weitgehend von der Chemotherapie beherrscht (Docetaxel, Pemetrexed, Erlotinib) – mit medianen Überlebenszeiten von sieben bis acht Monaten. Auch das NSCLC ist zur Sicherung seiner Versorgung mit Nährstoffen ebenso wie andere Tumoren stark auf die Angiogenese angewiesen, die seit geraumer Zeit als wichtiges Ziel der Tumortherapie erkannt ist. Sie ist hier vor allem vom Typ A des vaskulären endothelialen Wachstumsfaktors (VEGF-A) und seinem Typ-2-Rezeptor (VEGFR-2) abhängig. Der humane monoklonale IgG1-Antikörper Ramucirumab, der sich gegen die extrazelluläre Domäne dieses Rezeptors richtet, hat in zwei Phase-III-Studien beim Magenkarzinom überzeugt und mittlerweile auch beim NSCLC in Phase-I/II-Studien vielversprechende Ergebnisse gezeitigt.
Maurice Perol, Lyon, präsentierte nun in Chicago die ersten Daten der Phase-III-Studie REVEL, in der Ramucirumab in Kombination mit Docetaxel bei 1.253 mit Platin-haltiger Chemotherapie vorbehandelten Patienten mit NSCLC gegen Docetaxel alleine getestet wurde [5]. Die Rekrutierung war hinsichtlich der Histologie nicht eingeschränkt: Plattenepithel- ebenso wie Nicht-Plattenepithelkarzinome der Lunge konnten eingeschlossen werden. Ramucirumab (10 mg/kg) bzw. Placebo wurde zugleich mit Docetaxel (75 mg/m2) an Tag 1 der dreiwöchigen Therapiezyklen bis zum Progress oder bis zum Auftreten inakzeptabler Toxizität gegeben. Primärer Endpunkt war das Gesamtüberleben.
Ramucirumab war dem Placebo bei allen Parametern signifikant überlegen: bei der Ansprechrate (22,9% vs. 13,6%; p < 0,001) ebenso wie beim progressionsfreien (median 4,5 vs. 3,0 Monate; Hazard Ratio 0,762; p < 0,0001) und beim Gesamtüberleben (10,5 vs. 9,1 Monate; HR 0,857; p = 0,0235). Dieser Überlebensvorteil war in nahezu allen Subgruppen zu sehen, insbesondere auch bei den Plattenepithelkarzinomen. Nebenwirkungen vom Grad 3 oder 4 waren unter dem Antikörper etwas häufiger als unter Placebo: Neutropenie 34,9% vs. 28,0%, febrile Neutropenie 15,9% vs. 10,0%, Fatigue 11,3% vs. 8,1%, Leukopenie 8,5% vs. 7,6%, Hypertonus 5,4% vs. 1,9%, Pneumonie 5,1% vs. 5,8%. Todesfälle waren mit 5,4% bzw. 5,8% in beiden Armen gleich häufig, und auch die Inzidenz von Lungenblutungen aller Schweregrade war vergleichbar: 2,1% vs. 1,6%, bei Patienten mit Plattenepithelkarzinom waren sie mit 3,8% vs. 2,4% etwas häufiger.
Diese anti-angiogenetische Therapie kann damit wie bereits für der niedermolekulare VEGFR- und FGFR-Inhibitor Nintedanib das Überleben von Patienten mit NSCLC im Stadium IV nach Versagen einer Platin-basierten Erstlinientherapie verlängern, so Perol, und das bei einem moderaten Nebenwirkungsprofil, wie man es bei einer anti-angiogenetischen Therapie erwarten würde. Das Überleben als primärer Endpunkt war statistisch signifikant verlängert, allerdings mit einer Hazard Ratio, die mit 0,857 deutlich über der von den Zulassungsbehörden postulierten klinisch relevanten Grenze von 0,8 lag.
NSCLC: Weitere Individualisierung der Therapie
Der prädiktive Wert molekularer Marker wird durch Studienergebnisse immer weiter verfeinert: Patienten mit NSCLC profitieren von der Erstlinientherapie mit dem ErbB-Family-Blocker Afatinib mit einem deutlichen Überlebensvorteil – aber nur diejenigen mit einer ganz bestimmten Mutation (einer Deletion Exon 19) im Rezeptor für epidermalen Wachstumsfaktor (EGFR).
Beim primären Endpunkt progressionsfreies Überleben hatte sich in den beiden großen Phase-III-Studien LUX-Lung 3 und LUX-Lung 6 bereits im vergangenen Jahr ein deutlicher Vorteil für eine Erstlinientherapie mit Afatinib im Vergleich zu einer Platin-basierten Chemotherapie (mit Pemetrexed bzw. Gemcitabin) gezeigt [6, 7]. Beim diesjährigen ASCO-Kongress präsentierte James Yang, Taipeh, die Ergebnisse zu einem der sekundären Endpunkte, dem Gesamtüberleben [8]:
In einer kombinierten präspezifizierten Subgruppenanalyse der Patienten aus beiden Studien mit den häufigsten EGFR-Mutationen (Deletion Exon 19 und L858R – bei 89% aller Tumoren) wurde das Gesamtüberleben signifikant um drei Monate verlängert (median 27,3 vs. 24,3 Monate; Hazard Ratio 0,81; p = 0,0374). Bei der getrennten Untersuchung beider Mutationen zeigte sich ein Überlebensvorteil nur für Patienten mit der häufigsten EGFR-Mutation beim NSCLC, del(19), die bei ca. 50% aller Tumoren nachgewiesen wird: Bei ihnen verlängerte sich die mediane Überlebenszeit um mehr als ein Jahr. So überlebten die Patienten mit del(19) im Chemotherapie-Arm in LUX-Lung 3 median 21,1 Monate, im Afatinib-Arm hingegen 33,3 Monate – das ist ein Unterschied von 12,2 Monaten (Hazard Ratio 0,54, d. h. das Mortalitätsrisiko war um 46% erniedrigt; p = 0,0015;
Abb. 1 links). In LUX-Lung 6, wo nur asiatische Patienten eingeschlossen worden waren, war der Unterschied mit median 31,4 vs. 18,4 Monaten ähnlich groß (HR 0,64; p = 0,0229; Abb. 1 rechts). Bei Patienten mit L858R-Mutation hingegen wurde das Überleben durch Afatinib nicht beeinflusst.
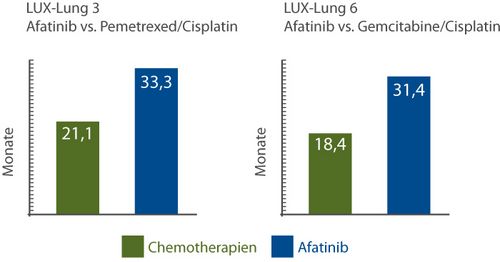
Afatinib ist damit das erste Medikament, so Yang, von dem Patienten mit bestimmten Mutationen mit einer deutlich längeren Überlebenszeit profitieren. Daher wird man künftig auch im klinischen Alltag bezüglich der Erstlinienbehandlung zwischen Patienten mit del(19) bzw. L858R-Mutation im EGFR-Gen unterscheiden müssen. Aufgrund der positiven Ergebnisse von LUX-Lung 3 und 6 für Ansprechen, progressionsfreies Überleben, Lebensqualität und Toxizität bleibt die Empfehlung bestehen, Patienten vor Beginn der Erstlinientherapie auf Mutationen zu testen und Patienten mit aktivierenden EGFR-Mutationen einer First-line-Therapie mit einem Tyrosinkinaseinhibitor zuzuführen.
Mutanten-selektive Inhibitoren
Die Therapie mit EGFR-Tyrosinkinaseinhibitoren der ersten (Erlotinib, Gefitinib) und zweiten Generation (Afatinib) führt oft nach einer bestimmten Zeit zu Resistenz-vermittelnden Mutationen. Die häufigste davon stellt die T790M-Mutation im Exon 20 dar, die bei etwa 50–60% aller Patienten mit akquirierter Resistenz auftritt. Gegen diese Mutation gibt es nun hochspezifische Inhibitoren, die mittlerweile die ersten klinischen Tests durchlaufen haben:
• CO-1686 hemmt neben anderen häufigen Mutationen auch T790M, nicht jedoch den Wildtyp-Rezeptor. In einer Phase-I/II-Studie wurde in allen getesteten Dosierungen vielversprechende Aktivität beobachtet [9]: So sprachen 58% aller zum Teil stark vorbehandelten Patienten mit T790M-Mutation an, und auch bei Hirnmetastasen waren Remissionen zu sehen. Die mediane progressionsfreie Überlebenszeit ist noch nicht erreicht und überschreitet jedenfalls die 1-Jahres-Marke deutlich. Die Substanz soll nun in einem Studienprogramm weiterentwickelt werden, in dem sie randomisiert beispielsweise gegen Erlotinib und gegen Chemotherapie getestet wird. Das Nebenwirkungsspektrum von CO-1686 ist frei von typischer Wildtyp-EGFR-vermittelter Toxizität wie Diarrhö oder Hautveränderungen; allerdings wurden behandlungsbedürftige Hyperglykämien beobachtet.
• AZD9291, ein weiterer Drittgenerations-EGFR-Inhibitor, der ebenfalls den Rezeptor mit der T790M-Mutation hemmt, wurde in einer Phase-I-Studie bei 199 Patienten mit NSCLC und einer erworbenen Resistenz gegen herkömmliche Inhibitoren geprüft [10]. Er zeigte Aktivität insbesondere bei Vorliegen der T790M-Mutation mit einer Ansprechrate von 64% (Krankheitskontrollrate 96%), während sie bei Patienten mit anderen Mutationen bei lediglich 23% lag. Die längste Remission dauert seit mehr als acht Monaten an.
EGFR-Inhibitor plus Angiogenesehemmer von Anfang an?
Eine weitere Möglichkeit, die Prognose von Patienten mit NSCLC mit EGFR-Mutationen zu verbessern, könnte die Kombination von EGFR-Tyrosinkinaseinhibitoren mit anti-angiogenetischen Wirkprinzipien von Anfang an sein. Die BeTa-Lung-Studie hatte einen Überlebensvorteil einer Kombination aus Erlotinib und dem VEGF-Antikörper Bevacizumab bei mit Chemotherapie vorbehandelten Patienten gezeigt [11]. In einer japanischen Phase-III-Studie erhielten deshalb 154 Patienten mit unbehandeltem NSCLC und EGFR-Mutationen randomisiert entweder Erlotinib und Bevacizumab oder Erlotinib alleine [12]. Beim primären Endpunkt progressionsfreies Überleben war die Kombination deutlich und statistisch signifikant überlegen mit median 16,0 vs. 9,7 Monaten (HR 0,54; p = 0,0015). Die Lebensqualität wurde durch die Zugabe von Bevacizumab nicht signifikant beeinträchtigt. Um die Daten zum Gesamtüberleben auszuwerten, ist es noch zu früh. Die Remissionsrate war in beiden Armen vergleichbar; warum Bevacizumab zu einer Verzögerung der Resistenzentwicklung führt, ist unklar und bedarf weiterer konfirmatorischer Studien.
ALK-Inhibitoren in der Erstlinientherapie des NSCLC
Die kleine Gruppe der ALK-positiven Nicht-Plattenepithelkarzinome der Lunge hat in den letzten Jahren durch die Entwicklung und Zulassung des ersten spezifischen ALK-Inhibitors Crizotinib für vorbehandelte Tumoren dieser Art große Beachtung erfahren. In einer Phase-III-Studie wurde Crizotinib in einer Dosierung von 250 mg zweimal täglich nun in der Erstlinie randomisiert gegen eine Chemotherapie aus bis zu sechs dreiwöchigen Zyklen aus Pemetrexed plus Cisplatin oder Carboplatin getestet [13]. Bei Progression war für die Patienten der Kontrollgruppe ein Crossover zu Crizotinib möglich.
Der ALK-Inhibitor war beim primären Endpunkt progressionsfreies Überleben signifikant überlegen (median 10,9 vs. 7,0 Monate; Hazard Ratio 0,454; p < 0,0001), und auch die Ansprechraten waren hier mit 74% vs. 45% signifikant höher (p < 0,0001). Da zwei Drittel der Patienten zum Zeitpunkt der Auswertung noch am Leben waren, ist beim Gesamtüberleben noch kein Unterschied nachweisbar, zumal 109 der 171 Patienten der Chemotherapie-Gruppe bereits zu Crizotinib gewechselt waren.
Nach Ansicht von Tony Mok, Hongkong, wird mit diesen Daten Crizotinib als neuer Standard in der Erstlinientherapie des fortgeschrittenen ALK-positiven Nicht-Plattenepithelkarzinoms der Lunge etabliert. Bemerkenswert war, dass die Hazard Ratio für das PFS von Crizotinib gegenüber der Erstlinien-Kombinationstherapie niedriger war als in der Zweitlinientherapie-Studie gegen eine Mono-Chemotherapie (Docetaxel oder Pemetrexed), was für die hohe Effektivität von Crizotinib spricht. Diese Daten belegen zudem, dass Lungenkarzinome bereits vor Beginn der Erstlinientherapie nicht nur auf EGFR-Mutationen, sondern auch auf ALK-Inversionen getestet werden sollten.
Wenn Patienten mit ALK-positiven Tumoren gegen Crizotinib resistent werden, gibt es jetzt eine weitere Option: Der Zweitgeneration-ALK-Inhibitor LDK378 oder Ceritinib wurde im April dieses Jahres in den USA bereits für diese Indikation zugelassen, und zwar aufgrund der Daten der Phase-I-Studie ASCEND 1, die Dong-Wan Kim, Seoul, in Chicago vorstellte [14]: Ceritinib wirkt sowohl gegen Crizotinib-naive als auch gegen resistente Tumoren und wurde bei 246 Patienten mit ALK-positiven Tumoren (darunter auch neun Nicht-NSCLC-Tumoren) getestet, von denen zwei Drittel bereits einen ALK-Inhibitor erhalten hatten.
Die Ansprechrate lag bei 54,6% für die vorbehandelten und bei 66,3% für die ALK-Inhibitor-naiven Patienten, darunter zwei bzw. ein Patient mit kompletter Remission. Ob die Patienten bereits einen ALK-Inhibitor gesehen haben, wirkt sich vor allem auf die Dauer des Ansprechens aus: Bei den vorbehandelten Patienten waren nach einem Jahr noch 28,4% progressionsfrei am Leben, bei den naiven hingegen 61,3%. An Grad-3/4-Nebenwirkungen traten mit 6% am häufigsten gastrointestinale Toxizitäten auf.
Besonders interessant: Ceritinib scheint auch gegen Hirnfiliae wirksam zu sein: Bei den vorbehandelten Patienten sprachen 40% an, bei den ALK-Inhibitor-naiven sogar 75% – für median etwa sieben Monate. Somit zeichnet sich für Patienten mit ALK-positivem NSCLC ein Chemotherapie-freies Therapiemanagement für die Erst- und Zweitlinientherapie mit Crizotinib und Ceritinib ab.
Anti-EGFR-Antikörper bei Plattenepithelkarzinomen
Ein gutes Viertel aller nicht-kleinzelligen Lungenkarzinome (NSCLC) sind histologisch Plattenepithelkarzinome. Diese Patienten haben von der positiven therapeutischen Entwicklung beim NSCLC in den letzten Jahren weniger profitiert, weil diese sich vor allem auf die Adenokarzinome – und dort überwiegend auf diejenigen mit „druggable“ Mutationen wie solchen in EGF-Rezeptor, ALK und ROS1 – erstreckt hat. Der Anti-EGFR-Antikörper Cetuximab hat zwar, zusätzlich zu einer platinhaltigen Erstlinientherapie gegeben, deren Wirksamkeit signifikant verbessert, insbesondere bei den Plattenepithelkarzinomen [15, 16], aber er ist für das NSCLC nicht zugelassen.
Ein neuer, humaner monoklonaler Anti-EGFR-Antikörper, Necitumumab, wurde nun in der bisher größten Erstlinien-Studie zum metastasierten Plattenepithelkarzinom der Lunge, der Phase-III-Studie SQUIRE, bei 1.093 Patienten getestet [17]. Necitumumab, so Nick Thatcher, Manchester, wurde in Kombination mit der Standard-Chemotherapie aus Gemcitabin und Cisplatin gegeben, die Kontrollgruppe erhielt nur die Chemotherapie. Der Antikörper wurde an den Tagen 1 und 8 eines jeden der bis zu sechs Chemotherapie-Zyklen und danach bis zu einer Progression mit 800 mg verabreicht.
Primärer Endpunkt war das Gesamtüberleben, und dieses wurde durch Zugabe von Necitumumab von median 9,9 auf 11,5 Monate verlängert (Hazard Ratio 0,84; p = 0,012). Dieser Überlebensvorteil war für alle untersuchten Subgruppen mit Ausnahme der über 70-jährigen Patienten zu sehen. Beim progressionsfreien Überleben unterschieden sich zwar die Medianwerte nicht (5,7 vs. 5,5 Monate), aber im Log-rank-Test war die Differenz auch hier signifikant (HR 0,85; p = 0,020). Die Ansprechraten unterschieden sich zwischen den beiden Armen nicht.
Die Expression des EGF-Rezeptors wurde in den Tumorproben quantitativ ausgewertet, war aber nicht prädiktiv für die Wirksamkeit von Necitumumab. Grad-3/4-Nebenwirkungen, die unter Necitumumab häufiger auftraten als im Kontrollarm, waren eine Hypomagnesiämie (9,3% vs. 1,1%) und ein Hautausschlag (7,1% vs. 0,4%). Nach etwa zwei Jahrzehnten, so Thatcher, stellen diese Ergebnisse erstmals wieder einen wichtigen Fortschritt in der Behandlung des fortgeschrittenen Plattenepithelkarzinoms der Lunge dar. Auch diese Studie ist für den primären Endpunkt Überleben statistisch signifikant, allerdings liegt auch in dieser Studie die Hazard Ratio oberhalb der als klinisch relevant definierten Marke von 0,8.
Großes Interesse an Immuntherapien
Die Entwicklung von „Checkpoint“-Inhibitoren, die das Immunsystem zu Anti-Tumor-Reaktionen aktivieren, wird derzeit in der Onkologie mit großem Interesse verfolgt und vorangetrieben. Beispielsweise bindet das von Tumorzellen exprimierte Oberflächenprotein PD-L1 an den Rezeptor PD-1 („Programmed Death 1“) auf T-Lymphozyten und unterbindet dadurch deren Angriff auf die Krebszelle. Monoklonale Antikörper gegen PD-1 gehören zu den großen Hoffnungsträgern; ihre Entwicklung ist beim Einsatz gegen das maligne Melanom am weitesten fortgeschritten, aber auch bei anderen Entitäten wie beim NSCLC gibt es frühe, vielversprechende Ergebnisse.
Ein wesentlicher Vorteil der Immuntherapien gegenüber den zielgerichteten Substanzen wie Tyrosinkinaseinhibitoren ist, dass sich nicht so leicht wie dort durch Mutationen der Zielmoleküle Resistenzen ausbilden können. Beispielhaft sei vom diesjährigen ASCO-Kongress eine Phase-I-Dosisfindungsstudie angeführt, in der der Anti-PD-1-Antikörper Nivolumab in Kombination mit einer Platin-basierten Chemotherapie bei 56 nicht vorbehandelten Patienten mit fortgeschrittenem NSCLC eingesetzt wurde [18]. Ansprechraten zwischen 33% und 50% und 1-Jahres-Überlebensraten von bis zu 87% sind sehr vielversprechend und verlangen in jedem Fall weiterführende, insbesondere prospektiv randomisierte Studien, um das Potenzial dieser Substanz zu evaluieren.
SCLC „extensive disease“:
Prophylaktische Schädelbestrahlung bringt keinen Überlebensvorteil
Seit 15 Jahren wird bei Patienten mit limitiertem kleinzelligem Lungenkarzinom (SCLC, „limited disease“), die auf die Chemotherapie mit einer kompletten Remission angesprochen haben, eine prophylaktische Hirnbestrahlung gegeben, weil diese nachweislich das Risiko für Hirnmetastasen reduziert und das Überleben verlängert [19]. Für Patienten mit „extensive disease“, die auf die Chemotherapie angesprochen haben, hat eine Phase-III-Studie ähnliche Resultate gezeitigt [20], aber die Kritik an der Methodik dieser Studie ist seither nicht verstummt: Slotman et al. verwendeten keine obligate Platin-haltige Chemotherapie, die Strahlendosen waren variabel, und vor allem war bei Aufnahme der Patienten in die Studie nicht per Kernspintomografie überprüft worden, ob wirklich noch keine Hirnmetastasen vorgelegen hatten.
Die Autoren einer japanischen Phase-III-Studie, deren erste Analyse Takashi Seto, Fukuoka, in Chicago vorstellte, hatten daraus gelernt [21]: Die unbehandelten Patienten, die sich einer obligaten MRT zum Ausschluss von Hirnmetastasen unterziehen mussten, erhielten als Erstlinientherapie in jedem Fall eine Platin-Doublette. Wenn sie darauf angesprochen hatten, wurden sie randomisiert, entweder eine kranielle Bestrahlung mit 25 Gy in zehn Fraktionen zu erhalten oder nur beobachtet zu werden.
Die Studie sollte 330 Patienten einschließen, wurde aber nach den ersten 163 auswertbaren Patienten abgebrochen. Zwar hatten sich in der Bestrahlungsgruppe weniger Hirnmetastasen entwickelt (32 vs. 51, 12-Monats-Rate 32,4% vs. 58,0%), und beim progressionsfreien Überleben zeigte sich kein Unterschied (median 2,2 vs. 2,4 Monate), wohl aber beim Gesamtüberleben: Im Bestrahlungsarm waren 61, im Kontrollarm hingegen nur 50 Patienten verstorben, eine Differenz, die zwar nicht signifikant (Hazard Ratio 1,38; p = 0,091), aber mit median fünf Monaten (10,1 vs. 15,1 Monate) inakzeptabel hoch war. Der primäre Endpunkt einer Überlebensverlängerung war damit definitiv verfehlt worden. Eine Zunahme von Toxizitäten vom Grad ≥ 2 wurde im Bestrahlungsarm nicht beobachtet.
Die prophylaktische Ganzhirnbestrahlung verlängert beim SCLC mit „extensive disease“ und definitiv ausgeschlossener radiologisch nachweisbarer Hirnmetastasierung damit in der Studie nicht das Gesamtüberleben. Die Diskrepanz zur Studie von Slotman et al. ist eventuell damit zu erklären, dass dort ein Teil der Patienten bereits asymptomatische Hirnmetastasen gehabt hatte, die wegen fehlender MRT-Untersuchungen nicht nachgewiesen wurden und dass die Bestrahlung daher therapeutisch und nicht prophylaktisch erfolgt war.
Trotz einer nachweisbaren Reduktion des kraniellen Metastasierungsrisikos in der aktuellen Studie sollte die prophylaktische Hirnbestrahlung deshalb bei Patienten mit „extensive disease“ nicht mehr als Standard verstanden werden, insbesondere da Patienten in den westlichen Industrieländern in der Regel vor Einleitung der Strahlentherapie ein Schädel-MRT erhalten. Daher reflektiert die japanische Studie den Therapiemanagement-Standard eher als die Studie von Slotman, in der keine regelmäßigen MRT-Untersuchungen vorgesehen waren. Ein Kritikpunkt war, dass ein hoher Anteil der Patienten CPT11 als japanischen Therapiestandard in der Induktionstherapie erhalten hat. Inwieweit dies jedoch die Übertragbarkeit der Ergebnisse auf kaukasische Patienten limitiert, ist zweifelhaft.
Neben der PCI („prophylactic cranial irradiation“) wurde auch eine Studie zur PTI („prophylactic thoracic irradiation“) vorgestellt. Weil die meisten Patienten mit SCLC und „extensive disease“ nach der Chemotherapie noch intrathorakale Tumorreste aufweisen, randomisierten Ben Slotman, Amsterdam, und Kollegen, 498 solcher Patienten, die auf eine initiale Chemotherapie angesprochen hatten, 30 Gy in zehn Fraktionen auf den Thorax zu erhalten oder nur nachbeobachtet zu werden [22]; alle erhielten gemäß den älteren Daten aus der Slotman-Studie [20] eine intrakranielle Bestrahlung. Das progressionsfreie Überleben wurde durch die thorakale Radiotherapie signifikant verlängert (HR 0,73; p = 0,001). Die Kurven zum Gesamtüberleben, dem primären Endpunkt, liefen etwa neun Monate lang parallel, sodass die 1-Jahres-Überlebensraten sich nicht signifikant unterschieden (33% vs. 28%; HR 0,84; p = 0,066), aber danach gingen sie auseinander, sodass nach zwei Jahren ein signifikanter Vorteil für die Radiotherapie resultierte (13% vs. 3%; p = 0,004).
Die Analyse nach zwei Jahren war allerdings keine präspezifizierte Analyse, sodass aus diesen Daten keine Indikationsstellung für eine PTI abzuleiten ist. Dies wurde auch vom Diskutanten Walter Curran, Atlanta, herausgestellt, der Slotmans Interpretation seiner eigenen Daten, die PTI sei nun Standard, als nicht gerechtfertigt kritisierte. Die Indikation für eine vorgezogene Palliation durch thorakale Bestrahlung bei großem thorakalem Resttumor bleibt von den Studienergebnissen unberührt.
Literatur
1. Gandara DR et al. J Clin Oncol 2003; 21: 2004.
2. Hanna N et al. J Clin Oncol 2008; 26: 2755.
3. Huber RM et al. J Clin Oncol 2012; 30 (15S): 452s (ASCO 2012, Abstract #7000).
4. Park K et al. J Clin Oncol 2014; 32 (15S): 477s (ASCO 2014, Abstract #7500).
5. Perol M et al. J Clin Oncol 2014; 32 (15S): 507s (ASCO 2014, Abstract #LBA8006^).
6. Sequist LV et al. J Clin Oncol 2013; 31: 3327-34.
7. Wu YL et al. Lancet Oncol 2014; 15: 213-22.
8. Yang JCH et al. J Clin Oncol 2014; 32 (15S): 507s (ASCO 2014, Abstract #8004^).
9. Sequist LV et al. J Clin Oncol 2014; 32 (15S): 508s (ASCO 2014, Abstract #8010^).
10. Janne PA et al. J Clin Oncol 2014; 32 (15S): 508s (ASCO 2014, Abstract #8009^).
11. Herbst RS et al. Lancet 2011; 377: 1846-54.
12. Kato T et al. J Clin Oncol 2014; 32 (15S): 507s (ASCO 2014, Abstract #8005).
13. Mok T et al. J Clin Oncol 2014; 32 (15S): 506s (ASCO 2014, Abstract #8002).
14. Kim DW et al. J Clin Oncol 2014; 32 (15S): 506s (ASCO 2014, Abstract #8003^).
15. Pirker et al. Lancet 2009; 373: 1525-31.
16. Pujol et al. Lung Cancer 2014; 83: 211-8.
17.Thatcher N et al. J Clin Oncol 2014; 32 (15S): 508s (ASCO 2014, Abstract #8008^).
18. Antonia SJ et al. J Clin Oncol 2014; 32 (15S): 533s (ASCO 2014, Abstract #8113).
19. Aupérin A et al. N Engl J Med 1999; 341: 476-84.
20. Slotman B et al. N Engl J Med 2007; 357: 664-72.
21. Seto T et al. J Clin Oncol 2014; 32 (15S): 477s (ASCO 2014, Abstract #7503).
22. Slotman BJ et al. J Clin Oncol 2014; 32 (15S): 477s (ASCO 2014, Abstract #7502).

Prof. Dr. med. F. Griesinger
Direktor Klinik für Hämatologie und Onkologie
Universitätsklinik Innere Medizin-Onkologie
Koordinator Cancer Center Oldenburg
Pius-Hospital
Georgstr. 12
D-26121 Oldenburg

