ASCO-Update 2014 zu Hauttumoren
Die Dermatoonkologie, in der die Fortschritte in der Therapie bis dato eher bescheiden gewesen waren, hat in den letzten Jahren unversehens eine Vorreiterrolle in der Onkologie übernommen. Möglich wurde das durch die Einführung moderner Immuntherapien, zunächst in Form des CTLA-4-Antikörpers Ipilimumab [1]. Sie hat eine Entwicklung angestoßen, die erst am Anfang steht und die Onkologie verändern wird: Ähnlich wie CTLA-4, aber zu einem etwas späteren Zeitpunkt im Verlauf der Immunkaskade setzen weitere „Checkpoint“-Moleküle auf T-Lymphozyten – wie der „Programmed Death“-Rezeptor PD-1 – Krebszellen in die Lage, den Angriff des Immunsystems zu unterlaufen („immune escape“). „Checkpoint-Modifier“, die dieses Signal hemmen, führen bei einem Teil der Patienten zu einer sehr effektiven, gegen die Tumorzellen gerichteten Immunreaktion. Schon unter Ipilimumab kommt es zu vorher nicht beobachteten Fällen von Langzeitüberleben. Beim Kongress der American Society of Clinical Oncology (ASCO) Anfang Juni in Chicago vorgestellte Ergebnisse von Phase-I/II-Studien lassen vermuten, dass PD-1-Inhibitoren bei noch mehr Patienten das Potenzial zu einem verlängerten Überleben beim Melanom, aber auch bei anderen Tumoren haben.
Ein großer Reiz von Substanzen wie Ipilimumab und weiteren Checkpoint-Inhibitoren liegt darin, dass sie unabhängig vom Mutationsstatus wirken und daher auch bei Patienten mit nicht BRAF-mutierten Tumoren angewendet werden können. Andererseits ist bei Patienten, die einmal auf diese Inhibitoren angesprochen haben, nicht so leicht eine Resistenzentwicklung zu erwarten, wie man sie früher oder später bei Tyrosinkinaseinhibitoren und anderen zielgerichteten Medikamenten sieht. Die Induktion einer Immunantwort und damit das Ansprechen auf die Therapie mit Ipilimumab kann allerdings einige Zeit in Anspruch nehmen. Deshalb wird in der deutschen S3-Leitlinie zum Melanom [2] empfohlen, Patienten mit einer Lebenserwartung von mindestens drei bis sechs Monaten eine Immuntherapie so früh wie möglich anzubieten, damit sie alle vier Zyklen Ipilimumab erhalten können. Neuere Auswertungen des italienischen „Expanded Access“-Programms zeigen nämlich, dass ein Langzeitüberleben dann wahrscheinlicher ist (Abb. 1, [3].)
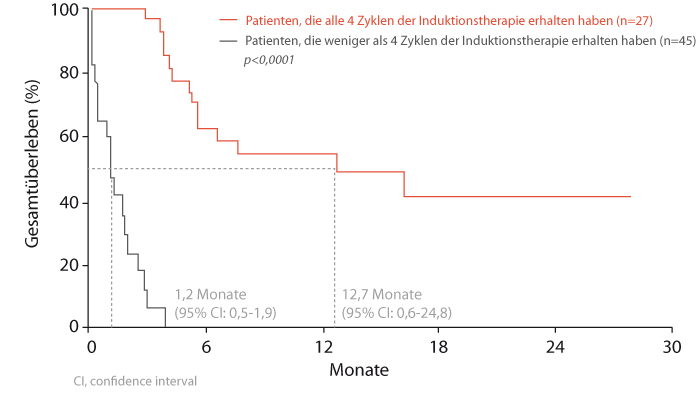
Ipilimumab adjuvant: PFS verlängert
Beim ASCO-Kongress wurde nun eine Vielzahl neuer Daten zur Immuntherapie des Melanoms präsentiert:
Aufgrund der Wirksamkeit beim fortgeschrittenen Melanom überprüfte die EORTC (European Organisation for Research and Treatment of Cancer) in einer placebokontrollierten Phase-III-Studie die adjuvante Behandlung mit Ipilimumab nach kompletter Resektion von Hochrisiko-Melanomen des Stadiums III. Wie Alexander Eggermont, Villejuif, berichtete [4], war Ipilimumab beim primären Endpunkt rezidivfreies Überleben mit einem Median von 26,1 vs. 17,1 Monaten dem Placebo hochsignifikant überlegen (Hazard Ratio 0,75; p = 0,0013); nach drei Jahren lag der absolute Unterschied in der Rezidivfreiheit mit 46,5% vs. 34,8% bei mehr als 10%. Ein möglicher Nutzen bezüglich des Gesamtüberlebens wird sich erst bei längerer Nachbeobachtung zeigen, aber auch dann wird unklar bleiben, ob Ipilimumab dem Interferon gleichwertig oder überlegen ist, einem bislang verwendeten Standard in der adjuvanten Situation, der in einigen Studien auch einen kleinen Nutzen hinsichtlich des Gesamtüberlebens gebracht hat. Darüber werden die Daten einer direkten Vergleichsstudie zwischen Ipilimumab und Interferon Auskunft geben, deren Rekrutierung mittlerweile beendet wurde.
Da Ipilimumab in dieser Studie in einer mehr als dreimal so hohen Dosierung verwendet wurde wie derzeit für metastasierte Patienten zugelassen, ist es nicht verwunderlich, dass die Toxizität nicht zu vernachlässigen war: Jeder zweite Patient musste die Behandlung unterbrechen, beispielsweise wegen endokriner Störungen, die teilweise mit hormoneller Substitution behandelt werden konnten, die aber oftmals irreversibel sind. Außerdem gab es fünf therapiebedingte Todesfälle. Die Studie hat zweifellos den Nachweis erbracht, dass die Immuntherapie auch adjuvant wirksam sein kann, aber um zu entscheiden, ob es sich hierbei tatsächlich um einen Fortschritt beim kurativ resezierten Hochrisiko-Melanom handelt, muss man abwarten, wie sie sich auf das Gesamtüberleben auswirkt.
Ipilimumab unter Alltagsbedingungen
Die Einschlusskriterien in Zulassungsstudien sind häufig ziemlich restriktiv, sodass unter Umständen wichtige Subgruppen von Patienten dort nicht abgebildet werden. Aus diesem Grund schloss die Arbeitsgemeinschaft Dermatologische Onkologie (ADO, englische Bezeichnung: Dermatologic Cooperative Oncology Group (DeCOG)) in insgesamt 25 Zentren Patienten mit Melanomen der Haut (n = 83), der Mukosa (n = 7), des Auges (n = 53) oder solche mit unbekanntem Primärtumor (n = 13) in eine Phase-II-Studie ein [5]. Die vorbehandelten Patienten mit Tumoren im Stadium III (nicht resezierbar) oder IV (Patienten mit Aderhaut-Melanomen durften auch unbehandelt sein) erhielten Ipilimumab in der zugelassenen Dosierung. Es fanden sich eine objektive Ansprechrate von 14% und in zusätzlich 22% der Fälle Krankheitsstabilisierungen, die Medianwerte für progressionsfreies und Gesamtüberleben lagen bei 2,6 bzw. 6,9 Monaten. Die einzelnen Melanom-Subgruppen unterschieden sich hierbei nicht, wohl aber wirkten sich andere Faktoren wie das Fehlen von Hirnmetastasen, niedrige LDH-Werte und hohe Lymphozyten-Zahlen im Gefolge der ersten beiden Ipilimumab-Dosen günstig auf das Überleben von Patienten mit kutanen und Aderhaut-Melanomen aus. Besonders wichtig schien auch hier die vollständige Gabe aller vier Dosen Ipilimumab zu sein: Bei Patienten mit kutanen Primärtumoren führte das zu 2- und 3-Jahres-Überlebensraten von 53% bzw. 31%, bei Patienten, die weniger als vier Dosen erhalten hatten, waren es nur 14% bzw. 9% (p < 0,0001).
Updates zu PD-1-Antikörpern
Während CTLA-4 die Interaktion zwischen T-Zelle und Antigen-präsentierenden dendritischen Zellen beeinflusst, hemmt der Immun-„Checkpoint“ PD-1 („Programmed Death-1“) zusätzlich die Wechselwirkung von T-Lymphozyten mit Tumorzellen. Der Rezeptor, der auf der Oberfläche der T-Zellen sitzt, wird durch Bindung des auf Tumorzellen exprimierten Liganden PD-L1 aktiviert und hindert daraufhin die Immunzelle daran, die Krebszelle zu attackieren. Derzeit sind mehrere Medikamente in der klinischen Entwicklung, die PD-1 oder PD-L1 hemmen und dadurch die T-Lymphozyten, die sich bereits im Tumorgewebe befinden, aktivieren können. Dieser Mechanismus, so die Hoffnung, könnte mindestens so aktiv wie die CTLA4-Inhibition dabei mithelfen, den Tumor komplett zu vernichten. Die ersten klinischen Daten haben eine Wirksamkeit dieser Antikörper bei bis zu der Hälfte der Patienten mit metastasiertem Melanom gezeigt, d. h. sie könnten die Wirkung von Ipilimumab noch übertreffen – bei möglicherweise weniger Toxizität. Außerdem scheint die Wirkung sich schneller einzustellen als diejenige des CTLA-4-Antikörpers. In Chicago gab es Updates zu zwei wichtigen Studien:
In einer Phase-I/II-Studie, die Antoni Ribas, Los Angeles, präsentierte [6], wurden insgesamt 411 Patienten mit metastasiertem Melanom mit verschiedenen Dosen des PD-1-Antikörpers MK-3475 behandelt. Dieser zeigt in Monotherapie sehr eindrucksvolle Ergebnisse: Bei Ipilimumab-naiven Patienten lag die Ansprechrate (nach den RECIST 1.1-Kriterien) bei 48% mit 8% kompletten Remissionen, bei mit Ipilimumab vorbehandelten Patienten waren es 30% bzw. 2%. Bei der Remissionsdauer ist der Medianwert noch nicht erreicht, sie reicht bisher von mehr als acht bis zu mehr als 76 Wochen. Das progressionsfreie Überleben ist für Ipilimumab-naive und -vorbehandelte Patienten identisch mit 5,6 bzw. 5,4 Monaten, die 1-Jahres-Überlebensrate liegt bei 69%. Das Toxizitätsprofil ist günstig mit Grad-3/4-Nebenwirkungen bei nur etwa 12% der Patienten, also erheblich weniger als unter Ipilimumab. Die beschriebene Wirksamkeit konnte für alle getesteten Dosierungen nachgewiesen werden, für weitere Studien werden 2 mg/kg alle drei Wochen empfohlen. Dass eine Vorbehandlung mit Ipilimumab das Langzeitergebnis nicht zu beeinflussen scheint, ist eine wichtige Information im Hinblick auf die Planung künftiger Therapiestrategien: Vermutlich wird man beide Ansätze entweder in Kombination oder sequenziell einsetzen können.
Die bislang längsten Nachbeobachtungsdaten zu PD-1-Inhibitoren gibt es für den PD-1-Antikörper Nivolumab, der in einer Phase-I-Dosisfindungsstudie bei verschiedenen Tumorentitäten (Melanom, nicht-kleinzelliges Lungenkarzinom, Prostata-, Nierenzell- und Kolorektalkarzinom) in Monotherapie beachtliche Ansprechraten erzielt hatte; bei den Melanomen waren es 28% [7]. Wie Stephen Hodi, Boston, in Chicago berichtete [8], lag die mediane Dauer des Ansprechens bei den 107 Patienten mit fortgeschrittenem, vorbehandeltem Melanom, die aber noch kein Ipilimumab erhalten hatten und den PD1-Antikörper alle zwei Wochen bis zu 96 Wochen lang bekamen, bei 22,9 Monaten. Von den Patienten, die angesprochen und die Therapie nicht progressionsbedingt vorzeitig beendet hatten, waren 52% danach noch für mindestens 24 Wochen in Remission. Die mediane Überlebenszeit lag bei 17,3 Monaten, nach einem, zwei und drei Jahren waren noch 63%, 48% bzw. 41% der Patienten am Leben. Bei 41 Patienten konnte im Tumorgewebe die Expression des PD-1-Liganden PD-L1 bestimmt werden. War er nachweisbar, so schnitten die betreffenden Patienten deutlich besser ab: Das mediane Gesamtüberleben ist bei ihnen noch nicht erreicht, während es bei den Patienten mit PD-L1-negativem Tumor bei 12,5 Monaten liegt; beim progressionsfreien Überleben sind es 9,1 vs. 1,9 Monate.
Kombination beider Immun-Prinzipien
Die PD1-Blockade ist mit Ansprechraten von rund 30% der nächste „große Knaller“ in der Therapie des Melanoms und anderer Tumoren, so Paul Chapman, New York, in einer „Hightlights-of-the-Day“-Sitzung am letzten Tag des Kongresses. Aufgrund unterschiedlicher Angriffspunkte in der immunologischen Reaktionskaskade lag es nahe, die Kombination von
PD-1- und CTLA-4-Antikörper in der Klinik zu untersuchen. Dies geschah in einer Phase-I-Studie mit 53 Patienten, deren vorläufige Ergebnisse bereits im vergangenen Jahr publiziert wurden [9]. Eine aktualisierte Auswertung präsentierte Mario Sznol, New Haven, in Chicago [10]: Die Kombination beider Antikörper, gleichzeitig gegeben, resultierte in einer bislang beim metastasierten Melanom noch nie beobachteten 2-Jahres-Überlebensrate von 79% über alle Dosierungen (mediane Überlebenszeit 40 Monate, d. h. mehr als drei Jahre, medianes progressionsfreies Überleben 27 Wochen). Die Ansprechrate lag bei 42% mit 17% Komplettremissionen. Bei sehr vielen Patienten, die auf die Therapie ansprachen, wurde das Tumorvolumen um mindestens 80% reduziert; die mediane Dauer des Ansprechens kann noch nicht berechnet werden: Bei 18 von 22 auswertbaren Patienten dauert es mittlerweile bis zu mehr als zwei Jahre an, bei vielen Patienten noch lange nach Absetzen der Therapie. BRAF-Mutationen im Tumor scheinen keinen Einfluss auf die Wirksamkeit der Kombination zu haben. Nicht beantworten kann man mit den bisher vorliegenden Daten die Frage, ob die Kombination von PD-1-Antikörper und Ipilimumab der alleinigen Gabe eines PD-1-Inhibitors überlegen ist. Dafür werden Phase-III-Studien mit einem direkten Vergleich beider Strategien erforderlich sein.
Diese Resultate bestätigen die
außerordentliche Wirksamkeit moderner Immuntherapien mit langfristigen Überlebenschancen für zumindest
einen Teil der Patienten mit fortgeschrittenem Melanom. Es gibt außerdem mittlerweile auch starke Hinweise, so Stephen Hodi bei einer Education
Session über Immuntherapien, dass sich mit immunonkologischen Therapieansätzen neben den klassischen immunogenen Malignomen wie Melanom und Nierenzellkarzinom auch andere Tumorentitäten wie z. B. das nicht-kleinzellige Lungenkarzinom erfolgreich behandeln lassen könnten.
Kombination aus BRAF- und MEK-Inhibitor
Melanome mit BRAF-V600-Mutationen sprechen auf BRAF-Inhibitoren wie Vemurafenib oder Dabrafenib mit schnellem Wirkeintritt und hohen Ansprechraten von über 50% auch bei hoher Tumorlast an. Allerdings entwickeln sich oftmals innerhalb von durchschnittlich sieben Monaten Resistenzen gegen diese Substanzen. Außerdem entstehen als paradoxe Nebenwirkung hyperproliferative Hautläsionen einschließlich nicht-melanozytärem Hautkrebs. Da die BRAF-Kinase in den RAS/RAF/MEK/ERK-Signaltransduktionsweg eingebunden ist, hofft man, diese Nachteile durch die Kombination der BRAF-Hemmer mit MEK-Inhibitoren in den Griff zu bekommen. In einer Phase-I/II-Studie verbesserte die Kombination aus Dabrafenib (150 mg zweimal täglich) und dem MEK-Inhibitor Trametinib in einer Dosierung von 2 mg/d gegenüber der Dabrafenib-Monotherapie Ansprechen, progressionsfreies Überleben und Hauttoxizität; besonders profitierten männliche Patienten und solche mit geringerer Tumorlast und normalen LDH-Werten [11]. In der Phase-III-Studie COMBI-d wurde die Kombination deshalb in diesen Dosierungen bei 423 Patienten mit BRAF-mutiertem Melanom der Stadien IIIC oder IV randomisiert und doppelblind mit Dabrafenib plus Placebo verglichen [12]. Wie Georgina Long, Sydney, berichtete, wurde durch die Kombination das progressionsfreie Überleben im Median signifikant von 8,8 auf 9,3 Monate verlängert (Hazard Ratio 0,75; p = 0,035). Auch bei den Ansprechraten war die Kombination mit 67% vs. 51% überlegen (p = 0,0015), ebenso beim Gesamtüberleben mit 40 vs. 55 Todesfällen (HR 0,63; p = 0,023). Nebenwirkungen waren in beiden Armen gleich häufig, allerdings waren im Kombinationsarm häufiger Dosismodifikationen notwendig. Hier litten mehr Patienten an Fieber (51% vs. 28%, vom Grad 3: 6% vs. 2%), dafür entwickelten weniger von ihnen hyperproliferative Hautläsionen (Plattenepithelkarzinome 2% vs. 9%, Hyperkeratosen 3% vs. 32%).
In dieser ersten doppelblinden Phase-III-Studie beim Melanom mit einem aktiven Kontrollarm konnte damit nachgewiesen werden, dass die Kombination von BRAF- und MEK-Inhibitor gegenüber der alleinigen Gabe eines BRAF-Inhibitors Ansprechen, progressionsfreies und Gesamtüberleben verbessert und überdies zu einer Verringerung der hyperproliferativen Hautreaktionen führt. Die COMBI-d-Studie wird fortgeführt, und eine erneute Analyse des Überlebens ist geplant, wenn 70% der Patienten verstorben sein werden.
Modifizierte Herpesviren verlängern Überleben
Immuntherapien können sehr verschiedene Gestalten annehmen: Eine davon, die derzeit ebenfalls intensiv beim Melanom, aber auch bei anderen soliden Tumoren klinisch erprobt wird, ist ein modifiziertes Typ-1-Herpes-simplex-Virus namens Talimogene
Laherparepvec (T-VEC). Es wird direkt in die Tumorläsion injiziert, repliziert dort selektiv und führt zur Lyse der Tumorzellen und zur Ausschüttung von Granulozyten/Makrophagen-Koloniestimulierendem Faktor (GM-CSF), der eine tumorspezifische systemische Immunreaktion verstärken soll. Nach vielversprechenden frühen klinischen Ergebnissen wurde T-VEC bei Patienten mit fortgeschrittenem, nicht resezierbarem Melanom in der Phase-III-Studie OPTiM im Verhältnis 2:1 randomisiert mit subkutan gegebenem GM-CSF verglichen. Eine Überlegenheit von T-VEC bezüglich des dauerhaften Ansprechens (16,3% vs. 2,1%) und der Zeit bis zum Therapieversagen (im Median 8,2 vs. 2,9 Monate) war bereits beim letztjährigen ASCO-Kongress berichtet worden [13]. Remissionen wurden sowohl in injizierten wie in nicht injizierten Läsionen gesehen. In diesem Jahr präsentierte Howard Kaufman, New Brunswick, die Überlebensresultate [14]: Mit einem Median von 23,3 vs. 18,9 Monaten war der Vorteil für T-VEC von grenzwertiger statistischer Signifikanz (HR 0,79; p = 0,051). Eine exploratorische Subgruppenanalyse ergab einen deutlichen und hochsignifikanten Vorteil der Vakzine bei Patienten mit geringerer viszeraler Metastasenlast (Stadium IIIB/C, IVM1a;
HR 0,57; p < 0,001) und bei solchen, die das Virus als Erstlinientherapie im metastasierten Stadium erhalten hatten (HR 0,50; p < 0,001). Die Verträglichkeit der Vakzine war gut, so Kaufman: Die einzige Nebenwirkung vom Grad 3/4, die bei mehr als 2% der Patienten auftrat, war eine Cellulitis.
Diese Ergebnisse sind vielversprechend: Die Wirkung ist tatsächlich systemisch, wie das Ansprechen von nicht behandelten Läsionen zeigt, und scheint vor allem bei frühem Einsatz und bei geringer viszeraler Krankheitsaktivität aufzutreten. Auch hier könnte die Einbindung in Kombinationstherapien sinnvoll sein, wie sie auch bereits getestet wird: Ebenfalls in Chicago vorgestellt wurden erste Ergebnisse
einer multizentrischen Phase-Ib-Studie, in der T-VEC bei Patienten mit bislang unbehandeltem Melanom der Stadien IIIB und IV mit Ipilimumab kombiniert wurde [15]. Bei bisher 18 auswertbaren Patienten wurden keine dosislimitierenden Toxizitäten beobachtet, so Igor Puzanov, Nashville, dafür eine eindrucksvolle Ansprechrate von 56% mit weiteren 16% Krankheitsstabilisierungen. Sechs Patienten, die sich in verschiedenen Krankheitsstadien befunden hatten (von IIIB bis IV M1b), erzielten eine komplette Remission (33%). Die Gabe von T-VEC war mit einem Anstieg von zytotoxischen CD8-T-Zellen verbunden, der sich nach Zugabe von Ipilimumab noch verstärkte und vor allem bei den Patienten ausgeprägt war, die auf die Behandlung ansprachen. Verglichen mit den Ergebnissen der beiden Therapien alleine sind diese Ansprechraten beachtlich; in einer zweiten, randomisierten Studienphase soll die Kombination nun mit der Ipilimumab-Monotherapie verglichen werden, so Puzanov.
Hedgehog-Inhibitor beim Basalzellkarzinom
Das Basalzellkarzinom ist der häufigste Tumor überhaupt, wird aber zum Glück nur selten so progredient, dass er eine wirkliche Bedrohung für den Patienten darstellt: Bei kaum viel mehr als jedem hundertsten Patienten findet sich ein lokal fortgeschrittenes Stadium, und weniger als ein halbes Prozent der Tumoren metastasieren. Für metastasierte und inoperable lokal fortgeschrittene Stadien gibt es seit Kurzem den Hedgehog-Inhibitor Vismodegib, der aufgrund der Daten der nicht-randomisierten Phase-II-Studie ERIVANCE zugelassen wurde [16]. In einem Update dieser Studie nach 30 Monaten Nachbeobachtung zeigte Aleksander Sekulic, Scottsdale, in Chicago Ansprechraten von 48,5% für Patienten mit metastasiertem und 60,3% für diejenigen mit lokal fortgeschrittenem Basalzellkarzinom [17]. Die mediane Dauer der Remissionen hatte sich seit der primären Analyse für die metastasierten Stadien von 12,9 auf 14,8 Monate und für die lokal fortgeschrittenen Erkrankungen von 7,6 auf 26,2 Monate verlängert. Das mediane progressionsfreie Überleben für die beiden Subgruppen lag bei 9,3 bzw. 12,9 Monaten, der Medianwert des Gesamtüberlebens betrug für die metastasierten Tumoren 33,4 Monate, für die lokal fortgeschrittenen war er noch nicht erreicht. Diese Resultate zeigen, so Sekulic, dass die Wirkung von Vismodegib auch nahezu drei Jahre nach Therapiebeginn anhält.
Literatur
1. Hodi FS et al. N Engl J Med 2010; 363: 711-23.
2. S3-Leitlinie „Diagnostik, Therapie und Nachsorge des Melanoms“. Version 1.1, Februar 2013, AWMF-Register-Nr: 032-024OL.
3. Ascierto PA et al. Cancer Invest 2014; 32: 144–9.
4. Eggermont A et al. J Clin Oncol 2014; 32 (15S) (ASCO 2014, Abstract #LBA9008).
5. Zimmer L et al. J Clin Oncol 2014; 32 (15S): 579s (ASCO 2014, Abstract #9031).
6. Ribas A et al. J Clin Oncol 2014; 32 (15S) (ASCO 2014, Abstract #LBA9000^).
7. Topalian SL et al. N Engl J Med 2012; 366: 2443-54.
8. Hodi FS et al. J Clin Oncol 2014; (32(15S): 571s (ASCO 2014, Abstract #9002).
9. Wolchok JD et al. N Engl J Med 2013; 369: 122-33.
10. Sznol M et al. J Clin Oncol 2014; 32 (15S) (ASCO 2014, Abstract #LBA9003^).
11. Flaherty K et al. J Clin Oncol 2014; 32 (15S): 574s (ASCO 2014, Abstract #9010^).
12. Long GV et al. J Clin Oncol 2014; 32 (15S): 574s (ASCO 2014, Abstract #9011^).
13. Andtbacka RHI et al. J Clin Oncol 2013; 31 (15S): 550s (ASCO 2013, Abstract #LBA9008).
14. Kaufman HL et al. J Clin Oncol 2014; 32 (15S): 573s (ASCO 2014, Abstract #9008a).
15. Puzanov I et al. J Clin Oncol 2014; 32 (15S): 578s (ASCO 2014, Abstract #9029).
16. Sekulic A et al. N Engl J Med 2012; 366: 2171-9.
17.Sekuklic A et al. J Clin Oncol 2014; 32 (15S): 574s (ASCO 2014, Abstract #9013).

Prof. Dr. med. Carola Berking
Klinik und Poliklinik für
Dermatologie und Allergologie
Klinikum der Universität München (LMU)
Frauenlobstr. 9-11/
Thalkirchner Str. 48
80337 München

