Systemtherapie bei molekularen Subgruppen des nicht-kleinzelligen Lungenkarzinoms
Bei etwa 80-85% der Lungentumoren handelt es sich um nicht-kleinzellige Lungenkarzinome (NSCLC), die restlichen sind kleinzellige Formen (SCLC). Die NSCLC lassen sich weiterhin in verschiedene histologische Subtypen differenzieren. Die häufigsten sind mit etwa 46% Adenokarzinome, gefolgt von Plattenepithelkarzinomen mit ungefähr 25% und den großzelligen Karzinomen (ca. 3,5%). Die verbleibenden etwa 25% lassen sich nicht zuordnen und gelten als „nicht näher bezeichnet“ (NOS, [1, 2]). In einer deutschen Untersuchung lag der Anteil der Adenokarzinome bei mehr als 3.000 Patienten mit fortgeschrittenem NSCLC bei 66,2% und der der Plattenepithelkarzinome bei 21,4% [3].
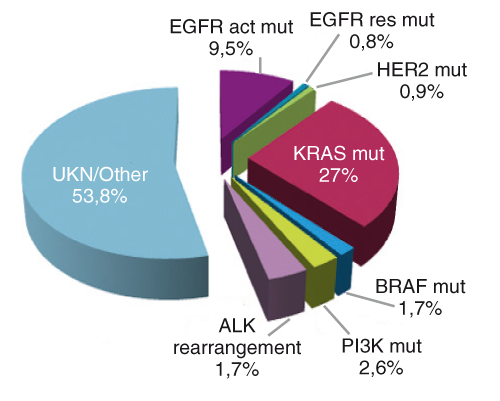
In den letzten Jahren hat sich herausgestellt, dass sich Lungenkarzinome genetisch unterscheiden. Dadurch haben sich völlig neue Therapiemöglichkeiten ergeben. So lassen sich in etwa der Hälfte der Adenokarzinome Treiber-(Driver-)Mutationen, die potenziell für die maligne Transformation (unreguliertes Tumorwachstum, Inhibition der Apoptose etc.) wichtig sind, nachweisen. Die größte Studie an weißen Patienten wurde durch das französische INCa (Institute National du Cancer) durchgeführt. Hier wurden 10.000 konsekutive Patienten mit NSCLC untersucht. Bei 46,2% der Patienten konnte eine potenzielle Treibermutation identifiziert werden, hiervon 9,5% eine EGFR Mutation, 27% eine KRAS-Mutation, 3,7% ein ALK Rearrangement (Abb. 1, [4]). Diese Daten entsprechen in etwa den Daten des Lung Cancer Consortiums [5].
In einer deutschen Studie konnte bei 310 von 3.155 eingeschlossenen Patienten (9,8%) mit vorwiegend fortgeschrittenem NSCLC eine EGFR-Mutation nachgewiesen werden, und zwar sowohl bei Nie-Rauchern als auch bei Ex-Rauchern [3]. Diese Ergebnisse zeigen, dass eine Mutationstestung unabhängig von Rauchstatus und Geschlecht bei Nicht-Plattenepithelkarzinomen sinnvoll ist. Darüber hinaus sollten Patienten mit Plattenepithelkarzinom, die nie (unter 100 Zigaretten lebenslang) oder nur leicht geraucht haben (unter 10 Pack-years und mehr als 15 Jahre Rauchstopp) auf molekulare Marker untersucht werden.
Aktuelle Therapieoptionen beim metastasierten NSCLC
In den letzten Jahren hat sich die Prognose in bestimmten Patientengruppen mit nicht-kleinzelligem Lungenkarzinom deutlich verbessert. Das betrifft vor allem Patienten mit aktivierenden Mutationen im Rezeptor für epidermalen Wachstumsfaktor (EGFR), für die in der Erstlinientherapie drei TKI zur Verfügung stehen: Afatinib (Giotrif® [6,7]), Erlotinib (Tarceva® [8]) und Gefitinib (Iressa® [9,10]). Liegt eine Inversion/Translokation von ALK vor, führt eine Therapie mit Crizotinib (Xalkori®) gegenüber einer Chemotherapie zu einer Verbesserung des progressionsfreien Überlebens (PFS), des Ansprechens sowie der Lebensqualität in der Zweitlinientherapie [11,12]. Schließlich steht für ROS1-Rearrangements eine Therapie mit Crizotinib (Xalkori®) zur Verfügung [13]. Um Patienten einer molekular stratifizierten Therapie zuzuführen, ist eine molekulare Testung vor Einleitung einer Therapie notwendig. Hierbei sollten alle Nicht-Plattenepithelkarzinome unabhängig vom Raucherstatus des Patienten und alle Plattenepithelkarzinome, bei denen die betroffenen Patienten nie oder nur leicht geraucht haben, auf Mutationen von EGFR, ALK und ROS1 getestet werden. Nur so können Patienten einer optimalen Therapie mit dem Ziel der guten Verträglichkeit, der Erhaltung oder Verbesserung der Lebensqualität sowie der Verbesserung des PFS und des Ansprechens zugeführt werden. Zusätzlich konnte in zwei Untersuchungen gezeigt werden, dass das Überleben der Patienten mit einer molekularen Veränderung durch eine molekular stratifizierte Therapie verbessert wird ([14, 15). Daher muss zur Identifizierung der Patienten, die eines dieser modernen Therapeutika erhalten sollen, die Testung auf molekulare Marker vor Beginn der Therapie erfolgen. Die Mutations-Testung wird daher unter anderem in der Leitlinie des National Comprehensive Cancer Network (NCCN) zum NSCLC empfohlen [16], sowie durch die ESMO [17] und durch die deutschen Empfehlungen [18].
TKI-Einsatz bei Nachweis aktivierender Mutationen
Mit der Einführung von TKI wurde ein wichtiger Fortschritt in der Behandlung von NSCLC-Patienten erreicht, weil die Chemotherapie ein gewisses Plateau erreicht hatte und mit einer TKI-Therapie bei Patienten mit EGFR-Mutationen eine bessere Wirksamkeit bei guter Verträglichkeit erzielt werden kann. TKI können bei Patienten mit fortgeschrittenem, metastasiertem Adenokarzinom der Lunge zur Anwendung kommen, wenn eine aktivierende EGFR-Mutation festgestellt wird. Diese Substanzen blockieren die Rezeptor-Tyrosinkinase des EGFR, der zu den Rezeptoren der ErbB-Familie gehört. Die Entdeckung weiterer Rezeptor-Tyrosinkinasen dieser Familie wie der Rezeptoren HER2 (ErbB2), ErbB3 und ErbB4 als potenzielle Targets ermöglichte nochmals eine Verbesserung der Wirksamkeit der TKI. Die ErbB-Familie ist eines der am häufigsten fehlregulierten Systeme in der Signaltransduktion maligner Tumoren.
Im EGFR können sogenannte aktivierende Mutationen vorliegen, wodurch sich die Konformation des EGFR-Proteins verändert. Hier sind vor allem Deletionen im Exon 19 und die Punktmutation L858R im Exon 21 zu nennen, mit etwa 90% die häufigsten aktivierenden Mutationen im EGFR [19]. Deutlich seltener kommen Mutationen in den Exons 18 und 20 vor. TKI binden mit erhöhter Affinität an den mutierten EGFR, sodass derartige genetisch bedingte Veränderungen als positiver prädiktiver Faktor für die Wirksamkeit der TKI gelten.
Wirksamkeit von Gefitinib
Gefitinib ist das erste zugelassene Medikament in der Erstlinientherapie von NSCLC-Patienten mit einer aktivierenden EGFR-Mutation. Zur Zulassung führten die Effektivitätsdaten der IPASS-Studie (IRESSA Pan ASia Study). An dieser Phase-III-Studie nahmen zuvor unbehandelte ostasiatische Patienten mit einem Adenokarzinom der Lunge teil, die Nie-Raucher waren oder nur leicht geraucht hatten. Davon erhielten 609 den TKI Gefitinib und 608 eine kombinierte Chemotherapie aus Carboplatin und Paclitaxel. Primärer Endpunkt war das progressionsfreie Überleben (PFS, [9, 20]).
Ausschlaggebend für die Zulassung war eine retrospektive Analyse, stratifiziert nach dem EGFR-Mutationsstatus. In der Subgruppe der Patienten mit einer aktivierenden Mutation im EGFR (n=261) fiel das progressionsfreie Überleben unter der TKI-Therapie gegenüber der Chemotherapie ebenfalls signifikant besser aus (Hazard Ratio 0,48; p < 0,001; Abb. 2).
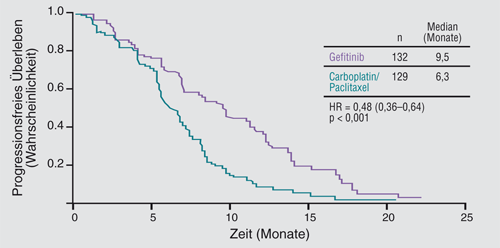
Lagen dagegen keine aktivierenden EGFR-Mutationen vor, war das progressionsfreie Überleben in der Chemotherapie-Gruppe deutlich länger als in der Gefitinib-Gruppe (HR 2,85; 95%-Konfidenzintervall 2,05–3,98; p < 0,001). Auch die objektiven Ansprechraten waren bei den Mutations-positiven Patienten unter Gefitinib deutlich höher (71,2% versus 47,3%).
Dabei kam es unter Gefitinib zu weniger Grad-3/4-Nebenwirkungen nach den Common Toxicity Criteria (CTC) des National Cancer Institute (NCI) als unter Carboplatin/Paclitaxel (28,7% versus 61%). Ebenso brachen weniger Patienten in der Gefitinib-Gruppe die Behandlung aufgrund von Nebenwirkungen ab (6,9% versus 13,6%). Darüber hinaus waren unter dem TKI seltener Dosismodifikationen notwendig als unter der Chemotherapie (bei 16,1% der Patienten für Gefitinib, bei 35,2% für Carboplatin und bei 37,5% für Paclitaxel). Schwerwiegende unerwünschte Wirkungen einschließlich Todesfällen kamen in beiden Gruppen etwa gleich häufig vor (16,3% versus 15,6%). Die häufigsten Nebenwirkungen unter Gefitinib waren Hautausschlag oder Akne, Diarrhö sowie Erhöhungen von Transaminasen, unter der Chemotherapie dagegen neurotoxische Effekte, Übelkeit und Erbrechen.
Die IPASS-Studie zeigte zudem, dass die Patienten unter Gefitinib auch in Bezug auf die Lebensqualität profitieren konnten. So wiesen deutlich mehr Patienten mit TKI-Therapie eine klinisch relevante Verbesserung der Lebensqualität auf als Patienten mit einer Chemotherapie, wie Auswertungen des Fragebogens Functional Assessment of Cancer Therapy-Lung (FACT-L; Odds Ratio 1,34; p = 0,01) und des Trial Outcome Index (TOI; OR 1,78; p < 0,001) belegten. Die mithilfe der Lung Cancer Subscales (LCS) ermittelte Besserung der Symptome war in beiden Gruppen etwa vergleichbar (OR 1,13; p = 0,30).
Die NEJ002-Studie (North East Japan, [10]) bestätigte die Ergebnisse der IPASS-Studie prospektiv. Sie schloss 224 Patienten mit Adenokarzinom und positivem EGFR-Mutationsstatus ein, die zuvor noch keine Chemotherapie erhalten hatten. Hier betrug das mediane progressionsfreie Überleben in einer Interimsanalyse unter Gefitinib 10,4 Monate und unter der Kombinationschemotherapie aus Carboplatin und Paclitaxel 5,5 Monate (HR 0,36; p < 0,001), ein Unterschied, der sich in der finalen Analyse bestätigte: 10,8 versus 5,4 Monate (HR 0,30; p < 0,001). Daneben war auch die objektive Ansprechrate mit 73,7% unter der TKI-Therapie signifikant höher als unter der Chemotherapie mit 30,7% (p < 0,001). Das Gesamtüberleben differierte dagegen nicht signifikant zwischen beiden Studienarmen: 30,5 versus 23,6 Monate (p = 0,31). Nebenwirkungen vom CTC-Grad 3 und höher traten in der Chemotherapie-Gruppe deutlich häufiger auf als in der Gefitinib-Gruppe (71,7% versus 41,2%, p < 0,001). Die häufigsten Nebenwirkungen unter dem TKI waren Hautausschlag und erhöhte Transaminasen, unter Chemotherapie Appetitverlust, Granulozytopenie, Anämie und sensible Neuropathie [10].
Sehr wahrscheinlich ist das vergleichbare bzw. nicht signifikant unterschiedliche Gesamtüberleben in beiden Studien auf hohe Crossover-Raten (64% bzw. 95% von Chemotherapie auf TKI) zurückzuführen. Außerdem zeichnet sich in der NEJ002-Studie ein Trend zu einem verlängerten Gesamtüberleben unter Gefitinib ab [10].
Erlotinib bei NSCLC mit positivem EGFR-Mutationsstatus
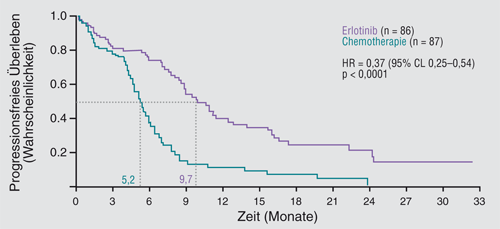
Die erste TKI Studie, die ausschließlich an weißen Patienten durchgeführt wurde, war die Phase-III-Studie EURTAC (EURopean TArceva versus Chemotherapy) mit dem TKI Erlotinib. Die Studienpopulation setzte sich aus 173 NSCLC-Patienten mit aktivierenden EGFR-Mutationen zusammen, davon erhielten 86 Erlotinib und 87 eine Standardchemotherapie aus Cisplatin plus Docetaxel oder Gemcitabin; bei Kontraindikationen für Cisplatin konnte Carboplatin plus Docetaxel oder Gemcitabin eingesetzt werden. Das mediane progressionsfreie Überleben betrug in der Erlotinib-Gruppe 9,7 Monate und in der Chemotherapie-Gruppe 5,2 Monate (HR 0,37; p < 0,0001; Abb. 4). Die häufigsten Grad-3/4-Nebenwirkungen waren in der Erlotinib-Gruppe Hautausschlag und erhöhte Transaminasen-Spiegel und in der Chemotherapie-Gruppe Granulozytopenie und Anämie [8].
Die vorgestellten Studiendaten zu Erlotinib und Gefitinib zeigen deutlich, dass Patienten mit metastasiertem NSCLC und aktivierenden EGFR-Mutationen von einer TKI-Therapie profitieren können. Beide Substanzen erreichen eine vergleichbare Effektivität. Das bezieht sich sowohl auf ein längeres medianes progressionsfreies Überleben und höhere Ansprechraten als auch auf eine bessere Symptomkontrolle und eine bessere Lebensqualität als mit einer Chemotherapie. Daher erscheint der Einsatz von TKI als Erstlinientherapie bei Patienten mit metastasiertem NSCLC und positivem EGFR-Mutationsstatus gerechtfertigt und empfehlenswert, auch wenn formal bisher in den Studien, vermutlich u. a. wegen einer hohen Crossover-Rate ein Überlebensvorteil nicht gezeigt wurde.
Neuer ErbB-Family-Blocker Afatinib
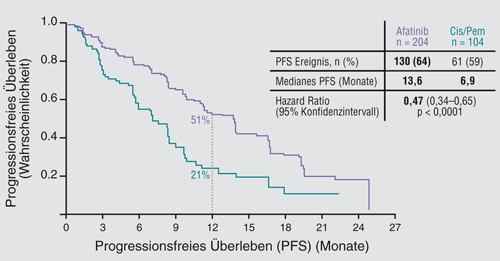
Da sich TKI als wirksame Therapieoption in der klinischen Praxis etabliert haben, stellt die Verbesserung ihres Wirkprinzips eine weitere Herausforderung für die klinische Forschung dar. Eine neue Substanz, die unter diesem Aspekt entwickelt wurde, ist Afatinib. Dabei handelt es sich um einen ErbB-Family-Blocker, der im Gegensatz zu Gefitinib und Erlotinib alle vier Rezeptor-Tyrosinkinasen der Familie inhibiert und sie im Gegensatz zu Gefitinib und Erlotinib außerdem irreversibel bindet. In der Phase-III-Studie LUX-Lung 3 ließ sich die bessere Wirksamkeit des ErbB-Family-Blockers gegenüber einer Chemotherapie mit Cisplatin und Pemetrexed belegen [6, 7].
In dieser internationalen Studie erhielten 230 Patienten mit fortgeschrittenem Adenokarzinom der Lunge und aktivierenden EGFR-Mutationen Afatinib und 115 Cisplatin/Pemetrexed. Dabei profitierten besonders die Patienten mit den häufigen EGFR-Mutationen (Deletion im Exon 19 und Punktmutation L858R im Exon 21) von der Afatinib-Therapie. Ihr medianes progressionsfreies Überleben fiel unter Afatinib mit 13,6 Monaten signifikant länger aus als unter der Chemotherapie mit 6,9 Monaten (HR 0,47; p < 0,0001), so das Ergebnis einer unabhängigen Analyse (Abb. 5). Auch für die gesamte Studienpopulation inklusive der Patienten mit seltenen Mutationen von Exon 18 und 20 war das mediane progressionsfreie Überleben unter dem ErbB-Family-Blocker deutlich besser als unter der Chemotherapie (11,1 versus 6,9 Monate; HR 0,58; p = 0,0004). Darüber hinaus kam es unter Afatinib zu signifikant höheren objektiven Ansprechraten als unter Chemotherapie: 60,8% versus 22,1% (p < 0,001) für die Patienten mit den häufigen Mutationen sowie 56,1% versus 22,6% (p < 0,001) für die Gesamtpopulation. Zudem verschlechterten sich mit Lungenkrebs assoziierte Symptome wie Husten und Dyspnoe in der Afatinib-Gruppe signifikant später als in der Chemotherapie-Gruppe. Auch die Lebensqualität war unter dem ErbB-Family-Blocker deutlich besser als in der Chemotherapie-Gruppe. Häufige Grad-3-Nebenwirkungen waren Diarrhö, Hautausschlag/Akne, Stomatitis/Mukositis und Paronychie [6, 7]. Diese Studie ist die größte Studie, die bei Patienten mit EGFR-mutierten Tumoren im Vergleich zu einer Chemotherapie durchgeführt wurde. Insbesondere die eindrucksvollen Lebensqualitäts-Analysen mit einem hohen Rücklauf (über 85%) zeigen den Stellenwert des TKI gegenüber einer Chemotherapie deutlich an.
ALK+ NSCLC
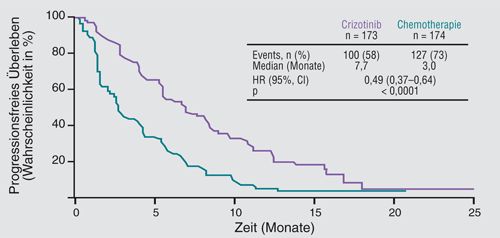
NSCLC mit ALK-Rearrangements weisen je nach untersuchtem Patientenkollektiv eine Häufigkeit von etwa 3–7% auf. Der häufigste Translokationspartner von ALK ist EML4, eine interchromosomale Inversion führt zum Entstehen des Fusionsgens und -proteins. Weitere Fusionspartner sind bei ALK-Translokationen beschrieben, die alle zu einer konstitutiven, nicht regulierten Expression von ALK und damit zur malignen Transformation führen. Crizotinib wurde ursprünglich als MET-Inhibitor entwickelt, hat aber zudem eine hohe Affinität zu ALK (und zu ROS1) und ist ein potenter ALK-Inhibitor. In einer erweiterten Phase-I/II-Studie zeigte Crizotinib bei Patienten mit ALK+ NSCLC mit einer objektiven Ansprechrate von 61% und einer „disease control rate“ von 82,5% hohe Effektivität. Diese Daten führten in den USA zu einer Zulassung von Crizotinib bei ALK+ NSCLC [11]. Eine weitere Phase-III-Studie wurde in der Zweitlinientherapie des ALK+ NSCLC durchgeführt. ALK+ Patienten wurden nach einer Erstlinientherapie randomisiert zwischen Crizotinib und Chemotherapie (Docetaxel oder Pemetrexed). Diese Studie zeigte einen signifikanten Vorteil hinsichtlich Ansprechen (65% vs. 19,5%), PFS (7,7 vs. 3,0 Monate) sowie Lebensqualität und „patient-reported outcomes“. Das Überleben der Gesamtpopulation lag bei 20 und 22 Monaten, mit einer hohen Crossover-Rate vom Chemotherapie-Arm auf Crizotinib [12]. Üblicherweise liegt das mediane Überleben in der Zweitlinientherapie mit herkömmlichen Therapien bei acht Monaten [21]. Diese Daten zeigen eindrucksvoll die Effektivität von Crizotinib bei ALK+ Patienten und haben zur Zulassung von Crizotinib in der Zweitlinientherapie durch die EMA geführt.
ROS1+ NSCLC
Als dritte therapeutische Ziel-Alteration bei NSCLC ist derzeit ROS1 zu nennen. Diese Veränderung tritt bei etwa 1,5% aller Patienten mit NSCLC auf, vorwiegend bei Nie- oder Leicht-Rauchern und bei Adenokarzinomen, aber auch Plattenepithelkarzinome können sie tragen. Bisher liegen nur Phase-II-Daten von etwa 30 Patienten vor, die eine hohe Ansprechrate und ein langes PFS aufweisen. In Deutschland wird der Einsatz von Crizotinib bei ROS1+ NSCLC durch die Krankenkassen unterstützt [22-25].
Resistenzentwicklung
Zwar sprechen geeignete Patienten mit den entsprechenden molekularen Alterationen schnell auf die molekular stratifizierten Therapien an, doch kommt es nach einer gewissen Zeit zur Entwicklung von Therapieresistenzen. Bei Patienten mit EGFR-Mutationen, die eine Resistenz unter Afatinib, Erlotinib oder Gefitinib entwickeln, sind die Resistenzmechanismen bereits relativ gut aufgeklärt: Etwa 50-60% der Patienten akquirieren eine T790M-Mutation im EGFR-Gen [26]. Diese sogenannten Gatekeeper-Mutationen, wie sie in ähnlicher Weise bei der CML im BCR-ABL- und bei GIST-Tumoren im KIT-Gen vorkommen, führen zu einer sterischen Veränderung der ATP-Bindungsdomäne und verhindern die Bindung von Erlotinib und Gefitinib. Lediglich Afatinib hat eine mäßige Affinität zu der T790M-mutierten Kinase, die zu einer partiellen Remissionsrate von etwa 10-15% bei T790M-mutiertem NSCLC führt [27]. Derzeit befinden sich neue Drittgenerations-TKI in der Erprobung, die gezielt die T790M-Mutation angreifen und keine Inhibition des Wildtyp-EGFR aufweisen.
Das Resistenzmuster bei ALK+ Tumoren ist heterogener. Hier sind einerseits ALK+-abhängige Alterationen wie Gatekeeper-Mutationen und ALK-Amplifikationen beschrieben worden. Zusätzlich können aber auch andere Signaltransduktionswege angeschaltet werden, z. B. durch eine akquirierte KRAS-Mutation oder aber auch eine akquirierte EGFR-Mutation [28]. Auch bei ALK+ Tumoren mit Crizotinib-Resistenz werden derzeit Zweitgenerations-TKI entwickelt, die eine hohe Remissionsrate aufweisen [29].
Klare Therapiealgorithmen sind bei TKI-resistenten Patienten mit Lungenkarzinom noch nicht entwickelt worden. Es besteht die Empfehlung, bei einer Resistenz, ähnlich wie beim Mammakarzinom, eine Re-Biopsie vorzunehmen. In einigen Fällen liegt einer „Resistenz“-Entwicklung eine Umdifferenzierung zu einem kleinzelligen Lungenkarzinom zugrunde, in anderen Fällen das Auftreten eines Zweittumors. Nur über die Bestimmung des Resistenzmechanismus ist eine molekulare Therapie mit zielgerichteten Medikamenten, z. B. T790M-spezifischen Agenzien möglich.
Weitere molekulare Targets
MET, RET, FGFR1: Möglicher neuer Therapiealgorithmus
Bei NSCLC befinden sich weitere molekulare Targets im Fokus der klinischen Forschung. So konnte gezeigt werden, dass etwa 15% der quadrupel-negativen (d. h. KRAS-, EGFR-, ALK- und ROS-negativen) Patienten, die nicht oder nur leicht geraucht haben, eine RET-Translokation aufweisen, die gegebenenfalls mit RET-Inhibitoren angreifbar ist [30]. Ein weiteres Gen, MET, spielt sowohl bei der Resistenzentwicklung als auch als Onkogen eine Rolle. MET kann sowohl durch MET-Antikörper [31] als auch durch niedermolekulare Medikamente (TKI) inhibiert werden. Die Daten einer großen prospektiven Phase-III-Studie in der Zweitlinientherapie bei immunhistochemisch MET-positiven Patienten werden im Jahre 2014 erwartet.
Bei etwa 20% der Patienten mit Plattenepithelkarzinom liegt eine Amplifikation des Gens für den Typ-1-Rezeptor des Fibroblasten-Wachstumsfaktors (FGFR1) vor [32]. Derzeit befinden sich FGFR1-Inhibitoren in der klinischen Erprobung, u. a. eine „First-in-man“-Phase-I-Studie in Deutschland bei FGFR1-amplifizierten Patienten.
Fazit
Die Therapie des NSCLC ist deutlich komplexer geworden, das NSCLC ist wie die CML oder der GIST-Tumor zu einer molekularen Erkrankung geworden. Angesichts des deutlichen klinischen Nutzens für NSCLC-Patienten mit Mutationen in EGFR und ALK durch eine Therapie mit einem TKI sowie Crizotinib spielt die Mutations-Testung eine zentrale Rolle. Nur so kann der Patient die für ihn optimale Therapie erhalten. Liegen keine Mutationen vor, ist die platinbasierte Chemotherapie der Therapiestandard.
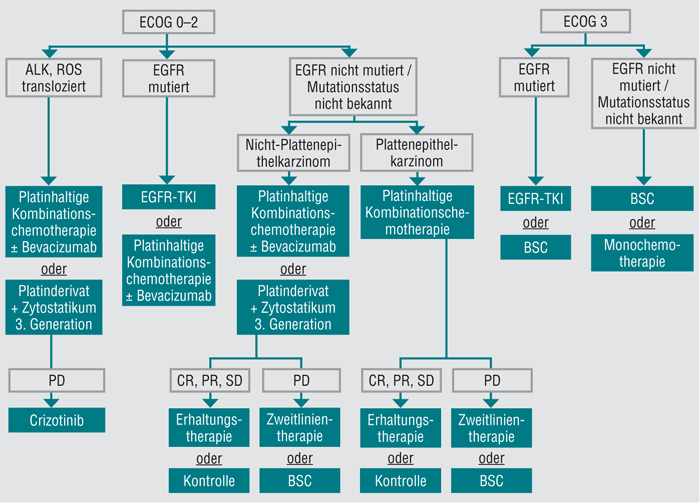
Ein künftiger Therapiealgorithmus könnte auf Basis der derzeit verfügbaren Daten wie folgt aussehen (Abb. 6): Nach histologischer Sicherung eines NSCLC wird der Mutationsstatus bei allen Patienten mit Nicht-Plattenepithelkarzinom unabhängig vom Raucherstatus und Geschlecht überprüft. Gelingt der Nachweis einer aktivierenden Mutation im EGFR, sind TKI wie Erlotinib, Gefitinib sowie der ErbB-Family-Blocker Afatinib die Erstlinientherapie der Wahl. Lässt sich dagegen eine ALK-Mutation feststellen, sollte eine Crizotinib-Therapie zumindest in der Zweitlinie durchgeführt werden. Liegt eine NSCLC mit EGFR-Wildtyp vor, stehen bei Patienten mit einem ECOG-Performance-Status 0 oder 1 entweder eine platinbasierte Chemotherapie oder eine Platin-Doublette mit Bevacizumab zur Verfügung.
Literatur
. Ferlay J et al. Estimates of worldwide burden of cancer in 2008. GLOBOCAN 2008. Int J Cancer 2010; 127: 2893–917.
2. Surveillance Epidemiology and End Results. URL: http://seer.cancer.gov/csr/1975_2009_pops09/results_merged/sect_15_lung_bronchus.pdf (Zugriff am 24.08.2012)
3. Schütte W et al. REASON: A registry for the epidemiologic and scientific evaluation of EGFR mutation status in newly diagnosed NSCLC patientes stage IIIB/IV in Germany. WCLC 2011, Abstract #O46.
4. Barlesi F et al. Biomarkers France: Preliminary results of routine EGFR, HER2, KRAS, BRAF, PI3KCA mutations detection and EML4-ALK gene fusion assessment on the first 10,000 non-small cell lung cancer (NSCLC) patients. J Clin Oncol 2013; 31 (suppl 15S): 486s (ASCO 2013, Abstract #8000).
5. Kris MG et al. Identification of driver mutations in tumor specimens from 1,000 patients with lung adenocarcinoma: The NCI’s Lung Cancer Mutation Consortium (LCMC). J Clin Oncol 2011; 29 (suppl 18S): 787s (ASCO 2011, Abstract #CRA7506).
6. Sequist LV et al. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013; 31: 3327-34.
7. Yang JC et al. Symptom Control and Quality of Life in LUX-Lung 3: A phase III study of afatinib or cisplatin/pemetrexed in patients with advanced lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013; 31: 3342-50.
8. Rosell R et al. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): A multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2012; 13: 239-46.
9. Mok TS et al. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009; 361: 947-57.
10. Maemondo M et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med 2010; 362: 2380-8.
11. Camidge DR et al. Activity and safety of crizotinib in patients with ALK-positive non-small-cell lung cancer: Updated results from a phase 1 study. Lancet Oncol 2012; 13: 1011-9.
12. Shaw AT et al. Effect of crizotinib on overall survival in patients with advanced non-small-cell lung cancer harbouring ALK gene rearrangement: A retrospective analysis. Lancet Oncol 2011; 12: 1004-12.
13. Ou S-HI et al. Efficacy and safety of crizotinib in patients with advanced ROS1-rearranged non-small cell lung cancer (NSCLC). J Clin Oncol 2013; 31 (suppl 15S): 494s (ASCO 2013, Abstract #8032).
14. Johnson BE et al. A multicenter effort to identify driver mutations and employ targeted therapy in patients with lung adenocarcinomas: The Lung Cancer Mutation Consortium (LCMC). J Clin Oncol 2013; 31 (suppl 15S): 490s (ASCO 2013, Abstract #8019).
15. The Clinical Lung Cancer Genome Project (CLCGP) and Network Genomic Medicine (NGM). A genomics-based classification of human lung tumors. Sci Transl Med 2013; 5: 209ra153.
16. NCCN-Guideline: Non-small cell lung cancer. Version 2.2012.
17. Peters S et al. Metastatic non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012; 23 (Suppl. 7): vii56–vii64.
18. Griesinger F et al. Onkopedia 2012 (http://www.dgho-onkopedia.de/de/onkopedia/leitlinien/lungenkarzinom-nicht-kleinzellig-nsclc).
19. Sharma SV et al. Epidermal growth factor receptor mutations in lung cancer. Nat Rev Cancer 2007; 7: 169-81.
20. Fukuoka M et al. Biomarker analyses and final overall survival results from a phase III, randomized, open-label, first-line study of gefitinib versus carboplatin-paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia (IPASS). J Clin Oncol 2011; 29: 2866-74.
21. Hanna N et al. Randomized phase III trial of pemetrexed versus docetaxel in patients with non–small-cell lung cancer previously treated with chemotherapy. J Clin Oncol 2004; 22: 1589-97.
22. Davies KD et al. Identifying and targeting ROS1 gene fusions in non–small-cell lung cancer. Clin Cancer Res 2012; 18: 4570-9.
23. Bergethon K et al. ROS1 rearrangements define a unique molecular class of lung cancers. J Clin Oncol 2012; 30: 863-70.
24. Shaw AT et al. Clinical activity of crizotinib in advanced non-small cell lung cancer (NSCLC) harboring ROS1 gene rearrangement. J Clin Oncol 2012; 30 (suppl 15S); 482s (ASCO 2012, Abstract #7508).
25. Ou SH et al. Efficacy and safety of crizotinib in patients with advanced ROS1-rearranged non-small cell lung cancer (NSCLC). J Clin Oncol 2013; 31 (suppl 15S): 494s (ASCO 2013, Abstract #8032).
26. Sequist L et al. Genotypic and histological evolution of lung cancers acquiring resistance to EGFR inhibitors. Sci Transl Med 2011; 3: 75ra26.
27. Griesinger F et al. Acquired resistance in NSCLC with EGFR mutation treated with TKI’s: Single center experience and treatment outcome. WCLC 2013, Abstract #P2.06-035
28. Doebele RC et al. Mechanisms of resistance to crizotinib in patients with ALK gene rearranged non-small cell lung cancer. Clin Cancer Res 2012; 18: 1472-82.
29. Shaw A et al. Clinical activity of the ALK inhibitor LDK378 in advanced, ALK-positive NSCLC. J Clin Oncol 2013; 31 (suppl 15S): 488s (ASCO 2013, Abstract #8010).
30. Kohne T et al. KIF5B-RET fusions in lung adenocarcinoma. Nat Med 2012, 18: 375-7.
31. Spigel DR et al. Randomized phase II trial of onartuzumab in combination with erlotinib in patients with advanced non-small cell lung cancer. J Clin Oncol 2013; 31: 4105-14.
32. Weiss J et al. Frequent and focal FGFR1 amplification associates with therapeutically tractable FGFR1 dependency in squamous cell lung cancer. Sci Transl Med 2010: 2: 62ra93.

Prof. Dr. med. Frank Griesinger
Klinik für Hämatologie und
Onkologie, Pius-Hospital
Georgstraße 12, 26121 Oldenburg
Tel.: 0441/229 16 10
frank.griesinger[at]pius-hospital[dot]de

