Strahlentherapie beim nicht-kleinzelligen Lungenkarzinom
Überblick
Neben der Chirurgie und der medikamentösen Therapie stellt die Strahlentherapie einen essenziellen Bestandteil der Behandlung des nicht-kleinzelligen Lungenkarzinoms sowohl in kurativen wie in palliativen Therapiesituationen dar. Wie bei den anderen Therapiemodalitäten haben sich dabei auch in der Strahlentherapie in den letzten Jahren erhebliche Entwicklungsfortschritte ergeben, die auch Einfluss auf die Therapieindikation genommen haben, d. h. in welcher Situation die Strahlentherapie zum Einsatz kommt. Aus diesem Grunde werden zunächst die Weiterentwicklungen in der Strahlentherapie sowie die damit im Zusammenhang stehenden Begriffe dargestellt.
Entwicklung der strahlentherapeutischen Techniken
Seit mehreren Jahrzehnten gilt die dreidimensionale Bestrahlungsplanung als Standard in der Strahlentherapie. Hierbei wird die Patientin bzw. der Patient in der späteren Bestrahlungsposition zumeist unter Verwendung spezieller Lagerungshilfen am CT gelagert und es wird dann ein sogenanntes Planungs-CT angefertigt. Diese CT-Schichten werden nachfolgend in einen Planungscomputer eingelesen und das System rekonstruiert hieraus ein dreidimensionales Dichteprofil der Patientin bzw. des Patienten, welches als Grundlage für die Bestrahlungsplanung dient. Nachfolgend werden in den einzelnen CT-Schichten die bei der Planung zu berücksichtigenden Risikoorgane eingezeichnet, also diejenigen Organe, deren Bestrahlungsdosis bestimmte Grenzen nicht überschreiten sollte. Bei Lungenkarzinomen gehören hierzu in der Regel die Lungenflügel rechts und links, die Gesamtlunge, das Herz, das Rückenmark und der Ösophagus. Um dann das Zielgebiet der Strahlentherapie, das sogenannte Zielvolumen (ZV), festzulegen und zu konturieren, d. h. einzuzeichnen, werden alle diagnostischen Befunde inklusive Bronchoskopie und diagnostische Bildgebung zurate gezogen. Im Falle eines kurativen Therapieansatzes bei nicht metastasierter Erkrankung werden hierbei sowohl der Primärtumor wie auch alle befallenen Lymphknoten berücksichtigt.
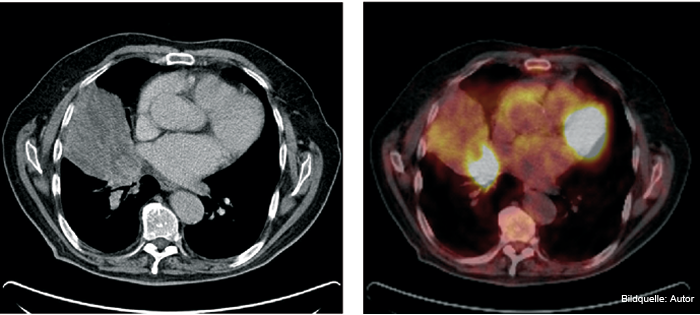
Lange Zeit galt die Mitbestrahlung auch von Lymphknotenstationen mit einem hohen Befallsrisiko, aber ohne Anhalt für einen tatsächlichen Befall (elektives Lymphabflussgebiet) als Standard. Hierdurch wurde jedoch vielfach das ZV sehr groß, was die Applikation hoher Strahlendosen zur Vernichtung des makroskopischen Tumors aufgrund der damit verbundenen Belastung von Risikoorganen deutlich erschwerte bzw. unmöglich machte. Durch die modernen bildgebenden Verfahren wie das PET-CT (Abb. 1), bei dem neben der anatomischen Information auch die Stoffwechselaktivitäten von Tumormanifestationen dargestellt werden, ist jedoch die Ungewissheit in Bezug auf die Tumorausbreitung geringer geworden, sodass vielfach versucht wird, das ZV auf den makrokopischen Tumor und befallene Lymphknoten sowie ggf. direkt benachbarte Lymphknotenstationen zu begrenzen. Inwieweit also auf eine elektive Mitbestrahlung nicht befallener Lymphknoten verzichtet werden kann, ohne das Therapieergebnis negativ zu beeinflussen, ist auch Gegenstand laufender Studien. Um eine möglichst genaue Berücksichtigung der Informationen des PET-CT zu erreichen, wird dieses vielfach mit dem Planungs-CT grafisch überlagert (Matching) oder das PET-CT wird gleich als Planungs-CT durchgeführt.
Sind das ZV und die entsprechenden Risikoorgane eingezeichnet, wird von den Medizinphysikern ein Bestrahlungsplan erstellt, der die Tumormanifestationen mit der verordneten Dosis erfasst und die Risikoorgane möglichst schont. Dafür wird aus verschiedenen Richtungen eingestrahlt, mit einer Überschneidung der Felder im ZV, sodass sich hier die eingestrahlten Dosen addieren. Zusätzlich werden die quadratischen Bestrahlungsfelder aus den einzelnen Richtungen mittels einer Abschirmung aus strahlenundurchlässigem Material auf das eigentliche ZV eingeschränkt (konformale Bestrahlung). Erfolgte diese Ausblockung früher mit individuell gegossenen Bleiblöcken, die von den MTRAs vor der Bestrahlung aus der jeweiligen Richtung per Hand in den Strahlengang eingeschoben werden mussten, so bedient man sich hierzu heute sogenannter Multilamellenkollimatoren (Multi Leaf Collimator = MLC). Diese zumeist aus Wolfram bestehenden MLCs weisen bis zu 160 einzelne Lamellen mit einer Breite von jeweils 1,0–0,3 cm auf (Abb. 2) und werden so programmiert, dass sie während der Bestrahlung jeweils computergesteuert die gewünschte Ausblendung vornehmen.

Wurden früher zum Ausgleich der individuellen Körperformen – und damit Gewebsdicken – in die Strahlengänge sogenannte Kompensatoren oder auch Keile eingebracht, so kann dies heute ebenfalls durch die MLCs verwirklicht werden, indem diese nacheinander unterschiedliche Formen annehmen (Feld-in-Feld-Technik) und somit bestimmte Feldbereiche eine zusätzliche Dosisaufsättigung erhalten im Sinne einer einfachen Form der Intensitätsmodulation. Der eigentliche Begriff der in den letzten Jahren etablierten Technik der Intensitäts-modulierten Strahlentherapie (Intensity-Modulated Radiation Therapy = IMRT) setzt zusätzlich eine sogenannte „inverse“ Bestrahlungsplanung voraus: Wird bei den bisher üblichen Bestrahlungsplänen berechnet, zu welcher Dosisverteilung eine bestimme Feldkonfiguration führt, so wird bei der inversen Bestrahlungsplanung eine gewünschte Dosisverteilung und maximal tolerierbare Belastung von Risikoorganen vorgegeben (dose constraints) und der Planungsrechner bestimmt, welche Bestrahlungsrichtungen und Teilfelder (Segmente) hierfür mit welcher Dauer bestrahlt werden müssen. Die maximale Anzahl an Bestrahlungsrichtungen und Segmente kann hierbei ebenfalls vorgegeben werden.
Bei den neuesten dynamischen Bestrahlungstechniken wie der „Volumetric Modulated Arc Therapy“ (VMAT) der Firma Elekta bzw. „Rapid Arc“ der Firma Varian werden sowohl der Schwenkarm des Bestrahlungsgerätes, der die Bestrahlungsrichtung vorgibt, wie auch die MLCs und gegebenenfalls auch die Blendendrehung und die Dosisleistung während der Bestrahlung kontinuierlich modifiziert, um hierdurch eine noch exaktere Intensitätsmodulation und damit gleichförmigere Dosisverteilung im ZV zu erzielen, bei noch besserer Schonung von Risikoorganen. Diese komplexen Bestrahlungstechniken setzen aufwendige individuelle dosimetrische Kontrollen durch die Medizinische Physik vor jeder Bestrahlung voraus.
Neben diesen Weiterentwicklungen im Bereich der Bestrahlungstechnik sind auch die Möglichkeiten der Lagerungs- und ZV-Kontrolle in den letzten Jahren im Sinne einer bildgeführten Strahlentherapie (Image-guided Radiation Therapy= IGRT) deutlich verbessert worden. Erfolgte in früheren Jahren die Lagerungskontrolle zumeist mit Feldkontrollaufnahmen unter Verwendung der therapeutischen Strahlung und gegebenenfalls zusätzlichem Matching mit den digitalen Rekonstruktionen aus dem Bestrahlungsplan, so besteht bei den neusten Linearbeschleunigern zumeist die Möglichkeit sogenannter Cone-Beam-CTs (CB-CT), d. h. CTs direkt in der aktuellen Lagerungsposition vor der Bestrahlung entweder mittels der therapeutischen Strahlung (Megavoltage CB-CT) oder mit einer zusätzlich angebrachten KV-Röhre (Kilovoltage CB-CT) anzufertigen, wobei letztere aufgrund der niedrigeren Energie zumeist eine bessere Bildgebung liefert (Abb. 3). Diese CTs werden dann unter ärztlicher Kontrolle automatisch mit dem Planungs-CT überlagert und gegebenenfalls eine notwendige Tischverschiebung zur exakten Übereinstimmung der aktuellen Lagerung mit der Lagerung im Planungs-CT berechnet und nach ärztlicher Freigabe automatisch auf den Bestrahlungstisch übertragen.
Zusätzlich gibt es Möglichkeiten, auch die Organbeweglichkeit und damit auch die Bewegung der Tumorregion insbesondere durch die Atmung zu berücksichtigen. Hat man hierbei bisher entweder ein Planungs-CT unter normaler Atmung oder in maximaler In- und Exspiration durchgeführt, um bei der Planung den Sicherheitssaum um die Tumorregion so groß zu wählen, dass diese in jeder Atemphase auch tatsächlich vollständig erfasst wird, so werden heutzutage vielfach sogenannte „4D-CTs“ zur Bestrahlungsplanung verwendet. Hierbei wird parallel zum CT auch die Atemphase aufgezeichnet und anschließend jeder Atemphase ein CT-Satz zugeordnet. Dadurch ist es möglich, die tatsächliche Bewegung des ZV zu berücksichtigen und den Sicherheitssaum klein zu halten oder die Bestrahlung nur in einer bestimmten Atemphase, d. h. atemkontrolliert (sogenanntes „Gating“) durchzuführen und somit den Sicherheitssaum noch weiter zu verkleinern. Für diese Atemkontrolle werden verschiedenste Systeme angeboten, die von einer Aufzeichnung der Atmung mittels Atemmaske und manueller Unterbrechung der Bestrahlung außerhalb der entsprechenden Atemphase bis zu einer automatischen Überwachung der Thoraxbewegung und entsprechender Steuerung der Bestrahlung gehen. Die Verkleinerung des Sicherheitssaumes ermöglicht höhere Enddosen im Bereich der Tumormanifestationen und gegebenenfalls höhere Einzeldosen. Kombiniert man dieses Verfahren noch mit einer Verbesserung der Lagerung, z. B. durch individuell angefertigte Vakuummatratzen, d. h. Lagerungshilfen, die mithilfe eines Vakuums exakt der Körperform angepasst werden, so sind dies die Voraussetzungen für eine „stereotaktische“ Bestrahlung des Tumors. Hierbei werden wenige Bestrahlungen, d. h. Fraktionen mit hohen Einzeldosen und entsprechend erhöhter biologischer Wirksamkeit, über multiple Einstrahlrichtungen eingestrahlt. Z. T. werden hierbei auch non-koplanare Felder verwendet, d. h. Felder, deren Einstrahlrichtungen nicht alle auf einer Ebene liegen.
Strahlenpneumonitis
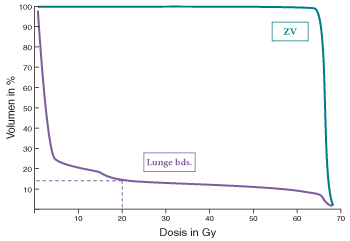
Ein wesentlicher Parameter bei der Bewertung von Bestrahlungsplänen zur Behandlung von Lungenkarzinomen ist der Anteil beider Lungen, der mehr als 20 Gy erhält, d. h. die sogenannte V20 (Abb. 4). Bei kaum beeinträchtigter Lungenfunktion sollte diese nicht über 30–35% liegen, sonst steigt das Risiko einer sogenannten „Pneumonitis“, d. h. einer Strahlentherapie-bedingten Entzündungsreaktion, die auch erst Wochen nach Abschluss einer Radiatio auftreten kann [1]. Eine Pneumonitis geht zumeist mit Dyspnoe und trockenem Husten einher, kann auch mit Fieber kombiniert sein und wird zumeist über typische radiologische Veränderungen diagnostiziert. Unbehandelt kann sich eine Pneumonitis über die ursprünglichen Bestrahlungsfelder hinaus ausbreiten und zu einer tödlichen Komplikation werden. Die Behandlung besteht üblicherweise aus einer Steroidmedikation und ggf. einer zusätzlichen Antibiose bei Verdacht auf Superinfektion. Neben der V20 kann auch die mediane Lungendosis beider Lungen zur Beurteilung der Lungenbelastung hinzugezogen werden, diese sollte im Allgemeinen 20 Gy nicht überschreiten.
Kurative Therapie beim nicht-kleinzelligen Lungenkarzinom
Im Folgenden sollen die Indikationen zur Bestrahlung in den verschiedenen Situationen betrachtet werden. Die Therapieentscheidungen sollten möglichst immer interdisziplinär und am besten im Rahmen interdisziplinärer Tumorkonferenzen erfolgen. Dies ist auch eine zentrale Zertifizierungsanforderung der Deutschen Krebsgesellschaft (DKG) und daher in DKG-zertifizierten Zentren sichergestellt.
Stadium I-II
Im Stadium I-II ist üblicherweise ein operatives Vorgehen die Therapie der Wahl, die Strahlentherapie beschränkte sich in der Vergangenheit auf medizinisch oder funktionell inoperable Patientinnen und Patienten. Mit konventioneller Fraktionierung, also Aufteilung der Gesamtdosis auf wochentägliche Dosen um 2 Gy und Gesamtdosen bis zu über 80 Gy können jedoch heutzutage lokale Kontrollraten von 50–80% erreicht werden [2]. In den letzten Jahren zeigen die Ergebnisse verschiedenster Arbeitsgruppen insbesondere im Stadium I, d. h. bei Tumoren bis 5 cm Größe und ohne Lymphknoten- und Fernmetastasen (Klassifikation cT1a-2a cN0 M0) mittels stereotaktischer Strahlentherapie ähnlich gute Therapieergebnisse wie mit der Operation [3, 4]. Die in diesen Publikationen berichtete lokoregionale Kontrolle lag nach drei Jahren bei 87,2% bzw. 89%, das Gesamtüberleben bei 55,8% bzw. 47%. Bei Bewertung dieser Ergebnisse muss zusätzlich berücksichtigt werden, dass nur Patienten eingeschlossen wurden, die aufgrund einer stark eingeschränkten Lungenfunktion oder sonstiger Begleiterkrankungen inoperabel waren. Diese Resultate sind insbesondere auch deshalb überraschend, da die Operation weiterhin die systematische mediastinale Lymphadenektomie beinhaltet, bei der stereotaktischen Strahlentherapie die Lymphabflusswege dagegen nicht mitbehandelt werden.
Abhängig von der Lokalisation des Tumors werden verschiedene Fraktionierungen, d. h. Aufteilungen der Gesamtdosis auf verschiedene Einzeldosen, empfohlen, üblicherweise zwischen 3 x 20 Gy bis 5 x 12 Gy für periphere Lokalisationen und z. B. 8 x 7,5 Gy für zentrale, Hilus-nahe Lokalisationen. Die Gesamtdosen sollten einer biologischen Äquivalenzdosis von mindestens 100 Gy, bezogen auf eine konventionelle Fraktionierung mit 2 Gy Einzeldosis, entsprechen. Die Umrechnung der verschiedenen Einzel- und Gesamtdosen auf biologische Äquivalenzdosen erfolgt dabei mittels des sogenannten „Linear-quadratischen Gesetzes“, welches die biologischen Eigenschaften von verschiedenen Tumorarten und auch von Normalgewebe berücksichtigt.
Aufgrund der guten Therapieergebnisse mittels stereotaktischer Strahlentherapie war in den Niederlanden eine randomisierte Studie (ROSEL) zum Vergleich Operation versus stereotaktische Strahlentherapie initiiert worden, die aber wegen unzureichender Rekrutierung leider geschlossen werden musste.
Kommt aus verschiedenen Gründen oder aufgrund von Lymphknotenbefall im Stadium I-II eine stereotaktische Strahlentherapie nicht infrage, so sollte eine konventionell fraktionierte Strahlentherapie mit 2 Gy Einzeldosen bis zu einer Gesamtdosis von üblicherweise 60–70 Gy unter Berücksichtigung der Lungenfunktion erfolgen. Der Nutzen einer parallelen Chemotherapie ist in dieser Situation nicht gesichert.
Eine postoperative Strahlentherapie ist nur nach inkompletter Tumorresektion indiziert.
Ist im Stadium I-II aufgrund verschiedenster Faktoren eine kurative Therapie nicht mehr möglich, so sollte zumindest eine palliative Therapie mit 10–13 x 3 Gy oder auch 5 x 4 Gy zur Linderung von Symptomen wie Hämoptysen und/oder zur Wachstumsverzögerung erwogen werden.
Stadium IIIA/B
Im Stadium IIIA/B kann die Strahlentherapie bzw. die kombinierte Radiochemotherapie in unterschiedlichen Situationen eingesetzt werden. Lange Zeit hat man in diesen Stadien ein operatives Vorgehen von vornherein ausgeschlossen, und die definitive Radiatio bzw. die definitive Radiochemotherapie galt als Standardtherapie. Verschiedene Studien und auch eine Metaanalyse [5] haben dabei den zusätzlichen Gewinn durch zwei bis drei Zyklen einer parallelen Chemotherapie – üblicherweise Platin-basiert – gezeigt.
Für die Kombination mit neueren Substanzen wie Tyrosinkinaseinhibitoren oder monoklonalen Antikörpern liegen bisher noch keine ausreichenden Daten vor.
Die applizierte Gesamtdosis auf den Primärtumor und befallene Lymphknoten sollte dabei üblicherweise zwischen 60 und 70 Gy liegen, auch wenn vielfach davon ausgegangen wird, dass mit höheren Enddosen eine größere lokale Kontrolle und damit auch eine Verbesserung der Überlebensrate zu erreichen sein sollte. Die hierzu vor Kurzem veröffentlichten Ergebnisse einer Dosiseskalationsstudie bis 74 Gy haben allerdings zur großen Überraschung eine Verschlechterung des Überlebens mit der höheren Enddosis ergeben: Die 1-Jahres-Überlebensrate lag mit 60 Gy bei 81%, mit 74 Gy nur bei 70,4% [6]. Als Ursache wird vor allem eine erhöhte kardiale und pulmonale Toxizität im dosiseskalierten Arm angenommen.
Die mit einer kombinierten Radiochemotherapie im Stadium III erreichten 5-Jahres-Überlebensraten liegen zumeist unter 20%, sowohl wegen einer unzureichenden lokalen Kontrolle wie auch wegen des Auftretens einer Metastasierung. Eine alleinige Radiatio aufgrund von Kontraindikationen gegen eine Chemotherapie führt zu einer 5-Jahres-Überlebensrate von nur ca. 5%.

Immer mehr in den Fokus geraten auch im Stadium III multidisziplinäre Therapieansätze, insbesondere auch unter Berücksichtigung einer genaueren Klassifikation eines mediastinalen Lymphknotenbefalls im Sinne der Robinson-Klassifikation (Tab. 1), da gezeigt werden konnte, dass die Überlebensrate in der pN2-Situation auch abhängig ist von der Größe der befallenen Lymphknoten und der Anzahl der befallenen Level [7]. In den günstigen Situationen kann die Strahlentherapie sowohl prä- wie auch postoperativ zum Einsatz kommen. Durch eine neoadjuvante Radiochemotherapie können gegebenenfalls ein Downstaging und ein im pathologischen Präparat nachweisbares Ansprechen erreicht werden. Die Studien [8, 9] zeigen aber zumeist eine größere perioperative Mortalität insbesondere bei Notwendigkeit einer Pneumektomie (Tab. 2). Daher wird die Strahlentherapie vielfach erst postoperativ (Postoperative Radiation Therapy = PORT) eingesetzt.

Hatten frühere Auswertungen wie die PORT-Metanalyse [10] den Nutzen einer adjuvanten Strahlentherapie in der pN2-Situation noch infrage gestellt, so haben Subgruppenanalysen aus neueren adjuvanten Chemotherapie-Studien wie der ANITA-Studie [11] ebenso wie eine retrospektive SEER-Analyse doch eine Verbesserung des Gesamtüberlebens durch die postoperative Strahlentherapie ergeben [12]. Der Grund dürfte insbesondere in den moderneren strahlentherapeutischen Techniken liegen im Vergleich zu den Techniken in den älteren Untersuchungen. Üblicherweise wird die postoperative Strahlentherapie des mediastinalen Lymphabflussgebietes mit 1,8–2 Gy Einzeldosis bis ca. 50 Gy durchgeführt. Nach R1/R2-Resektion sollte eine kleinvolumige Aufsättigung der entsprechenden Region bis 60 oder 66 Gy erfolgen, der Nutzen einer parallelen Chemotherapie ist in dieser Situation nicht gesichert.
Pancoast-Tumor
Im Falle eines Tumors des Sulcus superior (sogenannter „Pancoast-Tumor“) mit Infiltration von Rippen, Wirbelkörpern, Plexus brachialis, Ganglion stellatum und/oder subklavikulären Gefäßen und entsprechender klinischer Symptomatik wie Schulterschmerzen und Horner-Syndrom (Ptosis, Miosis, Enophthalmus) stellt die präoperative Radiochemotherapie mit nachfolgender Operation weiterhin den Therapiestandard dar. In der zugrunde liegenden Studie der Southwest Oncology Group (SWOG) wurden bei Patienten mit T3-4 N0-1-Tumoren 45 Gy in 1,8 Gy Einzeldosis in Kombination mit zwei Zyklen Cisplatin und Etoposid [13] appliziert. Hierdurch konnte eine komplette Resektion in 76% der Fälle erreicht werden, 36% der Patienten hatten eine komplette pathologische Remission durch die Vorbehandlung. Die 5-Jahresüberlebensrate lag bei 44%.
Ist die nachfolgende Operation nur im Sinne einer R1- bzw. R2-Resektion durchgeführt worden, so kann gegebenenfalls eine weitere Dosisaufsättigung mit 10–15 Gy erfolgen. Bei Inoperabilität ist eine kombinierte Radiochemotherapie bis ca. 60 Gy indiziert, gegebenenfalls zur Verminderung des Risikos einer therapiebedingten Plexusschädigung auch hyperfraktioniert, d. h. mit mehr Fraktionen und kleineren Einzeldosen von 1,2 Gy bis 66–69,6 Gy.
Prophylaktische Hirnschädel-Bestrahlung
Sowohl beim kleinzelligen wie auch beim nicht-kleinzelligen Lungenkarzinom stellt die zerebrale Metastasierung nach kurativer Therapie eine der häufigsten Rezidiv-Manifestationen dar. Beim kleinzelligen Karzinom konnte gezeigt werden, dass durch eine prophylaktische Bestrahlung des Hirnschädels mit üblicherweise 30 Gy in 15 Fraktionen à 2 Gy eine Verbesserung des Überlebens sowohl bei begrenzter (Limited Disease) wie auch bei fortgeschrittener Erkrankung (Extensive Disease) erreicht werden kann [14, 15]. Anders beim nichtkleinzelligen Karzinom, denn auch wenn es hier ebenfalls vereinzelte Arbeiten mit dem Hinweis auf einen positiven Effekt einer prophylaktischen Hirnschädel-Bestrahlung nach kurativer Therapie gibt [16], ist diese aufgrund fehlender endgültiger Daten bisher nicht etabliert.
Palliative Therapie
Wie bei den meisten anderen Tumorerkrankungen spielt die Strahlentherapie auch in palliativer Situation beim nicht-kleinzelligen Lungenkarzinom vielfach eine wesentliche Rolle. Bei Hämoptysen oder lokaler Tumorprogression trotz Systemtherapie z. B. mit Vergrößerung mediastinaler Lymphknoten und hierdurch bedingter Recurrens-Parese kann die Strahlentherapie zur Symptomlinderung und/oder Wachstumsverzögerung eingesetzt werden. Die Fraktionierungen reichen hierbei von 25 x 2 Gy über 10 x 3 Gy bis zu 5 x 4 Gy. Die stark hypofraktionierten Schemata, d. h. die Schemata mit wenigen Fraktionen und hohen Einzeldosen, werden dabei vielfach im Ausland aufgrund logistischer Aspekte eingesetzt.
Weitere palliative Strahlentherapie-Indikationen bestehen bei ossären oder multiplen zerebralen Filiae. Diese können zumeist sehr effektiv mit 10 x 3 Gy behandelt werden. Bei singulären (einzelnen) oder sogar solitären (alleinigen) Hirnmetastasen sollten dabei auch neurochirurgische Möglichkeiten überprüft werden, ebenso aber auch die stereotaktische Bestrahlung mittels speziell ausgestatteter Linearbeschleuniger oder auch dem Gammaknife, d. h. einem Strahlentherapie-Gerät, bei dem bis zu über 200 Kobaltquellen so angeordnet sind, dass eine fokussierte Bestrahlung auch kleinster cerebraler Manifestationen möglich wird. Im Falle einer solitären Metastase kann sich nach neurochirurgischer oder stereotaktischer Therapie ggf. als kurativer Therapieversuch noch eine definitive Therapie des Primärtumors mittels Resektion oder Radiochemotherapie anschließen.
Wurden früher zum Ausgleich der individuellen Körperformen – und damit Gewebsdicken – in die Strahlengänge sogenannte Kompensatoren oder auch Keile eingebracht, so kann dies heute ebenfalls durch die MLCs verwirklicht werden, indem diese nacheinander unterschiedliche Formen annehmen (Feld-in-Feld-Technik) und somit bestimmte Feldbereiche eine zusätzliche Dosisaufsättigung erhalten im Sinne einer einfachen Form der Intensitätsmodulation. Der eigentliche Begriff der in den letzten Jahren etablierten Technik der Intensitäts-modulierten Strahlentherapie (Intensity-Modulated Radiation Therapy = IMRT) setzt zusätzlich eine sogenannte „inverse“ Bestrahlungsplanung voraus: Wird bei den bisher üblichen Bestrahlungsplänen berechnet, zu welcher Dosisverteilung eine bestimme Feldkonfiguration führt, so wird bei der inversen Bestrahlungsplanung eine gewünschte Dosisverteilung und maximal tolerierbare Belastung von Risikoorganen vorgegeben (dose constraints) und der Planungsrechner bestimmt, welche Bestrahlungsrichtungen und Teilfelder (Segmente) hierfür mit welcher Dauer bestrahlt werden müssen. Die maximale Anzahl an Bestrahlungsrichtungen und Segmente kann hierbei ebenfalls vorgegeben werden.
Bei den neuesten dynamischen Bestrahlungstechniken wie der „Volumetric Modulated Arc Therapy“ (VMAT) der Firma Elekta bzw. „Rapid Arc“ der Firma Varian werden sowohl der Schwenkarm des Bestrahlungsgerätes, der die Bestrahlungsrichtung vorgibt, wie auch die MLCs und gegebenenfalls auch die Blendendrehung und die Dosisleistung während der Bestrahlung kontinuierlich modifiziert, um hierdurch eine noch exaktere Intensitätsmodulation und damit gleichförmigere Dosisverteilung im ZV zu erzielen, bei noch besserer Schonung von Risikoorganen. Diese komplexen Bestrahlungstechniken setzen aufwendige individuelle dosimetrische Kontrollen durch die Medizinische Physik vor jeder Bestrahlung voraus.
Neben diesen Weiterentwicklungen im Bereich der Bestrahlungstechnik sind auch die Möglichkeiten der Lagerungs- und ZV-Kontrolle in den letzten Jahren im Sinne einer bildgeführten Strahlentherapie (Image-guided Radiation Therapy= IGRT) deutlich verbessert worden. Erfolgte in früheren Jahren die Lagerungskontrolle zumeist mit Feldkontrollaufnahmen unter Verwendung der therapeutischen Strahlung und gegebenenfalls zusätzlichem Matching mit den digitalen Rekonstruktionen aus dem Bestrahlungsplan, so besteht bei den neusten Linearbeschleunigern zumeist die Möglichkeit sogenannter Cone-Beam-CTs (CB-CT), d. h. CTs direkt in der aktuellen Lagerungsposition vor der Bestrahlung entweder mittels der therapeutischen Strahlung (Megavoltage CB-CT) oder mit einer zusätzlich angebrachten KV-Röhre (Kilovoltage CB-CT) anzufertigen, wobei letztere aufgrund der niedrigeren Energie zumeist eine bessere Bildgebung liefert (Abb. 3).
Diese CTs werden dann unter ärztlicher Kontrolle automatisch mit dem Planungs-CT überlagert und gegebenenfalls eine notwendige Tischverschiebung zur exakten Übereinstimmung der aktuellen Lagerung mit der Lagerung im Planungs-CT berechnet und nach ärztlicher Freigabe automatisch auf den Bestrahlungstisch übertragen. Zusätzlich gibt es Möglichkeiten, auch die Organbeweglichkeit und damit auch die Bewegung der Tumorregion insbesondere durch die Atmung zu berücksichtigen. Hat man hierbei bisher entweder ein Planungs-CT unter normaler Atmung oder in maximaler In- und Exspiration durchgeführt, um bei der Planung den Sicherheitssaum um die Tumorregion so groß zu wählen, dass diese in jeder Atemphase auch tatsächlich vollständig erfasst wird, so werden heutzutage vielfach sogenannte „4D-CTs“ zur Bestrahlungsplanung verwendet. Hierbei wird parallel zum CT auch die Atemphase aufgezeichnet und anschließend jeder Atemphase ein CT-Satz zugeordnet. Dadurch ist es möglich, die tatsächliche Bewegung des ZV zu berücksichtigen und den Sicherheitssaum klein zu halten oder die Bestrahlung nur in einer bestimmten Atemphase, d. h. atemkontrolliert (sogenanntes „Gating“) durchzuführen und somit den Sicherheitssaum noch weiter zu verkleinern. Für diese Atemkontrolle werden verschiedenste Systeme angeboten, die von einer Aufzeichnung der Atmung mittels Atemmaske und manueller Unterbrechung der Bestrahlung außerhalb der entsprechenden Atemphase bis zu einer automatischen Überwachung der Thoraxbewegung und entsprechender Steuerung der Bestrahlung gehen. Die Verkleinerung des Sicherheitssaumes ermöglicht höhere Enddosen im Bereich der Tumormanifestationen und gegebenenfalls höhere Einzeldosen. Kombiniert man dieses Verfahren noch mit einer Verbesserung der Lagerung, z. B. durch individuell angefertigte Vakuummatratzen, d. h. Lagerungshilfen, die mithilfe eines Vakuums exakt der Körperform angepasst werden, so sind dies die Voraussetzungen für eine „stereotaktische“ Bestrahlung des Tumors. Hierbei werden wenige Bestrahlungen, d. h. Fraktionen mit hohen Einzeldosen und entsprechend erhöhter biologischer Wirksamkeit, über multiple Einstrahlrichtungen eingestrahlt. Z. T. werden hierbei auch non-koplanare Felder verwendet, d. h. Felder, deren Einstrahlrichtungen nicht alle auf einer Ebene liegen.
Strahlenpneumonitis
Ein wesentlicher Parameter bei der Bewertung von Bestrahlungsplänen zur Behandlung von Lungenkarzinomen ist der Anteil beider Lungen, der mehr als 20 Gy erhält, d. h. die sogenannte V20 (Abb. 4). Bei kaum beeinträchtigter Lungenfunktion sollte diese nicht über 30–35% liegen, sonst steigt das Risiko einer sogenannten „Pneumonitis“, d. h. einer Strahlentherapie-bedingten Entzündungsreaktion, die auch erst Wochen nach Abschluss einer Radiatio auftreten kann [1]. Eine Pneumonitis geht zumeist mit Dyspnoe und trockenem Husten einher, kann auch mit Fieber kombiniert sein und wird zumeist über typische radiologische Veränderungen diagnostiziert. Unbehandelt kann sich eine Pneumonitis über die ursprünglichen Bestrahlungsfelder hinaus ausbreiten und zu einer tödlichen Komplikation werden. Die Behandlung besteht üblicherweise aus einer Steroidmedikation und ggf. einer zusätzlichen Antibiose bei Verdacht auf Superinfektion. Neben der V20 kann auch die mediane Lungendosis beider Lungen zur Beurteilung der Lungenbelastung hinzugezogen werden, diese sollte im Allgemeinen 20 Gy nicht überschreiten.
Kurative Therapie beim nicht-kleinzelligen Lungenkarzinom
Im Folgenden sollen die Indikationen zur Bestrahlung in den verschiedenen Situationen betrachtet werden. Die Therapieentscheidungen sollten möglichst immer interdisziplinär und am besten im Rahmen interdisziplinärer Tumorkonferenzen erfolgen. Dies ist auch eine zentrale Zertifizierungsanforderung der Deutschen Krebsgesellschaft (DKG) und daher in DKG-zertifizierten Zentren sichergestellt.
Stadium I-II
Im Stadium I-II ist üblicherweise ein operatives Vorgehen die Therapie der Wahl, die Strahlentherapie beschränkte sich in der Vergangenheit auf medizinisch oder funktionell inoperable Patientinnen und Patienten. Mit konventioneller Fraktionierung, also Aufteilung der Gesamtdosis auf wochentägliche Dosen um 2 Gy und Gesamtdosen bis zu über 80 Gy können jedoch heutzutage lokale Kontrollraten von 50–80% erreicht werden [2]. In den letzten Jahren zeigen die Ergebnisse verschiedenster Arbeitsgruppen insbesondere im Stadium I, d. h. bei Tumoren bis 5 cm Größe und ohne Lymphknoten- und Fernmetastasen (Klassifikation cT1a-2a cN0 M0) mittels stereotaktischer Strahlentherapie ähnlich gute Therapieergebnisse wie mit der Operation [3, 4]. Die in diesen Publikationen berichtete lokoregionale Kontrolle lag nach drei Jahren bei 87,2% bzw. 89%, das Gesamtüberleben bei 55,8% bzw. 47%. Bei Bewertung dieser Ergebnisse muss zusätzlich berücksichtigt werden, dass nur Patienten eingeschlossen wurden, die aufgrund einer stark eingeschränkten Lungenfunktion oder sonstiger Begleiterkrankungen inoperabel waren. Diese Resultate sind insbesondere auch deshalb überraschend, da die Operation weiterhin die systematische mediastinale Lymphadenektomie beinhaltet, bei der stereotaktischen Strahlentherapie die Lymphabflusswege dagegen nicht mitbehandelt werden.
Abhängig von der Lokalisation des Tumors werden verschiedene Fraktionierungen, d. h. Aufteilungen der Gesamtdosis auf verschiedene Einzeldosen, empfohlen, üblicherweise zwischen 3 x 20 Gy bis 5 x 12 Gy für periphere Lokalisationen und z. B. 8 x 7,5 Gy für zentrale, Hilus-nahe Lokalisationen. Die Gesamtdosen sollten einer biologischen Äquivalenzdosis von mindestens 100 Gy, bezogen auf eine konventionelle Fraktionierung mit 2 Gy Einzeldosis, entsprechen. Die Umrechnung der verschiedenen Einzel- und Gesamtdosen auf biologische Äquivalenzdosen erfolgt dabei mittels des sogenannten „Linear-quadratischen Gesetzes“, welches die biologischen Eigenschaften von verschiedenen Tumorarten und auch von Normalgewebe berücksichtigt.
Aufgrund der guten Therapieergebnisse mittels stereotaktischer Strahlentherapie war in den Niederlanden eine randomisierte Studie (ROSEL) zum Vergleich Operation versus stereotaktische Strahlentherapie initiiert worden, die aber wegen unzureichender Rekrutierung leider geschlossen werden musste.
Kommt aus verschiedenen Gründen oder aufgrund von Lymphknotenbefall im Stadium I-II eine stereotaktische Strahlentherapie nicht infrage, so sollte eine konventionell fraktionierte Strahlentherapie mit 2 Gy Einzeldosen bis zu einer Gesamtdosis von üblicherweise 60–70 Gy unter Berücksichtigung der Lungenfunktion erfolgen. Der Nutzen einer parallelen Chemotherapie ist in dieser Situation nicht gesichert.
Eine postoperative Strahlentherapie ist nur nach inkompletter Tumorresektion indiziert.
Ist im Stadium I-II aufgrund verschiedenster Faktoren eine kurative Therapie nicht mehr möglich, so sollte zumindest eine palliative Therapie mit 10–13 x 3 Gy oder auch 5 x 4 Gy zur Linderung von Symptomen wie Hämoptysen und/oder zur Wachstumsverzögerung erwogen werden.
Stadium IIIA/B
Im Stadium IIIA/B kann die Strahlentherapie bzw. die kombinierte Radiochemotherapie in unterschiedlichen Situationen eingesetzt werden. Lange Zeit hat man in diesen Stadien ein operatives Vorgehen von vornherein ausgeschlossen, und die definitive Radiatio bzw. die definitive Radiochemotherapie galt als Standardtherapie. Verschiedene Studien und auch eine Metaanalyse [5] haben dabei den zusätzlichen Gewinn durch zwei bis drei Zyklen einer parallelen Chemotherapie – üblicherweise Platin-basiert – gezeigt.
Für die Kombination mit neueren Substanzen wie Tyrosinkinaseinhibitoren oder monoklonalen Antikörpern liegen bisher noch keine ausreichenden Daten vor.
Die applizierte Gesamtdosis auf den Primärtumor und befallene Lymphknoten sollte dabei üblicherweise zwischen 60 und 70 Gy liegen, auch wenn vielfach davon ausgegangen wird, dass mit höheren Enddosen eine größere lokale Kontrolle und damit auch eine Verbesserung der Überlebensrate zu erreichen sein sollte. Die hierzu vor Kurzem veröffentlichten Ergebnisse einer Dosiseskalationsstudie bis 74 Gy haben allerdings zur großen Überraschung eine Verschlechterung des Überlebens mit der höheren Enddosis ergeben: Die 1-Jahres-Überlebensrate lag mit 60 Gy bei 81%, mit 74 Gy nur bei 70,4% [6]. Als Ursache wird vor allem eine erhöhte kardiale und pulmonale Toxizität im dosiseskalierten Arm angenommen.
Die mit einer kombinierten Radiochemotherapie im Stadium III erreichten 5-Jahres-Überlebensraten liegen zumeist unter 20%, sowohl wegen einer unzureichenden lokalen Kontrolle wie auch wegen des Auftretens einer Metastasierung. Eine alleinige Radiatio aufgrund von Kontraindikationen gegen eine Chemotherapie führt zu einer 5-Jahres-Überlebensrate von nur ca. 5%.
Immer mehr in den Fokus geraten auch im Stadium III multidisziplinäre Therapieansätze, insbesondere auch unter Berücksichtigung einer genaueren Klassifikation eines mediastinalen Lymphknotenbefalls im Sinne der Robinson-Klassifikation (Tab. 1), da gezeigt werden konnte, dass die Überlebensrate in der pN2-Situation auch abhängig ist von der Größe der befallenen Lymphknoten und der Anzahl der befallenen Level [7]. In den günstigen Situationen kann die Strahlentherapie sowohl prä- wie auch postoperativ zum Einsatz kommen. Durch eine neoadjuvante Radiochemotherapie können gegebenenfalls ein Downstaging und ein im pathologischen Präparat nachweisbares Ansprechen erreicht werden. Die Studien [8, 9] zeigen aber zumeist eine größere perioperative Mortalität insbesondere bei Notwendigkeit einer Pneumektomie (Tab. 2). Daher wird die Strahlentherapie vielfach erst postoperativ (Postoperative Radiation Therapy = PORT) eingesetzt.
Hatten frühere Auswertungen wie die PORT-Metanalyse [10] den Nutzen einer adjuvanten Strahlentherapie in der pN2-Situation noch infrage gestellt, so haben Subgruppenanalysen aus neueren adjuvanten Chemotherapie-Studien wie der ANITA-Studie [11] ebenso wie eine retrospektive SEER-Analyse doch eine Verbesserung des Gesamtüberlebens durch die postoperative Strahlentherapie ergeben [12]. Der Grund dürfte insbesondere in den moderneren strahlentherapeutischen Techniken liegen im Vergleich zu den Techniken in den älteren Untersuchungen. Üblicherweise wird die postoperative Strahlentherapie des mediastinalen Lymphabflussgebietes mit 1,8–2 Gy Einzeldosis bis ca. 50 Gy durchgeführt. Nach R1/R2-Resektion sollte eine kleinvolumige Aufsättigung der entsprechenden Region bis 60 oder 66 Gy erfolgen, der Nutzen einer parallelen Chemotherapie ist in dieser Situation nicht gesichert.
Pancoast-Tumor
Im Falle eines Tumors des Sulcus superior (sogenannter „Pancoast-Tumor“) mit Infiltration von Rippen, Wirbelkörpern, Plexus brachialis, Ganglion stellatum und/oder subklavikulären Gefäßen und entsprechender klinischer Symptomatik wie Schulterschmerzen und Horner-Syndrom (Ptosis, Miosis, Enophthalmus) stellt die präoperative Radiochemotherapie mit nachfolgender Operation weiterhin den Therapiestandard dar. In der zugrunde liegenden Studie der Southwest Oncology Group (SWOG) wurden bei Patienten mit T3-4 N0-1-Tumoren 45 Gy in 1,8 Gy Einzeldosis in Kombination mit zwei Zyklen Cisplatin und Etoposid [13] appliziert. Hierdurch konnte eine komplette Resektion in 76% der Fälle erreicht werden, 36% der Patienten hatten eine komplette pathologische Remission durch die Vorbehandlung. Die 5-Jahresüberlebensrate lag bei 44%.
Ist die nachfolgende Operation nur im Sinne einer R1- bzw. R2-Resektion durchgeführt worden, so kann gegebenenfalls eine weitere Dosisaufsättigung mit 10–15 Gy erfolgen. Bei Inoperabilität ist eine kombinierte Radiochemotherapie bis ca. 60 Gy indiziert, gegebenenfalls zur Verminderung des Risikos einer therapiebedingten Plexusschädigung auch hyperfraktioniert, d. h. mit mehr Fraktionen und kleineren Einzeldosen von 1,2 Gy bis 66–69,6 Gy.
Prophylaktische Hirnschädel-Bestrahlung
Sowohl beim kleinzelligen wie auch beim nicht-kleinzelligen Lungenkarzinom stellt die zerebrale Metastasierung nach kurativer Therapie eine der häufigsten Rezidiv-Manifestationen dar. Beim kleinzelligen Karzinom konnte gezeigt werden, dass durch eine prophylaktische Bestrahlung des Hirnschädels mit üblicherweise 30 Gy in 15 Fraktionen à 2 Gy eine Verbesserung des Überlebens sowohl bei begrenzter (Limited Disease) wie auch bei fortgeschrittener Erkrankung (Extensive Disease) erreicht werden kann [14, 15]. Anders beim nichtkleinzelligen Karzinom, denn auch wenn es hier ebenfalls vereinzelte Arbeiten mit dem Hinweis auf einen positiven Effekt einer prophylaktischen Hirnschädel-Bestrahlung nach kurativer Therapie gibt [16], ist diese aufgrund fehlender endgültiger Daten bisher nicht etabliert.
Palliative Therapie
Wie bei den meisten anderen Tumorerkrankungen spielt die Strahlentherapie auch in palliativer Situation beim nicht-kleinzelligen Lungenkarzinom vielfach eine wesentliche Rolle. Bei Hämoptysen oder lokaler Tumorprogression trotz Systemtherapie z. B. mit Vergrößerung mediastinaler Lymphknoten und hierdurch bedingter Recurrens-Parese kann die Strahlentherapie zur Symptomlinderung und/oder Wachstumsverzögerung eingesetzt werden. Die Fraktionierungen reichen hierbei von 25 x 2 Gy über 10 x 3 Gy bis zu 5 x 4 Gy. Die stark hypofraktionierten Schemata, d. h. die Schemata mit wenigen Fraktionen und hohen Einzeldosen, werden dabei vielfach im Ausland aufgrund logistischer Aspekte eingesetzt.
Weitere palliative Strahlentherapie-Indikationen bestehen bei ossären oder multiplen zerebralen Filiae. Diese können zumeist sehr effektiv mit 10 x 3 Gy behandelt werden. Bei singulären (einzelnen) oder sogar solitären (alleinigen) Hirnmetastasen sollten dabei auch neurochirurgische Möglichkeiten überprüft werden, ebenso aber auch die stereotaktische Bestrahlung mittels speziell ausgestatteter Linearbeschleuniger oder auch dem Gammaknife, d. h. einem Strahlentherapie-Gerät, bei dem bis zu über 200 Kobaltquellen so angeordnet sind, dass eine fokussierte Bestrahlung auch kleinster cerebraler Manifestationen möglich wird. Im Falle einer solitären Metastase kann sich nach neurochirurgischer oder stereotaktischer Therapie ggf. als kurativer Therapieversuch noch eine definitive Therapie des Primärtumors mittels Resektion oder Radiochemotherapie anschließen.
Literatur
1. Amstrong J et al. Promising survival with three-dimensional conformal radiation therapy for non-small cell lung cancer. Radiother Oncol 1997; 44: 17-22.
2. Bradley J et al. Toxicity and outcome results of RTOG 9311: A phase I–II dose-escalation study using three-dimensional conformal radiotherapy in patients with inoperable non–small-cell lung carcinoma. Int J Radiat Oncol Biol Phys 2005; 61: 318-28.
3. Timmerman R et al. Stereotactic body radiation therapy for inoperable early stage lung cancer. JAMA 2010; 303: 1070-76.
4. Palma D et al. Curative treatment of stage I non-small-cell lung cancer in patients with severe COPD: Stereotactic radiotherapy outcomes and systematic review. Int J Radiat Oncol Biol Phys 2012; 61: 318-28.
5. Aupérin A et al. Meta-analysis of concomitant versus sequential radiochemotherapy in locally advanced non–small-cell lung cancer. J Clin Oncol 2010; 28: 2181-190.
6. Bradley JD et al. A randomized phase III comparison of standard-dose (60 Gy) versus high-dose (74 Gy) conformal chemoradiotherapy with or without cetuximab for stage III non-small cell lung cancer: Results on radiation dose in RTOG 0617. J Clin Oncol 2013; 31: 7501.
7. Andre F et al. Survival of patients with resected N2 non–small-cell lung cancer: Evidence for a subclassification and implications. J Clin Oncol 2000; 18: 2981-89.
8. Albain KS et al. Radiotherapy plus chemotherapy with or without surgical resection for stage III non-small-cell lung cancer: a phase III randomised controlled trial. Lancet 2009; 374: 379-86
9. Thomas M et al. Effect of preoperative chemoradiation in addition to preoperative chemotherapy: A randomised trial in stage III non-small-cell lung cancer. Lancet Oncol 2008; 9: 636-48.
10. Burdett S et al. PORT Meta-analysis Group. Postoperative radiotherapy in non-small cell lung cancer: Update of an individual patient data meta-analysis. Lung Cancer 2005; 47: 81-83.
11. Douillard JY et al. Impact of postoperative radiation therapy on survival in patients with complete resection and stage I, II, or IIIA non-small-cell lung cancer treated with adjuvant chemotherapy: The adjuvant Navelbine International Trialist Association (ANITA) randomized trial. Int J Radiat Oncol Biol Phys 2008; 72: 695-701.
12. Lally BE et al. Postoperative radiotherapy for stage II or III non-small-cell lung cancer using the Surveillance, Epidemiology and End Results database. J Clin Oncol 2006; 24: 2998-3006.
13. Rusch VW et al. Induction chemoradiation und surgical resection for non-small-cell lung carcinomas of the superior sulcus: Long term results of Southwest Oncology Group trial 9416 (Intergroup trial 0160). J Clin Onc 2007; 25: 313-8.
14. Aupérin A et al. Prophylactic cranial irradiation for patients with small-cell lung cancer in complete remission. Prophylactic Cranial Irradiation Overview Collaborative Group. N Eng J Med 1999; 341: 476-84.
15. Slotman B et al. Prophylactic cranial irradiation in extensive small-cell lung cancer. N Eng J Med 2007; 357: 664-72.
16. Poettgen C et al. Prophylactic cranial irradiation in operable stage IIIA non-small-cell lung cancer treated with neoadjuvant chemoradiotherapy: Results from a German multicenter randomized trial. J Clin Oncol 2007; 25: 4987-92.

Dipl.-Phys. Dr. med. Kay C. Willborn
Facharzt für Strahlentherapie
Klinik für Strahlentherapie und Radioonkologie
Pius-Hospital Oldenburg
Georgstraße 12, 26121 Oldenburg
Tel.: 0441/229-1601 oder -1625
Fax: 0441/229-1645
Kay.Willborn[at]Pius-Hospital[dot]de

