Stadienabhängige chirurgische Therapie des nicht-kleinzelligen Lungenkarzinoms
Einleitung
Die Prognose nach Diagnosestellung eines nicht-kleinzelligen Lungenkarzinoms (NSCLC) ist schlecht. Ein Jahr nach Diagnosestellung leben noch 45%, nach fünf Jahren noch 14% der Patienten (über alle Stadien und alle Therapieformen). Betrachtet man die Untergruppe der kurativ operierten Patienten im Stadium IA, so findet man jedoch Überlebenswahrscheinlichkeiten von 93% nach einem Jahr und 70-80% nach fünf Jahren. Insofern bietet die Operation beim NSCLC im frühen Stadium eine begründete Aussicht auf Heilung. Bei Tumoren im Stadium II und III ist ein kombinierter Therapieansatz in der Regel die Therapie der Wahl und bietet die besten Überlebenschancen. Hier ist die Operation eine zentrale Modalität in einem multimodalen Behandlungskonzept.
Behandlung in einem Zentrum
Die chirurgische Therapie von Patienten mit Lungenkarzinom sollte in einem zertifizierten Lungenkrebszentrum oder zumindest in Zusammenarbeit mit einem Zentrum durchgeführt werden. Für die chirurgische Therapie des Lungenkarzinoms belegen zahlreiche Publikationen eine signifikante Assoziation zwischen höherer Fallzahl und niedrigerer postoperativer Letalität. Eine kürzlich publizierte Metaanalyse identifizierte 95 Publikationen, von denen 19 in die Analyse einbezogen wurden [1]. Die ausgewerteten Daten von rund 170.000 Patienten zeigen eine signifikant niedrigere postoperative Letalität in Klinken mit hohem Fallvolumen (OR 0,71; 95%-Konfidenzintervall 0,62–0,81). Das individuelle Volumen des Chirurgen spielte dabei keine Rolle, das Fachgebiet dagegen schon. Bei Thoraxchirurgen war die Letalität signifikant geringer (OR 0,78; 95%-KI 0,70–0,88) als bei Allgemeinchirurgen.
Generell sollte es einer sorgsam geführten, alle Faktoren der Tumorausdehnung und der individuellen Komorbidität berücksichtigenden Beratung in einem interdisziplinären Tumorboard überlassen bleiben, die Indikation zur Operation zu stellen oder abzulehnen. Inoperabilität sollte nicht allein aufgrund der “Papierform” konstatiert werden, sondern nur unter Berücksichtigung aller individuellen Patientenfaktoren. Aufgabe interdisziplinärer Tumorkonferenzen ist das kritische Abwägen der differenzialtherapeutischen Optionen als Basis der ärztlichen Empfehlung. Die umfassende Information des Patienten über die Empfehlungen der Tumorkonferenz ist Voraussetzung für seine autonome Entscheidung.
Indikation und Ziel der operativen Therapie
Die Operation des NSCLC mit kurativer Zielsetzung setzt voraus, dass sich 1) die Erkrankung auf den Thorax beschränkt, 2) eine komplette Resektion mit ausreichenden Sicherheitsabständen im Gesunden technisch möglich ist und 3) der dazu erforderliche Eingriff dem Patienten mit vertretbarem Risiko zumutbar ist. Insofern stehen vor der Indikationsstellung zu einem chirurgischen Eingriff die Beurteilung der lokalen Tumorausdehnung, der Ausschluss von Fernmetastasen und die Einschätzung der allgemeinen und funktionellen Operabilität des Patienten.
Primäres Therapieziel bei allen onkologischen Operationen mit kurativer Zielsetzung ist die radikale Resektion des Tumors mit ausreichend freien Resektionsrändern (R0). Die Radikalität der Operation ist neben den TNM-Deskriptoren der entscheidende Prognosefaktor. Sie wird intraoperativ mittels histopathologischer Schnellschnittdiagnostik gesichert. Bei R1-Resektion ist nach Möglichkeit eine Nachresektion vorzunehmen; ist dies nicht möglich, wird – mit allerdings schlechterer Prognose als nach kompletter Resektion – die volldosierte adjuvante Nachbestrahlung des OP-Betts (ca. 60 Gy innerhalb von 6-8 Wochen postoperativ) empfohlen (interdisziplinäre Entscheidungsfindung).
Gleichrangiges Therapieziel ist der Erhalt allen gesunden Lungengewebes. Vor allem gilt es, eine Pneumonektomie wann immer möglich zu vermeiden. Um das zu erreichen, sind insbesondere bei Patienten im Stadium III häufig erweiterte Resektionen mit bronchoplastischen und/oder angioplastischen Rekonstruktionen erforderlich. Eine entsprechende Expertise der behandelnden Institution für diese Eingriffe muss vorhanden sein.
Die Entscheidung zur operativen Therapie basiert auf der klinischen Stadieneinteilung (Tab. 1) nach Abschluss der Staging-Diagnostik unter Berücksichtigung der lungenfunktionellen Reserve und Komorbiditäten. Nach einer Operation wird die weitere (adjuvante) Therapie durch die Ergebnisse der pathologischen Untersuchungen, insbesondere der histologischen Differenzierung und des Lymphknotenstatus, definiert. Nach einer primären systemischen Behandlung mit oder ohne Bestrahlung (Induktionstherapie) wird das weitere Vorgehen durch das Ansprechen auf die Therapie bestimmt.
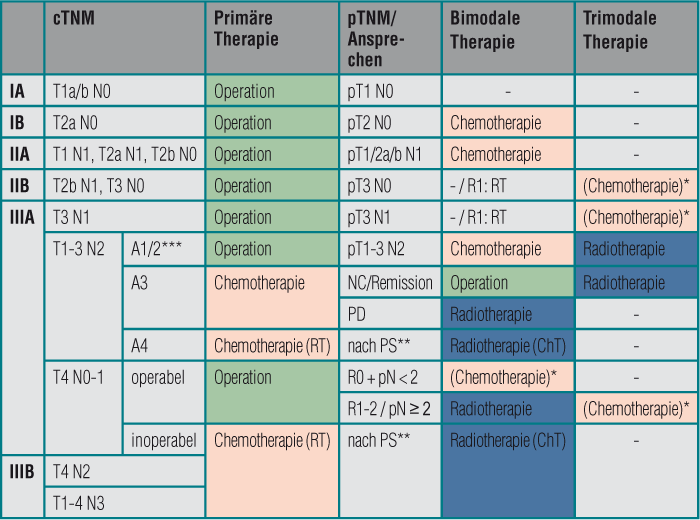
Tab. 1: Stadienabhängige Therapie des nicht-kleinzelligen Lungenkarzinoms. Die Entscheidung zur Primärtherapie erfolgt auf Basis des klinischen Tumorstadiums (cTNM), die Entscheidung zur postoperativen adjuvanten Therapie auf Basis des pathologischen Stadiums (pTNM).
* kein Standard; Entscheidung im interdisziplinären Tumorboard
** bei gutem PS simultane Radiochemotherapie, sonst sequenziell
*** Klassifikation nach Robinson (Ausmaß des mediastinalen Lymphknotenbefalls)
Bildquelle: Autor
Intraoperatives Vorgehen
Lungenresezierende Eingriffe mittels Videothorakoskopie oder Thorakotomie setzen Allgemeinanästhesie und Intubation mit einem Doppellumen-Tubus voraus. Dies gestattet bei Einlungen-Ventilation und kompletter Atelektase der operierten Seite die beste Übersicht und größtmögliche Gewebeschonung bei Präparation und Resektion.
Wird die Indikation zur Operation bei einem unklaren Lungenrundherd gestellt und ist das Karzinom präoperativ nicht gesichert, wird der Lungenrundherd zunächst Parenchym-sparend im Sinne einer atypischen Resektion komplett entfernt und eine intraoperative Schnellschnittdiagnostik durchgeführt. Bei Nachweis eines Lungenkarzinoms wird der Eingriff fortgeführt und es erfolgt zunächst der Ausschluss oder Nachweis einer intrathorakalen Metastasierung. Die gesamte ipsilaterale Lunge wird auf das Vorhandensein intrapulmonaler Metastasen untersucht, die viszerale und parietale Pleura werden auf Tumorabsiedlungen inspiziert, Tumoradhäsionen oder Infiltrationen werden identifiziert. Alle makroskopisch verdächtigen Befunde werden durch intraoperative Schnellschnittdiagnostik mikroskopisch verifiziert.
Nach Feststellung der Resektabilität erfolgt die Festlegung des erforderlichen Resektions-Ausmaßes. Bei Patienten mit ausreichender funktioneller Reserve sind Standard-Resektionsverfahren die Lobektomie, die Lobektomie mit bronchoplastischer und/oder angioplastischer Erweiterung, die Bilobektomie oder die Pneumonektomie. Nicht-anatomische oder atypische Lungenresektionen sind nur in Ausnahmefällen bei Hochrisiko-Patienten gerechtfertigt (s. u.). Die Lobektomie ist das Verfahren der Wahl bei Tumoren, deren Ausbreitung auf das Parenchym eines Lungenlappens beschränkt ist. Sie erlaubt die komplette Tumorresektion en bloc mit pleuralen und zentralen Lymph-Abflussgebieten. Eine Lobektomie wird in der Regel gut toleriert, die verbleibende Restlunge füllt die Pleurahöhle gut aus, der Funktionsverlust beträgt im Langzeitverlauf unter 10% der präoperativen 1-Sekunden-Kapazität. Die Krankenhausletalität nach Lobektomie wird in großen Serien mit etwa 2% angegeben und ist damit deutlich niedriger als nach Pneumonektomie.
Eine Bilobektomie umfasst die Resektion des rechten Ober- und Mittellappens (obere Bilobektomie) oder des rechten Unterlappens einschließlich Mittellappen (untere Bilobektomie). Bilobektomien sind erforderlich, wenn der Tumor peripher (z. B. anteriores Oberlappensegement – zentrales Mittelappensegment) oder zentral (z. B. Segment 6 – Bronchus) die Lappengrenzen überschreitet. Auch ein interlobärer Lymphknotenbefall kann in bestimmten Fällen eine Bilobektomie erforderlich machen. Häufiger ist jedoch dann die Indikation zur Pneumonektomie gegeben. Morbidität und Letalität nach Bilobektomie sind geringfügig höher als nach Lobektomie, aber signifikant geringer als nach Pneumonektomie.
Eine Pneumonektomie ist bei zentralem Tumorsitz indiziert, wenn durch eine Lob-/Bilobektomie auch unter Einschluss bronchoplastischer/angioplastischer Erweiterungen keine komplette Resektion erzielt werden kann. Dies ist der Fall bei großen peripheren Tumoren mit lappenüberschreitendem Wachstum oder bei langstreckigem Tumorbefall des Hauptbronchus. Postoperative Morbidität und Letalität der Pneumonektomie sind signifikant höher als nach Lobektomie. Aufgrund der höheren Inzidenz einer Bronchusstumpf-Insuffizienz ist die rechtsseitige Pneumonektomie mit höherer Morbidität und Letalität assoziiert als die linksseitige. Zentrale Tumorausbreitung entlang der großen Gefäße kann eine Erweiterung der Pneumonektomie durch Perikardiotomie/-resektion und intraperikardiale Gefäßabsetzung erforderlich machen. Nach intraperikardialer Pneumonektomie treten vermehrt postoperativ kardiale Arrhythmien auf; die sonstige Morbidität oder Letalität ist im Vergleich zur Standard-Pneumonektomie aber nicht erhöht. Eine weitere Form der erweiterten Pneumonektomie ist die Manschetten-Pneumonektomie unter Einschluss der distalen Trachea (Bifurkations-Resektion) und Anlage einer End-zu-End-Anastomose des gegenseitigen Hauptbronchus und der Trachea. Diese ist indiziert bei Befall des proximalen Hauptbronchus bzw. der Carina, wenn dadurch eine komplette Resektion erzielt werden kann.
Bronchoplastische/angioplastische Verfahren
Endobronchialer Tumorbefall der zentralen Lappenbronchen oder kapselüberschreitendes Wachstum befallener interlobärer Lymphknoten (N1) sind die Indikation zu broncho- und/oder angioplastischen Resektionen. Manschettenresektionen an Bronchialbaum und Lungengefäßen – als sogenannte organerhaltende Operationen – lassen in diesen Fällen die Pneumonektomie vermeiden, ohne die Radikalität einzuschränken. Technische Komplexität des Eingriffs, Morbidität und postoperativer Überwachungsaufwand sind höher als bei Standard-Lobektomie. Morbidität und Letalität sind bei entsprechender Erfahrung des Operateurs jedoch niedriger als nach Pneumonektomie.
Erweiterte Resektion
Unter erweiterter Resektion versteht man die Einbeziehung aller die Lungengrenzen überschreitenden Befunde oder die En-bloc-Resektion des Lungentumors mit angrenzenden Strukturen. Während eine direkte Infiltration der Thoraxwand in der Regel technisch unproblematisch zu resezieren ist, stellt die Infiltration des Mediastinums eine Grenzindikation für eine primär chirurgische Therapie dar und bedarf der erfahrenen thoraxchirurgischen Beurteilung. Postoperative Letalität und Morbidität nach erweiterter Resektion sind höher als nach vergleichbarer einfacher Resektion. Diese Eingriffe sollten daher nur an erfahrenen Zentren durchgeführt werden.
Lymphknotendissektion
Bei allen onkologischen Resektionen mit kurativer Zielsetzung ist eine systematische interlobäre, hiläre und mediastinale Lymphknotendissektion obligat. Die Anforderungen an eine systematische mediastinale Lymphknotendissektion sind erfüllt, wenn bei rechtsseitigen Resektionen das paratracheale Kompartiment (Lymphknoten-Stationen #2 und #4), das infra-carinäre Kompartiment (Lymphknoten-Stationen #7 und #8) und das inferiore Kompartiment (Lymphknoten-Station #9) ausgeräumt werden; bei linksseitigen Resektionen entsprechend das aortopulmonale Kompartiment (Lymphknoten-Stationen #5 und #6), das infra-carinäre und das inferiore Kompartiment. Die während der Operation entfernten und anschließend histopathologisch untersuchten Lymphknoten definieren den postoperativen N-Status (pN) als Basis für die Entscheidung zur adjuvanten Therapie. Die systematische Lymphknotendissektion kann die Prognose in erster Linie dadurch verbessern, dass ein der klinischen Diagnostik entgangener Lymphknotenbefall nachgewiesen und entsprechend eine adjuvante Therapie veranlasst wird. Auch bei leitliniengerechter umfassender präoperativer Diagnostik mit PET-CT unter Einschluss bioptischer Verfahren (Bronchoskopie mit endobronchialem Ultraschall, Mediastinoskopie) ergibt sich in rund 20-25% der Fälle eine „Korrektur“ des cN-Status durch den pN-Status. Ohne die operative Lymphknotendissektion blieben diese Patienten unterdiagnostiziert; eine ggf. indizierte adjuvante Chemotherapie würde ihnen vorenthalten werden. Ein direkter therapeutischer Effekt der Lymphknotendissektion ist durch Resektion tumorbefallener Lymphknoten im Sinne einer lokalen Tumorkontrolle möglich. Die prognostische Relevanz bleibt aber unklar, denn letztlich ist eine stattgehabte Lymphknoten-Metastasierung Ausdruck einer Generalisierung des Tumorleidens, die nicht durch eine lokale Therapie beherrschbar ist.
Therapie im Stadium I und im Stadium II [2, 3, 4]
Die radikale Resektion ist bei allen operablen Patienten im Stadium I und bei der Mehrzahl der Patienten im Stadium II die primäre Therapie der Wahl, wenn keine Kontraindikationen vorliegen (Tab. 1). Stadium I umfasst Lungenkarzinome ohne Lymphknotenbefall mit einem größten Durchmesser < 3 cm (Stadium IA) bzw. 3–5 cm (Stadium IB). Stadium II umfasst Lungenkarzinome mit lokal begrenztem intrapulmonalem und/oder hilärem Lymphknotenbefall oder große (5–7 cm) nodal negative Tumoren. Die Standardresektion ist die einfache Lobektomie oder Manschettenlobektomie (bei infiltrativem N1-Lymphknotenbefall am proximalen Lappenbronchus) mit systematischer interlobärer, hilärer und mediastinaler Lymphknotendissektion.
Limitierte Resektion
Limitierte Resektionen (anatomische Segmentresektion, atypische Resektion) sind eine chirurgisch-therapeutische Option bei Patienten mit kleinen, peripher gelegenen Tumoren im Stadium I, die funktionell für eine Standardresektion nicht operabel erscheinen. Aus Gründen der Radikalität dürfen limitierte Resektionen aber nur bei Patienten mit stark eingeschränkter funktioneller Reserve vorgenommen werden. Die Lokalrezidiv-Rate ist nach limitierter Resektion eines NSCLC im Stadium IA (T1N0) etwa dreimal so hoch wie nach Lobektomie. Neuere retrospektive Analysen größerer Kohorten aus USA (SEER-Daten) und Japan lassen vermuten, dass bei Tumoren < 2 cm im Durchmesser und prognostisch günstiger histologischer Subdifferenzierung eine anatomische Segmentresektion der Lobektomie onkologisch gleichwertig ist. Dies gilt insbesondere für Adenokarzinome mit lepidischer Subdifferenzierung. Allerdings müssen bis zur definitiven Einschätzung die Ergebnisse der zwei in Japan und USA laufenden randomisierten Studien abgewartet werden. Aktuell gilt nach wie vor die Lobektomie als Standard.
Minimal-invasive Operation (VATS-Lobektomie)
Als operativer Standard für Tumoren im Stadium I hat sich die videothorakoskopisch durchgeführte Lobektomie (VATS-Lobektomie) etabliert. Die VATS – als minimal-invasives Verfahren – ist aufgrund deutlich kleinerer Inzisionen und Verzicht auf eine Rippenspreizung für den Patienten deutlich weniger belastend als eine offene Thorakotomie. Onkologisch ist die VATS-Lobektomie der offenen Lobektomie nicht unterlegen, sofern keine Kompromisse in der onkologischen Radikalität und insbesondere bei der Lymphknotendissektion gemacht werden. Prinzipiell ist jede anatomische Lungenresektion minimal-invasiv und onkologisch korrekt durchführbar. Bei interlobärer Lymphknotenmetastasierung im Stadium II oder mediastinaler Lymphknotenmetastasierung kommt das videothorakoskopische Vorgehen allerdings aufgrund begrenzter Übersicht an seine Grenzen. In diesen Fällen sollte man zur offenen Thorakotomie konvertieren, um Kompromisse in der onkologischen Radikalität zu vermeiden.
Adjuvante Therapie
Die 5-Jahres-Überlebensraten nach kurativer Resektion bei NSCLC im Stadium IA liegen bei 75–80%. Eine adjuvante Chemotherapie verbessert sie nicht. In der postoperativen Situation nach R0-Resektion hat die Strahlentherapie einen negativen Einfluss auf die Prognose und ist nicht indiziert. Für Stadium IB weisen die großen Register postoperative 5-Jahres-Überlebensraten von 55–60% aus. In der Metaanalyse führt die adjuvante Chemotherapie im Stadium IB zur Verbesserung der 5-Jahres-Überlebensrate um absolut 1,8%. Die aus diesen Daten abgeleiteten Empfehlungen verschiedener Leitlinien sind nicht einheitlich. Retrospektive Analysen deuten darauf hin, dass möglicherweise Patienten mit zusätzlichen Risikofaktoren (z. B. Tumorgröße > 4 cm) stärker von der adjuvanten Chemotherapie profitieren. Diese zusätzlichen Parameter sind allerdings nicht prospektiv validiert. Eine adjuvante Bestrahlung ist nur nach inkompletter Resektion indiziert, wenn eine Nachresektion unmöglich ist; postoperativ nach R0-Resektion wirkt sie sich negativ auf die Prognose aus und ist nicht indiziert. Bei inoperablen Patienten ist die Strahlentherapie eine alternative primäre Therapieoption.
Die postoperativen 5-Jahres-Überlebensraten nach alleiniger Operation für das Stadium IIA liegen zwischen 45% und 55% und für das Stadium IIB zwischen 35% und 45%. Alle aktuellen Leitlinien empfehlen eine adjuvante Chemotherapie nach erfolgter R0-Resektion. Sie führte in einer Metaanalyse von 34 Studien mit unterschiedlichen Chemotherapie-Protokollen zu einer Verbesserung der 5-Jahres-Überlebensrate um 5% absolut. In der Langzeit-Metaanalyse von mit einer Kombination aus Cisplatin und Vinorelbin behandelten Patienten der LACE-Studie lag die 5-Jahres-Überlebensrate um 11,6% höher als in der Kontrollgruppe.
Die Strahlentherapie hat in der postoperativen Situation nach R0-Resektion im Stadium II einen negativen Einfluss auf die Prognose und ist nicht indiziert. Die Strahlentherapie ist eine Alternative als primäre Therapiemaßnahme bei inoperablen Patienten. Sie kann auch indiziert sein in einer postoperativen R1- oder R2-Situation, wenn eine erneute Operation nicht möglich ist.
Therapie im Stadium III [3, 4, 5]
Das Stadium III umfasst eine heterogene Gruppe von Patienten (siehe Tab. 1). Operationen bei Patienten im Stadium III erfordern häufig komplexe Resektionen. An der radikalen Resektion müssen daher ggf. neben der Thoraxchirurgie andere chirurgische Disziplinen (z. B. Herz- und Gefäßchirurgie, Neurochirurgie, Wirbelsäulenchirurgie) beteiligt werden. Die 5-Jahres-Überlebensraten liegen für das Stadium IIIA zwischen 15% und 70%, für das Stadium IIIB zwischen 5% und 10%. Vor allem Ausmaß und Lokalisation der mediastinalen Lymphknotenmetastasen sind prognostisch relevant und werden in der Subklassifikation nach Robinson erfasst.
Therapie bei mediastinalen Lymphknotenmetastasen
(N2), Robinson IIIA1,2
Diese Gruppe umfasst Patienten, bei denen das klinische Staging zunächst einen cN0- oder cN1-Status ergeben hatte, auf dessen Basis man sich zur primären Operation entschloss. Bei der pathologischen Untersuchung der entfernten mediastinalen Lymphknoten wurde ein mediastinaler Lymphknotenbefall intraoperativ (= Robinson A2) bzw. postoperativ (= Robinson A1) gesichert. Bei diesen Patienten ist der N2-Status somit definitionsgemäß erst intraoperativ bzw. postoperativ in der histologischen Aufarbeitung diagnostiziert worden (= inzidentelles N2).
Postoperativ, nach R0-Resektion und abgeschlossener Wundheilung, ist eine adjuvante Chemotherapie mit vier Zyklen eines platinbasierten Regimes indiziert. Mit der adjuvanten Chemotherapie sollte vier bis acht Wochen postoperativ begonnen werden. Anschließend ist eine zusätzliche adjuvante Radiotherapie zu diskutieren. Sie reduziert das lokale Rezidivrisiko, wirkt sich aber nicht signifikant auf die Gesamtüberlebenszeit aus. In der Regel wird die adjuvante Strahlentherapie bei N2-Situation im Anschluss an die adjuvante Chemotherapie bei Patienten unter 65 Jahren in gutem Allgemeinzustand angeboten. Nach R1-Resektion – ohne Option einer Nachresektion – kann die Strahlentherapie auch als primäre adjuvante Therapie indiziert sein.
Therapie bei mediastinalen Lymphknotenmetastasen
(N2), Robinson IIIA3
In diese Gruppe fallen Patienten, bei denen bereits mit dem klinischen Staging eine Metastasierung des Tumors in ipsilaterale mediastinale Lymphknoten gesichert wurde. Tumor und Lymphknotenmetastasen werden jedoch als resektabel beurteilt (Beurteilung im Tumorboard unter Anwesenheit eines erfahrenen Thoraxchirurgen!). Somit liegt keine „bulky-N2“-Situation vor. In dieser Konstellation hat die Operation ihren Stellenwert im Rahmen eines multimodalen Therapiekonzepts. In der Regel erfolgt die Operation nicht primär, sondern sekundär nach einer Induktions-Chemotherapie oder Induktions-Chemoradiotherapie. In Einzelfällen – bei Befall lediglich einer Lymphknotenstation ohne Anhalt für Kapseldurchbruch – kann die Operation auch am Anfang der multimodalen Therapiesequenz stehen, mit anschließender adjuvanter Chemotherapie mit oder ohne Radiotherapie (multidisziplinärer Tumorboard-Entscheid).
Der Nutzen einer multimodalen, idealerweise trimodalen Therapie im resektablen Stadium IIIA ist mit belastbarer Evidenz belegt, es gibt jedoch keine eindeutige Evidenz für den Vorteil einer bestimmten Therapiesequenz (CT→OP→RT oder CT→RT→OP oder OP→CT→RT). In Phase-II-Studien war die Sequenz Chemoradiotherapie→OP zumeist mit einer höheren Morbidität und einer tendenziell höheren therapiebedingten Mortalität verbunden als die alleinige Operation oder die Sequenz CT→OP→RT. Die Entscheidung zu einer Resektion nach Induktionstherapie sollte bereits vor Beginn der Gesamttherapie getroffen werden. Nach Induktions-Chemoradiotherapie und Operation mit R0-Resektion sollte postoperativ keine weitere Strahlentherapie erfolgen.
Ein Befall mehrerer Lymphknoten-Stationen ist prognostisch ungünstig, insbesondere bei fehlendem Ansprechen nach Induktionstherapie. In dieser Situation sollte der Einsatz der Operation zugunsten einer definitiven Radiochemotherapie kritisch re-evaluiert werden.
Therapie bei mediastinalen Lymphknotenmetastasen
(N2), Robinson IIIA4
Es liegt eine – bereits im klinischen Staging gesicherte – primär nicht resektable N2-Metastasierung vor (“bulky N2”).Eine Operation mit kurativer Zielsetzung ist in diesem Stadium in der Regel nicht möglich. Die Beurteilung und Entscheidung bzgl. Operabilität muss jedoch in jedem Fall interdisziplinär in Anwesenheit eines erfahrenen Thoraxchirurgen erfolgen. Therapie der Wahl ist die definitive simultane Chemoradiotherapie. Lediglich für ausgewählte Patienten ist die Induktionstherapie, gefolgt von der Operation, eine Option, z. B. Induktions-Chemotherapie→OP→RT; Voraussetzungen hierfür sind jedoch ein guter Allgemeinzustand und ein sehr gutes Ansprechen auf die Induktionstherapie.
Therapie der Stadien T3N1 und T4N0-1
Die Operation ist die Therapie der Wahl, wenn keine Kontraindikationen vorliegen und der Lokalbefund als operabel beurteilt wird. Gelingt eine radikale Resektion, haben diese Patienten eine sehr gute Prognose mit 5-Jahres-Überlebensraten von bis zu 70%. Aufgrund der lokalen Tumorausdehnung sind häufig erweiterte Resektionen und sogenannte Manschettenresektionen mit broncho- und/oder angioplastischer Rekonstruktion erforderlich. Diese Eingriffe erfordern häufig ein Zusammenwirken von Chirurgen mehrerer Fachdisziplinen und eine komplexe postoperative Betreuung. In erfahrenen Zentren sind solche Eingriffe jedoch mit vertretbarer Morbidität und geringer Letalität durchführbar.
Nach R0-Resektion und abgeschlossener Wundheilung bei gutem Allgemeinzustand und Bestätigung eines pN1-Befundes besteht die Indikation zu einer adjuvanten platinbasierten Chemotherapie (vier Zyklen). Damit sollte vier bis acht Wochen nach der Operation begonnen werden. Die Indikation zur adjuvanten Radiotherapie sollte abhängig von der R-Situation (R-Status + Resektionsabstand), befallenen/resezierten Strukturen und pN-Status sowie postoperativem Allgemeinzustand diskutiert werden.
Wenn Unklarheit besteht, ob primär eine radikale (R0-) Resektion erzielt werden kann, stellt auch die präoperative Strahlenchemotherapie für selektierte Patienten eine Option dar.
Pancoast-Tumoren [3, 4, 6]
Pancoast-Tumoren (engl. Synonym: Superior Sulcus Tumor) sind eine distinkte Entität nicht-kleinzelliger Lungenkarzinome. Charakteristisch dafür sind die Folgen des lokalen Wachstums, ausgehend von der Lungenspitze, mit Infiltration neuraler (Plexus brachialis, Ganglion stellatum) und/oder ossärer Strukturen (Rippen, Wirbelkörper). Entscheidend für die Therapieplanung ist die optimale lokale Bildgebung mittels CT und MRT zur Beurteilung der Operabilität, insbesondere die Beziehung zum Plexus brachialis, ggf. zu den Neuroforamina und Wirbelkörpern.
Prospektiv randomisierte Studien zur Therapie von Pancoast-Tumoren fehlen. Die besten Ergebnisse werden durch eine primäre Induktions-Chemoradiotherapie gefolgt von einer Operation erzielt. Die Prognose wird wesentlich vom primären Lymphknotenstatus und vom Erreichen einer R0-Resektion bestimmt. Die Beurteilung der Operabilität nach Induktionstherapie erfordert eine enge interdisziplinäre Abstimmung mit ggf. Hinzuziehen von Neurochirurgen und Orthopäden.
Oligometastastasiertes
Stadium IV [3, 4, 7]
Patienten mit Lungenkarzinom und einer solitären Nebennieren-Metastase oder bis zu drei solitären ZNS Metastasen (ohne Hinweise auf extraadrenale bzw. extrazerebrale Metastasen) kann ein Therapiekonzept mit einem kombinierten lokalen kurativen Therapieansatz angeboten werden. Voraussetzung hierzu ist eine kurative Therapieoption sowohl für den Primärtumor als auch für die Metastasen. Primärtumoren mit mediastinaler Lymphknotenmetastasierung sind daher in der Regel ein Ausschluss-Kriterium. Die Staging-Diagnostik sollte eine adäquate Bildgebung zum Ausschluss weiterer Metastasen umfassen (PET-CT).
Die optimale lokale Therapie solitärer Nebennieren-Metastasen ist die Operation (laparoskopische Resektion), für solitäre ZNS-Metastasen (gesichert durch MRT-Diagnostik) die Operation oder Radiochirurgie jeweils mit Ganzhirnbestrahlung. Die Therapie der ZNS-Metastasen erfolgt in der Regel vor der Therapie des Primärtumors, nicht zuletzt wegen der deutlich schnelleren Erholung der Patienten von dem neuro- oder radiochirurgischen Eingriff und der dadurch bedingten Verkürzung der Gesamt-Therapiedauer.
Palliative chirurgische Therapie
Die chirurgische Therapie bei Patienten mit Lungenkarzinom kann neben der kurativen Zielsetzung bei bedingter oder sicherer kurativer Inoperabilität auch eine palliative Zielsetzung verfolgen. Indikationen sind:
Lungenabszess oder einschmelzende Retentions-Pneumonie,
Hämoptoe,
unbeeinflussbare Schmerzen bei Tumoreinbruch in die Brustwand nach Versagen anderer Therapien.
Die Indikation zur Operation – insbesondere mit primär palliativer Zielsetzung – ist immer eine Individualentscheidung. Sie sollte interdisziplinär unter kritischem Abwägen der Risiken und des zu erwartenden palliativen Nutzens für den Patienten getroffen werden.

Prof. Dr. med. Hans Hoffmann
Thoraxklinik am
Universitätsklinikum Heidelberg
Amalienstraße 5
69126 Heidelberg
Tel.: 06221/396-1101
Fax: 06221/396-1102
hans.hoffmann[at]med.uni-heidelberg[dot]de

