Neuroendokriner Tumor des Pankreas
Kasuistik
Der Fall:
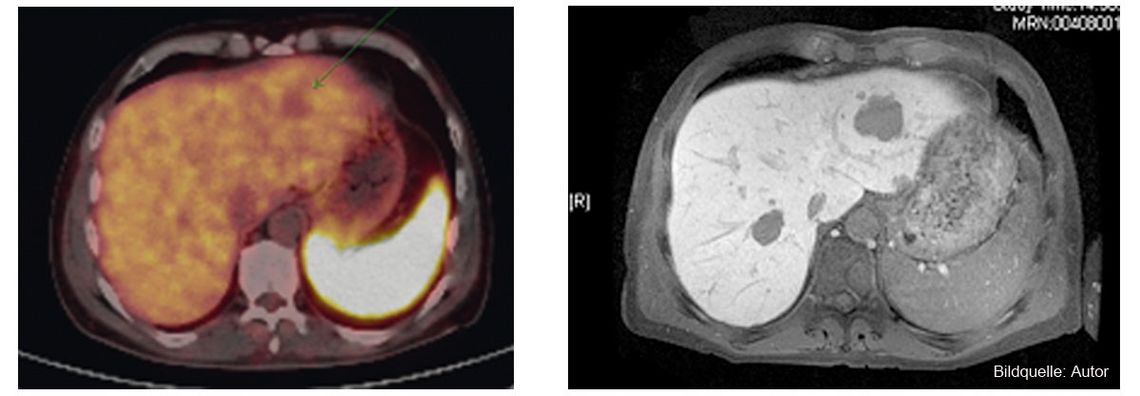
Ein männlicher Patient (Jahrgang 1972, verheiratet, ein Kind) stellt sich im August 2009 mit einem schmerzlosen Ikterus erstmals in einer externen Klinik vor. Ein 23 mm großer Pankreaskopf-Tumor, der mittels Pylorus-erhaltender partieller Pankreatikoduodenektomie (PPPD) reseziert wird, erweist sich als mäßig kernpleomorphes und gut differenziertes neuroendokrines Karzinom nach alter WHO-Klassifikation aus dem Jahr 2000 bzw. als neuroendokriner Tumor nach der neuen WHO-Klassifikation von 2010, der infiltrativ in das peripankreatische Fettgewebe eingewachsen und in die Venen eingebrochen ist (pT3N0, G2). Beim Restaging an der Charité im Januar 2010 ergibt sich im 68Ga-DOTATOC-PET/CT (Abb. 1 links) ein Verdacht auf Somatostatin-Rezeptor-negative Lebermetastasen, die wenig später im Kontrastmittel-MRT bestätigt (Abb. 1 rechts) und retrospektiv auch im präoperativen MRT gefunden werden.
Verlauf:
Im Februar 2010 wird deshalb mit einer Kombinations-Chemotherapie aus Streptozotocin und 5-Fluorouracil begonnen, für die Remissionsraten von in 30–60% der Fälle und Überlebenszeiten von im Median 18–24 Monaten beschrieben sind [1]. Ziel ist im konkreten Fall die Proliferationskontrolle und im günstigsten Fall das Erreichen einer sekundären Resektabilität der Leberfiliae. Trotz dreifacher Antiemese zeigt sich eine erhebliche gastrointestinale Toxizität des Streptozotocin, die eine Umstellung auf das FOLFOX-4-Schema erforderlich macht [2]. Ein Primovist-MRT nach drei Monaten zeigt die Progredienz der Metastasen. Aufgrund der erst kurz vorher erfolgten Therapieumstellung wird die FOLFOX-Behandlung trotzdem fortgesetzt und mit lokoregionärer Hyperthermie kombiniert. Eine Neuropathie wird nicht beobachtet. Nach wiederum drei Monaten ist im CT zunächst eine Wachstumskontrolle im Sinne einer Erkrankungsstabilisierung zu erkennen, doch im Oktober 2010 ist die Erkrankung erneut in der Leber progredient; an der Stelle des resezierten Primärtumors ist ferner ein mutmaßliches Lokalrezidiv zu erkennen.
Die Therapie wird auf die orale Chemotherapie-Kombination mit Temozolomid und Capecitabin (TEMCAP) umgestellt, für die Ansprechraten bis zu 70% beschrieben werden [3], aber bereits zwei Monate nach Therapiebeginn muss der Patient mit einer rezidivierenden, lebensbedrohlichen Blutung aus Varizen im Bereich der Gastrojejunostomie stationär aufgenommen werden. Die initial äußerst schwierige Blutstillung gelingt schließlich mittels Histoacryl-Sklerosierung, aber im CT zeigt sich unter der insuffizienten Chemotherapie eine leichte weitere Progression der Erkrankung, auch wenn diese die RECIST-Kriterien noch nicht erfüllt. Die Fortsetzung von TEMCAP führt bis März 2011 zu einer Krankheitsstabilisierung, aber intermittierende pektanginöse Beschwerden machen – nach koronarangiografischem Ausschluss einer arteriosklerotisch bedingten koronaren Herzerkrankung – eine Reduktion der Capecitabin-Dosis auf 75% erforderlich. Das CT vom August 2011 zeigt wiederum einen langsamen, aber stetigen und inzwischen RECIST-wirksamen Progress. Im gleichzeitig angefertigten 68Ga-DOTATOC-PET/CT ist weiter keine ubiquitäre Somatostatin-Rezeptor-Expression erkennbar, weshalb eine Peptid-Rezeptor-Radionuklid-Therapie (PRRT) nicht sinnvoll erscheint. Wegen des Verdachts auf Dedifferenzierung wird eine Biopsie veranlasst, die weiterhin ein G2-NET mit einem Ki67-Index von 15% ergibt. Im 18FDG-PET/CT vom November 2011 sind keine gesteigerte Glukoseaufnahme und keine Hinweise auf Dedifferenzierung mit konsekutiver Steigerung des Glukosemetabolismus zu erkennen.
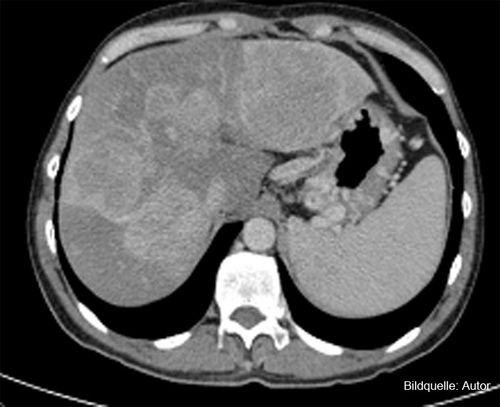
Die Behandlung mit dem mTOR-Inhibitor Everolimus, die nun begonnen wird, führt zu einer 14 Monate lang anhaltenden Krankheitsstabilisierung (laut CT vom Januar 2013, Abb. 2). Die Therapie ist sehr gut verträglich, der Patient verliert allerdings bei sonst sehr gutem Allgemeinzustand 8 kg Gewicht, ist aber gut belastbar und wieder voll berufstätig. Ein erneutes CT im April 2013 zeigt weiter Stabilität der Metastasen, aber eine erneute Progredienz des Lokalrezidivs, was einer Zeit bis zur Progression von 17 Monaten entspricht. Das ist ein sehr gutes Ergebnis: In der Zulassungsstudie für Everolimus hatte die mediane progressionsfreie Überlebenszeit bei pankreatischen NET bei elf Monaten gelegen [4]. Leider kommt es in der Folge zu einer erneuten, nicht stillbaren Blutung von Varizen im Bereich des Lokalrezidivs; nach Infektion, Sepsis, Beatmungspflichtigkeit verstirbt der Patient im Juni 2013.
Diskussion
Die sequenzielle, multimodale Therapie ist die Regel bei neuroendokrinen Tumoren. Chemotherapie (und bei positivem Rezeptor-Nachweis auch PRRT) haben das Potenzial, Tumorzellen abzutöten oder zumindest ihr Wachstum zu bremsen. Eine objektive Rückbildung ist aber nicht immer erreichbar und konnte auch in diesem Fall nicht erzielt werden. Von allen eingesetzten Therapien konnte Everolimus die längste Progressionsfreiheit erreichen – alle drei eingesetzten Chemotherapie-Kombinationen konnten hingegen bei diesem Patienten die in den entsprechenden Studien erzielten medianen Zeiten bis zur Progression nicht erreichen (Streptozotocin/5-FU: 4 vs. 13 Monate, FOLFOX: 6 vs. 12 Monate, TEMCAP: 10 vs. 12 Monate), lediglich Everolimus übertraf die erwartete progressionsfreie Überlebenszeit von elf Monaten mit letztlich 14 Monaten deutlich.
Literatur
1. Pavel ME et al. Streptozocin-based chemotherapy in patients with advanced pancreatic neuroendocrine tumors. J Clin Oncol 32, 2014 (suppl 3); ASCO-GI 2014, Abstract #295.
2. Bajetta E et al. Are capecitabine and oxaliplatin (XELOX) suitable treatments for progressing low-grade and high-grade neuroendocrine tumours? Cancer Chemother Pharmacol 2007; 59: 637-42.
3. Strosberg JR et al. First-line chemotherapy with capecitabine and temozolomide in patients with metastatic pancreatic endocrine carcinomas. Cancer 2011; 117: 268-75.
4. Yao JC et al. Everolimus for advanced pancreatic neuroendocrine tumors. N Engl J Med 2011; 364: 514-23.
Dr. med. Ulrich-Frank Pape
Medizinische Klinik mit
Schwerpunkt Hepatologie und Gastroenterologie
Campus Mitte & Campus Virchow-Klinikum
Charité Universitätsmedizin Berlin
Augustenburger Platz 1, 13353 Berlin
Tel.: 030/450 665 209
Fax: 030/450 553 942
ulrich-frank.pape[at]charite[dot]de

