Companion Diagnostics bei soliden Tumoren: Basis für selektive Therapien
Companion Diagnostics (CDX) gehören zu den wichtigsten Bausteinen der personalisierten Medizin und gewinnen vor
allem in der Onkologie immer mehr Bedeutung, da sie die Wahl einer gegen bestimmte Zielmoleküle gerichteten Therapie (targeted therapy) ermöglichen.
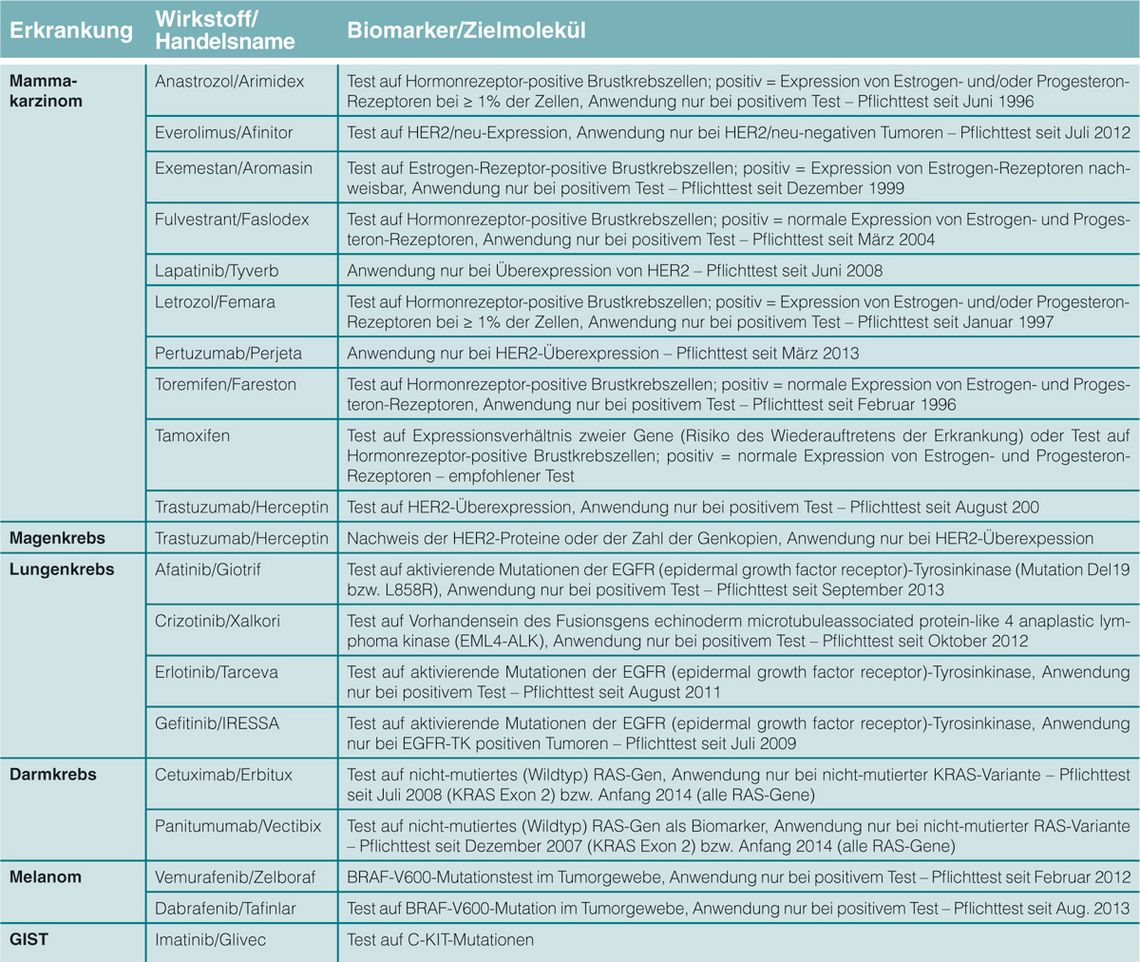
Mamma- und Magenkarzinom
Ein schon beinahe „klassisches“ Beispiel ist der HER2-Test, der bei Brustkrebs und inzwischen auch beim fortgeschrittenen Magenkarzinom eingesetzt wird. Für beide Entitäten ist die Behandlung mit dem
HER2-Rezeptor-Antikörper Trastuzumab nur zulässig, wenn im Tumorgewebe eine Amplifizierung des HER2-Gens oder eine Überexpression des HER2-Proteins nachgewiesen wurde
Gastrointestinaler Stromatumor (GIST)
Der Tyrosinkinaseinhibitor (TKI) Imatinib, zuerst in der Hämato-Onkologie zur Therapie der chronischen myeloischen Leukämie zugelassen (gegen die BCRABL-Tyrosinkinase), ist auch eines der potentesten Medikamente zur Behandlung
von Risikopatienten mit GIST. Charakteristische molekulare Veränderungen sind hier Mutationen des C-KIT- oder des PDGFRα-Rezeptors, die ebenso wie BCRABL Zielstrukturen für eine Behandlung mit Imatinib und anderen TKIs sind.
In diesen Tumoren ist eine sehr exakte Bestimmung der Mutation in den Zielgenen erforderlich, um den geeigneten TKI in passender Dosierung zu wählen. Mit Multikinase-Inhibitoren wie Sunitinib lassen sich Tumoren behandeln, die entweder auf Imatinib von vornherein schlecht
ansprechen oder im Verlauf Resistenzen entwickeln, die mit einem spezifischen Mutationsspektrum einhergehen.
Kolorektales Karzinom
Wie BCR-ABL-und C-KIT-Kinase ist auch der Rezeptor für den epidermalen Wachstumsfaktor (EGFR) ein übergeordneter Regulator, dessen Hemmung nachgeschaltete Signalwege inaktiviert. Für den EGFR konnte schon früh gezeigt werden, dass man durch Hemmung der
Ligandenbindung einen Wachstumsarrest in den Tumorzellen erreicht. Blockierende monoklonale Antikörper wie Cetuximab und Panitumumab werden in Kombination mit Chemotherapie bei Patienten mit metastasiertem kolorektalem Karzinom (mKRK) eingesetzt.
Die Medikamente entfalten ihre Wirkung jedoch nur, wenn die nachgeschalteten Gene des Signalweges nicht mutiert sind. Dazu gehören nach derzeitigem Stand der Erkenntnisse die Exone 2, 3 und 4 der Gene KRAS und NRAS. Wenngleich die S3-Leitlinie für KRK
bislang nur die Bestimmung des Mutationsstatus von KRAS vorsieht, sollte beim KRAS-Wildtyp auch NRAS untersucht werden; liegen Mutationen in mindestens einem der genannten Exone vor, ist ein Therapieversagen wahrscheinlich.
Lungenkarzinome
Zur Therapie des nicht-kleinzelligen Lungenkarzinoms (NSCLC) werden ebenfalls Kinaseinhibitoren (Gefitinib oder Erlotinib) eingesetzt, anders als beim KRK aber nur, wenn Mutationen im EGFR-Gen nachgewiesen wurden. Wie beim KRK werden auch bei NSCLC prätherapeutisch die Hotspot-Mutationen bestimmt, nachdem zuvor im Gewebeschnitt mittels Mikrodissektion die Tumorregion isoliert wurde. Im EGFR-Gen sind ebenfalls Resistenzmutationen (z. B. T790M) bekannt, die eine Bindung der TKIs verhindern.
EGFR-Mutationen findet man in 15–20%, KRAS-Mutationen in etwa 25% der NSCLC. Gleichzeitiges Vorkommen beider Mutationen wurde bislang interessanterweise noch nicht beobachtet. Als neues zielgerichtetes Medikament wurde 2012 Crizotinib beim NSCLC zugelassen.
Sein Target: Eine chromosomale Umlagerung mit Inversion auf Chromosom 2p führt zum Fusions-Onkogen EML4-ALK, das für ein Protein mit einer intrazellulären Kinase-Domäne von ALK kodiert, das ursprünglich in anaplastischen Lymphomen nachgewiesen wurde (ALK = Anaplastic Lymphoma Kinase). Auch hier besteht der therapeutische Ansatz in der Hemmung der ALK-Tyrosinkinase. Lediglich etwa 5% aller Patienten mit NSCLC haben diese genetische Veränderung und profitieren von dieser Therapie.
Malignes Melanom
Ein weiteres Beispiel einer zielgerichteten Therapie mit begleitendem Diagnostikum ist der BRAF-Inhibitor Vemurafenib beim malignen Melanom. In etwa 50% aller Melanome der Haut findet man eine Mutation im Exon 15 des BRAF-Gens, bei akralen, mukosalen und Melanomen der Uvea lediglich in 15%, 5% bzw. weniger als 1% der Fälle. Für den Einsatz des Medikaments ist seit Februar 2012 der Nachweis einer BRAF-V600-Mutation zwingend vorgeschrieben. Ebenfalls eine Rolle beim malignen Melanom spielen Mutationen im NRAS- und C-KIT-Gen.
Escape-Mechanismen
Die Beispiele zeigen, dass zielgerichtete Krebstherapien bereits klinischer Alltag sind. In den meisten Fällen kommt es aber zur Resistenzentwicklung durch Escape-Mutationen, die unter der Therapie manifest werden und die Tumorzellen vom betreffenden Target unabhängig machen. Das Tumorwachstum kann dann nicht mehr gestoppt werden.
Für alle genannten Tumorentitäten sind diese Mechanismen bekannt. Die Frage, ob die ursächlichen Mutationen unter der Therapie entstehen oder bereits zum Zeitpunkt der Diagnose im Tumor vorhanden sind, ohne dass sie detektierbar sind, ist nicht abschließend geklärt.
Next Generation Sequencing
Nach wie vor ist die histopathologische Begutachtung der Goldstandard bei der Diagnostik von Tumorerkrankungen. Die Auswahl der Tumorareale ist entscheidend für die Erfassung therapierelevanter Genmutationen, während moderne
Sequenziertechnologien (Next Generation Sequencing) beim Nachweis von Subklonen eine Rolle spielt. Dieses schrittweise Vorgehen erlaubt ein effektives Tumormonitoring und lässt wichtige Rückschlüsse auf die „Tumor-Evolution“ zu. Durch die frühe und präzise Erfassung
relevanter genetischer Veränderungen im Tumor kann ein Anfangsprofil erstellt werden, das als Grundlage für das weitere Monitoring während und nach der Therapie dient. Die Morphologie bestimmt nach wie vor die Diagnoserichtung in der Onkologie
und wird durch die molekulare Pathologie, zunehmend mit den Methoden der Companion Diagnostics, erweitert. Wesentlich für eine patientenorientierte Nutzung der Ergebnisse wird die enge interdisziplinäre Zusammenarbeit in onkologischen Zentren sein.

Prof. Dr. med. Barbara Dockhorn-Dworniczak
Zentrum für Pathologie Kempten-Allgäu
Gemeinschaftspraxis am Klinikum Kempten
Robert-Weixler-Straße 48, 87439 Kempten
Tel.: 0831/512 99-0 oder -11
dockhorn[at]patho-kempten[dot]de

