Neue Erkenntnisse der letzten Jahre zeigen, dass der Zellstoffwechsel nicht nur ein Nebenprodukt der Zellaktivierung ist. Welche Nährstoffe aufgenommen und wie sie verarbeitet werden wird nicht nur von den Energiebedürfnissen der Zelle bestimmt, sondern ist eng mit deren Funktion verknüpft. Man ist was man isst – dies gilt nun auch für Immunzellen. Da man durch die Veränderung des Zellstoffwechsels die Funktion der Zellen modulieren kann, eröffnet uns der Forschungsbereich des Immunmetabolismus neue Wege, das Immunsystem zu manipulieren. Metabolische Inhibitoren könnten in Zukunft verwendet werden, um die Immunantwort in autoimmunen Erkrankungen oder bei Organtransplantation zu steuern oder um Immuntherapien effektiver zu machen.
Schlüsselwörter: Immunmetabolismus, Metabolismus, Immunsystem, Glykolyse, Oxidative Phosphorylierung
Einleitung
Zum ersten Mal hört man möglicherweise in der Schule etwas über den Zellmetabolismus, wenn auf die Funktion der Mitochondrien eingegangen wird. Während dieser Zeit findet man die kleinen Eindringlinge, die in unseren Zellen leben, für uns Energie generieren, aber auch über den Zelltod entscheiden, vielleicht interessant. Die Begeisterung für den Zellstoffwechsel schwindet aber, wenn man tiefer in die verschiedenen Zellstoffwege eindringt und man sich mit komplexen metabolischen Reaktionen auseinandersetzen muss. In der Vergangenheit fühlten sich bei der Erwähnung von Zellmetabolismus daher nicht viele Immunologen angesprochen. Was ist schon Spannendes dabei, wenn Zellen Nährstoffe aufnehmen und in Energie und Biosynthesevorläufermoleküle umwandeln? Eine Zelle, die proliferiert, nimmt mehr Nährstoffe auf als eine ruhende Zelle – so what? Wieso sollte man sich der Erforschung des Metabolismus widmen? Die letzten Jahre brachten die überraschende Erkenntnis, dass der Metabolismus der Immunzellen nicht nur ein passiver Prozess ist, der sich den Energiebedürfnissen der Zelle anpasst. Im Gegenteil, er wird dynamisch reguliert und spielt eine aktive Rolle in der Steuerung der Immunantwort. So konnte man zeigen, dass sich die verschiedenen Immunzelltypen in ihrem metabolischen Profil unterscheiden und der Zellstoffwechsel die Entwicklung und Funktion der Immunzellen steuern kann [1–3]. Durch die interessanten Erkenntnisse der letzten Jahre werden nun immer mehr Immunologen dazu motiviert, ihre alten Biochemie-Lehrbücher zurate zu ziehen und die metabolischen Vorgänge in Immunzellen besser zu untersuchen.
Grundlagen des Zellstoffwechsels
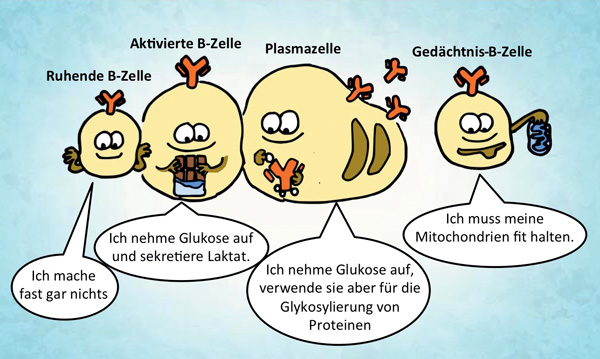
Vor allem die Erkenntnisse der Krebsforschung machten den Zellstoffwechsel zu einem faszinierenden und lohnenden Forschungsgebiet. Schon Anfang des vorigen Jahrhunderts beobachtete der deutsche Nobelpreisträger Otto H. Warburg, wie Krebszellen trotz der Gegenwart von Sauerstoff ihren Stoffwechsel radikal verändern, viel Glukose aufnehmen und Laktat sekretieren. Um Energie zu gewinnen, wird Glukose im Zytosol in mehreren aufeinanderfolgenden Schritten zu Pyruvat abgebaut, ein Vorgang, der als Glykolyse bezeichnet wird. Pyruvat kann weiter zu Laktat vergärt und aus der Zelle ausgeschieden werden. Bedient sich die Zelle nur der Glykolyse zur Energiegewinnung, kann sie pro Glukosemolekül zwei Moleküle ATP generieren. Alternativ zur Vergärung kann Pyruvat jedoch auch in die Mitochondrien eingeschleust werden und dort im Citratzyklus (auch Krebs- oder Tricarbonsäurezyklus genannt) vollständig zu CO2 oxidiert werden. Der Citratzyklus stellt eine zyklische Reaktionskette dar; hier werden die Reduktionsäquivalente Nicotinamid-Adenin-Dinukleotid (NADH) und Flavin-Adenin-Dinukleotid (FADH2) hergestellt, die anschließend an die Proteine der Atmungskette weitergereicht werden, um dort als Elektronendonatoren zu dienen. Die Energie, die durch die stufenweise Übertragung von Elektronen auf Sauerstoff frei wird, treibt die Synthese von ATP an. Diesen Prozess nennt man oxidative Phosphorylierung. Eine Zelle, die Glukose vollständig oxidiert, kann pro Molekül Glukose bis zu 36 Moleküle ATP gewinnen. Dieser Stoffwechselweg ist also eindeutig energieeffizienter, verglichen mit dem verkürzten Prozess in Richtung der Laktatsekretion. Wieso bevorzugen Krebszellen also einen Stoffwechselweg mit geringerer Energieeffizienz? Man könnte geneigt sein, die hohe Mutationsrate der Krebszellen als Ursache für dieses sonderbare Verhalten zu sehen. Krebszellen sind ja nicht „normal“, womöglich entspricht dieses metabolische Profil durchaus ihrem, durch Mutationen entstandenen, abnormalen Zustand. Inzwischen hat man aber die verstärkte Sekretion von Laktat auch bei aktivierten, gesunden Immunzellen beobachtet. Sie ist somit eher ein Kennzeichen für stark proliferierende Zellen und nicht das Resultat maligner Entartung.
Der Vorteil, Glykolyse zu betreiben, könnte darin liegen, dass dieser Prozess auch unter Sauerstoffmangel stattfinden kann. Im Gegensatz dazu ist Sauerstoff als Elektronenakzeptor für die oxidative Phosphorylierung absolut notwendig. Die Fähigkeit, Energie unter Sauerstoffmangel zu erzeugen, ist deshalb für Krebszellen vorteilhaft, da die Sauerstoffversorgung in Tumoren mangelhaft sein kann. Sauerstoffmangel scheint aber weder der einzige noch der wichtigste Grund zu sein, warum stark proliferierende Zellen verstärkt Laktat sekretieren. Krebszellen oder aktivierte Immunzellen vergären Glukose auch in Situationen, in denen ausreichend Sauerstoff vorhanden ist (aerobe Glykolyse). Die hohe Laktatsekretion scheint eine schnelle Zellteilung auf vielfache und komplexe Art und Weise zu unterstützen. Wie das? Unter anderem könnte ein starker glykolytischer Fluss den Zellen ermöglichen, glykolytische Intermediate abzuzweigen, die für die Biosynthese von Nukleotiden wichtig sind. Außerdem wird bei der Laktaterzeugung NAD+ regeneriert – ein wichtiger Co-Faktor für die Biosynthese. Möglicherweise beeinflusst der glykolytische Fluss auch weitere Vorgänge in den Zellen. Die Vorteile, die die aerobe Glykolyse mit sich bringt, werden in der Literatur immer noch stark diskutiert [4].